Samenvatting
Verwekker: Marburgvirus en ebolavirus
Incubatieperiode: 2 tot 21 dagen, meestal 9 dagen
Besmettingsweg: Direct fysiek contact met besmette personen (of de lichamen van personen die zijn overleden aan ebola of marburg) en direct contact met hun lichaamsvloeistoffen. Ook via infectieuze, wilde dieren.
Besmettelijke periode: Gedurende de gehele symptomatische periode, en convalescentie periode
Maatregelen: Meldingsplicht groep A2, brononderzoek op indicatie. Contactonderzoek en -monitoring. Strikte isolatie. Beschermende kleding, handschoenen, ademhalingsbeschermingsmasker type FFP2. Postexpositieprofylaxe
Symptomen: Acuut met algehele malaise, koorts, hoofdpijn en myalgie. Meestal keelpijn, misselijkheid, braken, buikpijn, diarree, pijn op de borst en hoesten. Een deel krijgt petechiën, ecchymosen en mucosale bloedingen
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 24 september 2024
Wijzigingen vanaf laatste vaststelling LOI:
- 3 juli 2025: transmissieroute dier naar mens is toegevoegd onder Besmettingsweg.
- 18 maart 2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en waar van toepassing arbeidsrelevante aanvullingen en veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen.
- 27 januari 2025: Tekst voor vervoer patiënten met koorts (met of zonder andere klachten) is aangepast:
altijd in overleg met de regionale GGD (Gemeentelijke gezondheidsdienst) en het triage/behandelcentra voor VHK. - 10 oktober 2024: tekst onder kopje Contacten ingedeeld als ‘incidenteel contact’ is licht aangepast.
- 2 oktober 2024: publicatie herziene versie. Richtlijn herzien door Rosa Joosten in samenwerking met Edwin Slok en Linda Smid (LCI/RIVM). Hoofdstuk diagnostiek wordt nog vastgesteld. Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn:
- Incubatieperiode: aangepast naar gemiddeld 9 dagen (range 2-21 dagen).
- Ziekteverschijnselen: ingedeeld in 4 verschillende fases.
- Volledige herziening van natuurlijke immuniteit.
- Transmissie: expliciet gemaakt wat verstaan wordt onder lichaamsvloeistoffen. Paragrafen herschreven en literatuur geactualiseerd.
- Herziening van de diagnostiekparagraaf.
- Verhoogde kans op infectie: toegevoegd dat het risico gaat om onbeschermd contact, en dat dit ook kan bij overleden personen.
- Actualisatie van de epidemiologische gegevens.
- Preventie: informatie toegevoegd over 2 ebolavaccins met een licentie in de EU (Europese Unie) (Ervebo; Zabdeno en Mvabea).
- Meldingsplicht: aangepast conform ECDC (European Centre for Disease Prevention and Control), uniform voor de 3 VHK-richtlijnen.
- Contactonderzoek: incidenteel contact toegevoegd. Bij laag risico: naast personen die met PBM contact hebben gehad, toegevoegd ‘of geen direct contact hebben gehad’.
- Maatregelen t.a.v. patiënt en contacten: de maatregelen van de risicocontacten verplaatst naar maatregelen t.a.v. patiënt en contacten. Bij hoog risicocontacten dient individuele evaluatie plaats te vinden door een internist-infectioloog t.a.v. mogelijkheden voor postexpositieprofylaxe. Wanneer een patiënt t.g.v. VHK komt te overlijden, hoeft geen contact meer te worden opgenomen met de regionale inspecteur voor de gezondheidszorg. Het is om een periode na herstel beschermd seksueel contact te hebben met condoom.
- Bijlagen Vervoer verdachte patiënten, Diagnostiek ebola marburg en Reinigen en desinfecteren van ruimtes in de thuissetting) zijn herzien.
- Bijlagen Casusdefinities en Behandeling marburg zijn vervallen.
Achtergronden
Verwekker
Filovirussen bevatten enkelstrengs RNA en vallen onder de orde Mononegavirales. De familie der Filoviridae bestaat uit twee genera: marburg- en ebolavirus, die marburgvirusziekte (MARV) en ebolavirusziekte (EVD) kunnen veroorzaken. Beide zijn zoönosen (Feldmann 2020). De viruspartikels verlaten de cel door zich af te splitsen van het celmembraan, waarbij een envelop wordt gevormd. Aan de buitenzijde van deze envelop worden glycoproteïnen tot expressie gebracht. Met virus geïnfecteerde cellen produceren ook virale glycoproteïnen die in de extracellulaire ruimte worden uitgescheide (Kuhn 2019).
Van marburgvirus is op dit moment 1 species bekend, van ebolavirus zijn er 5 species bekend, met eigen specifieke kenmerken, en weinig/geen kruisreactiviteit met name tussen het Zaïre-ebolavirus (ZEBOV) en Soedan-ebolavirus (SEBOV), Reston-ebolavirus (REBOV), Tai Forest-ebolavirus (voorheen Ivory Coast of Cote d'Ivoire ebolavirus, ICEBOV of CIEBOV) en Bundibugyo-ebolavirus (BEBOV) (Feldmann 2014).
Daar waar in deze richtlijn over (filo)virus wordt gesproken, wordt alle 5 verschillende species bedoeld. Indien er een specifiek virus wordt bedoeld of er enkel informatie beschikbaar is over een specifiek virus, wordt dit expliciet genoemd.
Epidemiologie
Verspreiding in de wereld
Grote delen van West-, Oost- en Centraal-Afrika behoren tot het natuurlijke verspreidingsgebied van de filovirussen (Coltart 2017, Rojek 2019, Sneller 2019). Ebola Reston, waarvan enkel asymptomatische humane infecties zijn gerapporteerd, heeft op de Filippijnen zijn natuurlijk reservoir (Peterson 2004). Sinds de eerste metingen van het voorkomen filovirussen, in 1976, zijn er zo’n 35.000 gevallen van filovirus-hemorragische koorts gerapporteerd. Ongeveer 15249 patiënten (44%) overleefden de infectie niet (CDC 2022). Uitbraken van filovirus-hemorragische koorts komen incidenteel in de hierboven beschreven Afrikaanse gebieden voor. Voor een overzicht van de huidige endemische gebieden, zie: WHO.
Voorkomen in Nederland
In Nederland komen het marburg- en ebolavirus niet endemisch voor. Wel zijn er in 2008 en 2014 (geplande) overnames geweest van besmette personen die infectie in het buitenland hadden opgelopen.
Pathogenese
Aanvankelijk vindt virusreplicatie vooral plaats in macrofagen en dendritische cellen, die in het lymfeweefsel terechtkomen. Tijdens deze eerste fase treedt er vanuit het lymfeweefsel disseminatie van het virus op naar een groot aantal weefsels en organen. Filovirussen zijn in staat om zeer uiteenlopende celtypen te infecteren, wat leidt tot uitgebreide weefselnecrose. Via verschillende routes wordt de immuunrespons zeer efficiënt geblokkeerd. De onderdrukking van de adaptieve immuunreactie en apoptose van niet-geïnfecteerde T-lymfocyten, een proces waarvan het mechanisme nog onopgehelderd is, is hier waarschijnlijk een belangrijk onderdeel van (Malvy 2019, Prescott 2017). Geïnfecteerde macrofagen scheiden grote hoeveelheden cytokinen en chemokinen af. Hierdoor ontstaan vaatlekkage, diffuse intravasale stolling en algeheel orgaanfalen, uiteindelijk leidend tot shock. Het tot expressie brengen van tromboplastine (tissue factor) door geïnfecteerde macrofagen leidt tot activering van stollingsfactor VII en daarmee eveneens tot het ontstaan van diffuse intravasale stolling (Abir 2022).
Incubatieperiode
Meestal 9 dagen (range, 2-21 dagen) (Kimberlin 2021, WHO 2021). Data van de West-Afrika-uitbraak in 2014-2016 liet zien dat kinderen gemiddeld een kortere incubatieperiode hebben dan volwassenen (Kimberlin 2021).
Ziekteverschijnselen
Ziekteverschijnselen variëren van mild tot zeer ernstig met een gemiddeld overlijdensrisico van circa 50%, dat bij de beschreven uitbraken varieert tussen 25 en 90% (Kawuki 2021, Kimberlin 2021). Studies hebben tevens aangetoond dat asymptomatisch doormaken van een infectie mogelijk is (Dean 2016, Gayedyu-Dennis 2023).
Qua presentatie kunnen verschillende fasen worden onderscheiden (ECDC 2022):
- Fase 1, prodromale fase (tot 10 dagen): acuut begin met een griepachtig beeld bestaande uit koorts, algehele malaise, spier- en gewrichtspijn, hoofdpijn, gevolgd door malaiseanorexie, diarree (waterige ontlasting die soms bloed en slijm bevat), misselijkheid en braken. Tijdens deze eerste fase kunnen deze symptomen in meer of mindere mate aanwezig zijn (Feldmann 2020, West 2014).
- Fase 2 (dag 1-6) wordt gekarakteriseerd door progressie van zwakte/malaise en klinische manifestaties van verschillende orgaansystemen. Symptomen kunnen zijn gastro-intestinaal (overgeven, diarree, anorexie en buikpijn); neurologisch (hoofdpijn, verminderde alertheid); vasculair (conjunctivale/faryngeale vaattekening); cutaan (rond de vijfde ziektedag ontwikkelt ongeveer 20% van de patiënten een maculopapulaire huiduitslag) of respiratoir (hoesten, pijn op de borst en kortademigheid). Hemorragische manifestaties kunnen zich ook voordoen door stollingsstoornissen en door vaatschade/lekkage (bloederige diarree, neusbloedingen, bloedbraken, petechiën, ecchymosen, tot zelfs profuse interne en externe bloedingen en een diffuse intravasale stolling (DIS)).
- Fase 3 (dag 7-8): In de tweede ziekteweek ziet men in de regel het begin van klinisch herstel óf een verdere klinische verslechtering. Patiënten met bloedingen of encefalopathie hebben een slechte prognose (overlijden vrijwel allemaal).
- Fase 4 (vanaf dag 9) waarbij patiënten sterven aan een combinatie van multi-orgaanfalen, electrolytverstoringen en hypovolemische shock door ernstig vochtverlies. Indien een patiënt herstelt dan duurt het klinische herstel lang. Gedurende deze periode kunnen complicaties optreden zoals orchitis, hepatitis, myelitis, otitis en uveïtis (Sneller 2019).
De laboratoriumwaarden laten aanvankelijk vaak een leukopenie/lymfopenie zien, gevolgd door neutrofilie, trombocytopenie en afwijkende stollingsparameters. De aminotransferase serumspiegels kunnen sterk verhoogd zijn, waarbij de ASAT-waarde hoger is dan de ALAT (alanine aminotransferase)-waarde met matig verhoogd AF en gamma GT (Feldmann 2020, Hunt 2015).
Asymptomatische of weinig-symptomatische EBOV-geïnfecteerde patiënten kunnen een voor PCR niet detecteerbaar viremie hebben, waarbij infectie na zo’n 3 weken wel detecteerbaar is door bepaling van een IgG (immunoglobuline G) en IgM (immunoglobuline M) respons (Jacob 2020, Kelly 2022).
Natuurlijke immuniteit
Uit serologisch onderzoek onder patiënten die een ebolavirusinfectie overleefden blijkt dat er voor een langere periode neutraliserende antilichamen en een verhoogde T-celrespons is (Thom 2021). IgM-antilichamen bleven in een studie onder overlevenden positief tussen de 30 en 168 dagen na doormaken van infectie (Ploquin 2018, Rowe 1999). Het is niet bekend in hoeverre de aanwezigheid van (neutraliserende) antistoffen ook bescherming biedt tegen nieuwe blootstelling aan hetzelfde of een ander filovirus.
De sera van Marburgpatiënten toonden een jaar na doorgemaakte infectie nog steeds een hoge reactiviteit (Natesan 2016). Het is onzeker of deze antilichamen beschermend zouden zijn in het geval van een nieuwe blootstelling aan hetzelfde of een ander filovirus (Moyen 2015, Natesan 2016).
Reservoir
Het dierenreservoir van ebola- en marburgvirus bestaat uit verschillende soorten herbivore vleermuizen, zonder dat zij symptomen vertonen (Leroy 2005). Het verspreidingsgebied van deze vleermuissoort omvat grote delen van Afrika: de Nijldelta en vrijwel het gehele continent ten zuiden van de Sahara (Kajihara 2019). Besmetting van in het Afrikaanse tropische regenwoud levende chimpansees, gorilla’s en antilopen met ebolavirus blijkt regelmatig voor te komen. Omdat deze infecties gepaard gaan met een zeer hoge mate van sterfte, is het onwaarschijnlijk dat deze diersoorten tot het natuurlijk reservoir behoren. Niettemin vormen besmette dieren een belangrijke schakel tussen het reservoir en de menselijke populatie: omdat het vinden, en in sommige gevallen slachten en eten van dode of zieke dieren tot besmetting van mensen kan leiden (Languon and Quaye 2019).
Transmissie
Besmettingsweg
Transmissie van filovirussen vindt plaats door direct contact met lichaamsvloeistoffen van besmette personen (of de lichamen van personen die zijn overleden aan een filovirusinfectie) en het daarna aanraken van de eigen slijmvliezen of direct contact met beschadigde huid (Geisbert 2020, Kimberlin 2021). Onder lichaamsvloeistoffen worden verstaan: bloed, weefsels, feces, urine, semen, speeksel, tranen, vaginaal vocht, vruchtwater, moedermelk, liquor, braaksel, oorsmeer en zweet. Volgens de WHO zijn de meest besmettelijke lichaamsvloeistoffen bloed, ontlasting en braaksel.
Filovirussen kunnen ook worden verspreid door direct contact met de huid van een patiënt, maar het risico op infectie door dit type blootstelling wordt als lager beschouwd dan door blootstelling aan bloed of lichaamsvloeistoffen. Virussen die op het huidoppervlak aanwezig zijn, kunnen het gevolg zijn van virale replicatie in de dermis of epidermis, door besmetting van de huid met bloed of andere lichaamsvloeistoffen, of beide (Bray and Chertow 2024, Feldmann 2020, Jacob 2020, Malvy 2019).
Ook het direct onbeschermd contact met overleden patiënten, zoals het ritueel wassen van slachtoffers op begrafenissen, heeft bij eerdere uitbraken een belangrijke rol gespeeld bij de verspreiding van infecties (Victory 2015).
Het filovirus kan worden overgedragen via indirect contact via besmette gebruiksvoorwerpen, dit komt echter minder frequent voor (CDC, 2021, Malenfant 2022). De secundaire attack rate (SAR) in huishoudens is in het algemeen tussen de 10% en 20% en hangt samen met de ernst van ziekte, leeftijd van de indexpatiënt (meer bij oudere patiënten) en vooral met direct fysiek contact (Dean 2016, Kimberlin 2021). Er zijn geen aanwijzingen dat besmetting plaatsvindt via hoesten (Agency 2021). Ook aerogene transmissie van ebolavirus dan wel marburgvirus van mens op mens is nooit aangetoond (CDC , Kimberlin 2021).
Daarnaast is transmissie mogelijk door fysiek contact met infectieuze, wilde dieren (levend of dood) en door het bereiden of eten van bushmeat (vlees van wilde dieren als apen, bosantilopes en vleermuizen). Ook bij het bezoeken van grotten of mijnen met vleermuiskolonies is er kans op transmissie. (ECDC 2023, WHO 2025).
Porte d’entrée
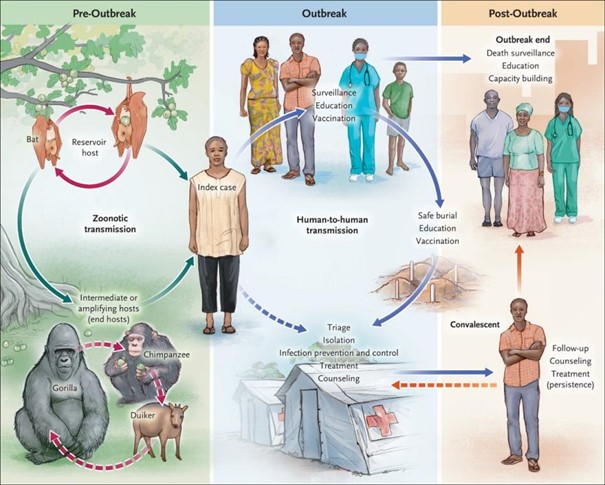
Slijmvliezen en conjunctivae dienen over het algemeen als porte d’entrée (Yeh 2018). In dierexperimenteel onderzoek lijkt infectie via de huid alleen plaats te vinden via laesies. Infectie via intacte huid is echter niet geheel uit te sluiten (Shu 1969). De transmissiecyclus van filovirussen is in onderstaande figuur helder weergegeven (Feldmann 2020).
Besmettelijke periode
Acute fase
De patiënt is gedurende de gehele periode van symptomen besmettelijk.
Convalescentieperiode
Filovirussen kunnen soms wel tot 3-4 maanden persisteren in bepaalde weefsels en lichaamsvloeistoffen zoals de borstklieren, testikels/semen, vaginaal vocht, placenta, vruchtwater, moedermelk, speeksel, het centraal zenuwstelsel (in het bijzonder in de liquor), gewrichten, conjunctivae en oogkamers, maar bij virale persistentie in de testikels kan die periode veel langer zijn (Crozier 2022, Schindell 2018). Het is onduidelijk welke mate van besmettelijkheid deze vloeistoffen hebben en hoe vaak zij voor transmissie zorgen. Individuele casuïstiek heeft dit echter wel laten zien via onbeschermd seksueel contact.
Besmettelijkheid
In de late fase van de ziekte, wanneer symptomen zoals braken, diarree, bloedingen en shock aanwezig zijn en kort na het overlijden is de besmettelijkheid het grootst. Het risico op ebolavirustransmissie is het grootst in de fase van ernstige ziekte of overlijden van de patiënt als er veel ebolavirus aanwezig is (Feldmann 2020, Jacob 2020, Malvy 2019).
Risicogroepen
Verhoogde kans op infectie
Tot de risicogroep voor virale hemorragische koorts met een filovirus behoren personen die:
- onbeschermd contact hebben gehad met bloed of andere lichaamsmaterialen/ of-vloeistoffen van (overleden) personen of dieren die (waarschijnlijk) besmet zijn met een van deze virussen (zie Besmettingsweg);
- of in contact zijn geweest met primaten en vleermuizen in gebieden waar het ebola- of marburgvirus circuleert (zie Verspreiding in de wereld).
Verhoogde kans op ernstig beloop
Een hoge leeftijd is gerelateerd aan een grotere kans op overlijden. Zo bedroeg tijdens de ebola-uitbraak in Kikwit in 1995 het sterftepercentage in de leeftijdscategorie van 15- tot 29-jarigen 69%, voor ouderen (>59 jaar), was dit met 96,5% significant hoger. De sterftepercentages bij mannen en vrouwen zijn ongeveer gelijk (Sadek 1999).
Zaïre-ebolavirus en Soedan-ebolavirus zijn het meest pathogeen, het Bundibugyo-ebolavirus geeft de laagste sterftecijfers (Kawuki 2021). Snelle diagnose, tijdig toegang hebben tot medische zorg en snelle start van goede ondersteunende therapie verkleint de kans op overlijden (Decker 2014, Liddell 2015).
Verhoogde kans op ernstig beloop bij zwangerschap
Zwangerschap lijkt niet geassocieerd met een hogere mortaliteit of ernstiger ziektebeloop van de moeder. In een recente systematic review en meta-analyse was het absolute risico op overlijden voor zwangeren geschat op 68% (CI 50-84), dit verschilde niet van vrouwen die niet zwanger waren. Spontane abortus en profuus vaginaal bloedverlies treden wel vaak op (Kayem 2021, WHO 2020). Vrijwel alle vrouwen die zwanger waren hadden gecompliceerde zwangerschapsuitkomsten ten gevolge van transplacentaire infecties. De perinatale mortaliteit is zeer hoog (>95%) (Kayem 2021). Het virus was in vruchtwater tot 32 dagen detecteerbaar en tot 26 dagen in moedermelk (Foeller 2020).
Behandeling
Er is geen specifieke therapie beschikbaar voor filovirusinfectie. Behandeling bestaat hoofdzakelijk uit ondersteunende maatregelen gericht op het bestrijden van complicaties. In augustus 2022 heeft de WHO een richtlijn gepubliceerd over de behandeling van infectie met het ebolavirus. Daarin wordt een aanbeveling gedaan voor de behandeling van PCR-bewezen ebolavirusinfectie veroorzaakt door het ebolavirus Zaïre met Ebanga (mAb114; ansuvimab) of Inmazeb (REGN-EB3: een cocktail van 3 monoklonale antistoffen atoltivimab, maftivimab en odesivimab). Deze aanbeveling geldt ook voor neonaten van 7 dagen of jonger van wie de moeder bewezen EVD heeft. Beide behandelingen zijn niet werkzaam tegen Sudan ebolavirusziekte.
Het zijn allebei intraveneuze middelen die zo spoedig mogelijk na vaststellen van de diagnose in een eenmalige dosis moeten worden toegediend naast de standaard ondersteunende therapie bij deze ernstig zieke patiënten. Voor een toedieningsschema, zie het WHO-document. De beschikbaarheid van deze ongeregistreerde middelen is zeer beperkt. Voor de mogelijke beschikbaarheid kan overlegd worden met de LCI (Landelijke Coördinatie Infectieziektebestrijding).
Voor achtergrondinformatie over de monoklonale antistoffen en de onderbouwing van het WHO-advies, zie bijlage Onderbouwing behandeling ebola.
Diagnostiek
Zie ook de bijlage Uitwerking diagnostiek bij patiënt met verdenking ebola/marburg. Zie tevens Diagnostisch Vademecum Ebola, Diagnostisch Vademecum Marburgvirus en Diagnostisch Vademecum hemorragische koortsen.
Microbiologische diagnostiek
Diagnostiek van virale hemorragische koorts wordt verricht door middel van genoomdetectie en serologie (Muzembo 2022). In Nederland wordt deze diagnostiek enkel uitgevoerd in het Erasmus MC (Medisch Centrum), Rotterdam, afdeling Viroscience, WHO collaborating center for Arboviruss and Hemorrhagic Fever reference and research tevens nationaal referentie laboratorium voor hemorragische koorts virussen. Vooraankondiging en overleg over het type materiaal, wijze van afname, de verpakking en de wijze van transport zijn noodzakelijk. Daarnaast is overleg met Erasmus MC, Viroscience noodzakelijk over mogelijkheden voor additionele, niet-microbiologische diagnostiek op BSL3-niveau.
Erasmus MC, Afdeling Viroscience verzorgt, in overleg met het RIVM (Rijksinstituut voor Volksgezondheid en Milieu) en indien nodig voor confirmatie per direct de inzending naar het Bernhard Nocht Institute for Tropical Medicine in Hamburg.
Diagnostiek naar filovirusinfectie is mogelijk door middel van keeluitstrijk (RT-PCR), neusuitstrijk (RT-PCR), sputum (RT-PCR), serum (serologie, RT-PCR), feces (RT-PCR) en urine (RT-PCR).
Adres en telefoonnummer:
WHO Collaborating Centre for Arbovirus and Hemorrhagic Fever Reference and Research
Erasmus MC, Afdeling Viroscience
Unit Klinische Virologie kamer NB-1052
Wytemaweg 80
3015 CN, Rotterdam
Tel: 010-7033431. Buiten kantooruren is de dienstdoende viroloog te bereiken via 010-7040704.
Overige microbiologische diagnostiek
Diagnostiek naar overige ernstige infectieziekten, zoals malaria tropica en bacteriële infecties, dient onder bioveiligheidsniveau 3, plaats te vinden. Virusisolatie en de inzet van kweken is bij vermoeden op virale hemorragische koorts enkel geoorloofd onder bioveiligheidsniveau 4.
Interpretatie resultaten
Positieve test (ebolavirus/marburgvirus-RNA aangetoond met RT-PCR). Negatieve test (geen ebolavirus/marburgvirus-RNA met RT-PCR aangetoond):
- Indien de test negatief is EN het materiaal minimaal 48 uur na ontstaan van symptomen is afgenomen, dan heeft de patiënt geen infectie met ebolavirus of marburgvirus. Indien het materiaal afgenomen is tijdens de eerste 48 uur na ontwikkeling van symptomen EN de patiënt heeft nog steeds symptomen passend bij ebolavirus of marburgvirus infectie, dan is een infectie met ebolavirus of marburgvirus niet geheel uitgesloten. Er dient dan een tweede materiaal afgenomen te worden minimaal 48 uur na ontstaan van symptomen en minimaal 24 uur na afname van het eerste sample.
- Indien het materiaal afgenomen is tijdens de eerste 48 uur na ontwikkeling van symptomen EN patiënt heeft geen van de symptomen meer passend bij ebolavirus of marburgvirus infectie, dan heeft de patiënt geen infectie met ebolavirus of marburgvirus.
- Bovenstaand beleid is onafhankelijk van een eventuele alternatieve diagnose.
- In individuele gevallen kan er in overleg met het RIVM besloten worden om materiaal ook door te sturen. Dan geldt gecombineerde uitslag Erasmus MC en 2e referentielaboratorium.
- In overleg met de viroloog van het Erasmus MC kan op indicatie worden besloten om IgM- en IgG-antistoffen te bepalen in serum.
Preventie
Immunisatie
Vaccinatie
Twee ebolavaccins hebben tot nu toe een licentie gekregen in de EU (Europese Unie), waaronder Ervebo: een levend verzwakt recombinant vesiculair stomatitisvirusvaccin (rVSV), bekend als rVSVΔG-ZEBOV-GP ebolavaccin, dat geregistreerd is voor volwassenen en kinderen ouder dan 1 jaar. Data van een onderzoek in Guinee waar dit vaccin gebruikt werd voor ringvaccinatie, toonde aan dat er snel bescherming werd bereikt, omdat er 10 dagen na een enkele dosis geen ziektegevallen meer waren (Henao-Restrepo 2017). Dit vaccin beschermt alleen tegen het Zaïre-ebolavirus.
Daarnaast is er een combinatievaccin, bestaande uit twee vaccins, Zabdeno en Mvabea, dat geregistreerd is vanaf de leeftijd van 1 jaar (EMA 2021a, b, 2022). Zabdeno bevat een adenovirusvector type 26 wat het ebolaglycoproteïne tot expressie brengt. Na dit vaccin volgt na 8 weken de heterologe boostervaccinatie met Mvabeadat viruseiwitten van Zaïre- en Sudan-ebolavirus, marburgvirus en Tai Forest-ebolavirus tot expressie brengt. Effectiviteitsdata ontbreken hier nog van.
Er is tot heden dan ook nog geen vaccin tegen marburg beschikbaar.
Passieve immunisatie
Er is geringe klinische ervaring met de toepassing van natuurlijke en monoklonale humane en dierlijke antistoffen gericht tegen filovirussen. Zie Profylaxe en Behandeling.
Algemene preventieve maatregelen
Zie Maatregelen ten aanzien van index, contacten en bron.
Reiniging, desinfectie en sterilisatie
Conform de richtlijn Standaardmethoden reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Tijdens het uitvoeren van werkzaamheden waarbij men mogelijk in contact komt met infectieus materiaal, dient men beschermende kleding te dragen volgens de (gedateerde maar nog geldende) WIP-richtlijn Virale Hemorragische koortsen. Zie ook voor het afvoeren van afval uit isolatiekamers, desinfectie van isolatiekamers en desinfectie van apparatuur de WIP-richtlijn Virale Hemorragische koortsen.
Maatregelen
Meldingsplicht
Virale hemorragische koorts is een meldingsplichtige ziekte groep A2. Dit houdt in dat artsen reeds bij het vermoeden van de infectieziekte dit direct (dus ook ’s avonds, ’s nachts, in het weekend of op nationale feestdagen) moeten melden aan de GGD (Gemeentelijke gezondheidsdienst). Het hoofd van het laboratorium meldt de vaststelling van de verwekker direct aan de GGD.
Clinici en GGD wordt verzocht om bij het vermoeden van virale hemorragische koorts direct contact op te nemen met de LCI (Landelijke Coördinatie Infectieziektebestrijding) (088-689 70 00, ook buiten kantoortijden). Indien dit nummer buiten kantoortijden onverhoopt geen gehoor geeft, dan graag de dienstdoende LCI-arts Infectieziektebestrijding op laten piepen door de meldkamer via telefoonnummer 088-061 28 22.
Klinische criteria
Elke persoon met ten minste één van de volgende twee:
- Koorts
- Hemorragische manifestaties in verschillende vormen die kunnen leiden tot falen van meerdere organen
Laboratoriumcriteria
Ten minste één van de volgende twee:
- Isolatie van een specifiek virus uit een klinisch monster
- Detectie van specifiek virusnucleïnezuur in een klinisch monster en bevestiging door sequencing of een tweede test op verschillende genomische doelwitten
Epidemiologische criteria
Ten minste één van de volgende:
- Reizen in de afgelopen 21 dagen naar een regio waar VHK-gevallen bekend zijn of vermoedelijk hebben plaatsgevonden
- Blootstelling in de afgelopen 21 dagen aan een waarschijnlijk of bevestigd geval van VHK waarvan het begin van de ziekte in de afgelopen 6 maanden plaatsvond
Casusclassificatie
- Waarschijnlijk geval: elke persoon die aan de klinische criteria voldoet en een epidemiologisch verband heeft
- Bevestigd geval: elke persoon die voldoet aan de klinische criteria en de laboratoriumcriteria
Zie ook het Stroomschema voor casuïstiek.
Inschakelen van andere instanties
Clinici en de GGD (Gemeentelijke gezondheidsdienst) moeten bij het vermoeden van virale hemorragische koorts contact opnemen met de LCI (Landelijke Coördinatie Infectieziektebestrijding) (088-689 7000, ook buiten kantoortijden). Bij het vermoeden van (of bewezen) virale hemorragische koorts dient contact opgenomen te worden met een VHK-behandelcentrum voor opname of overplaatsing. De LCI is op de hoogte van de actuele beschikbaarheid.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing dient te worden verricht wanneer zich 2 of meer gevallen van virale hemorragische koorts voordoen binnen een kort tijdsbestek of wanneer deze ziekte wordt gezien bij een persoon die niet in een periode van 21 dagen hieraan voorafgaand in een van de endemische gebieden heeft verbleven.
Contactonderzoek
Het betreffende ziekenhuis en de GGD verrichten contactonderzoek (zie ook bijlage Monitoring contacten). Alle personen die via de beschreven routes (zie Besmettingsweg) contact hadden met de patiënt, moeten worden aangemerkt als contacten. Contacten dienen te worden geïnventariseerd vanaf de eerste ziektedag van de patiënt. Monitoring van de contacten dient te starten meteen na bevestiging van de diagnose bij de index.
Het is raadzaam reeds bij een verdenking van virale hemorragische koorts een contactlijst aan te leggen met incidenteel-, laag- en hoogrisicocontacten. Risicostratificatie vindt als volgt plaats:
Incidenteel contact
Personen die zich in dezelfde ruimte hebben bevonden als de patiënt, maar geen direct contact hebben gehad met de index of infectieus materiaal.
Laag risico
Huisgenoten die geen direct contact hebben gehad met (infectieus materiaal van) de patiënt, medisch personeel dat geen direct contact heeft gehad met (infectieus materiaal van) de patiënt of zich hierbij door middel van beschermende maatregelen adequaat heeft beschermd.
Hoog risico
Personen die zonder adequate beschermende maatregelen (zie onder kopje Beschermende maatregelen) contact hebben gehad met de patiënt of diens lichaamsvloeistoffen vanaf het moment dat de patiënt als infectieus kan worden beschouwd.
Vliegtuigcontacten
De ECDC-richtlijn Risk assessment guidelines for disease transmitted on aircraft beschrijft de risicostratificatie bij vliegtuigcontacten specifiek voor ebola en marburg (ECDC 2009). Indien een patiënt in zijn besmettelijke periode een vliegreis heeft gemaakt, dient overwogen te worden de hierin opgesomde vliegtuigcontacten te traceren en op te volgen.
Maatregelen ten aanzien van index, contacten en bron
Maatregelen bij contacten
Contacten ingedeeld als ‘incidenteel contact’
Voor personen met een incidenteel contact zijn geen aanvullende maatregelen van kracht. Indien er klachten ontstaan passend bij een filovirusinfectie, dient men contact op te nemen met de betrokken GGD, of de aangewezen contactpersoon in het ziekenhuis voor verdere evaluatie.
Contacten ingedeeld als ‘laag risico’
Gedurende een periode van 3 weken moeten deze personen tweemaal daags de lichaamstemperatuur meten. Bij voorkeur reizen deze laagrisicocontacten gedurende de monitoringsperiode niet naar het buitenland. Indien een temperatuur ≥38oC wordt gemeten of klachten passend bij een filovirusinfectie, dient men contact op te nemen met de betrokken GGD, of de aangewezen contactpersoon in het ziekenhuis voor verdere evaluatie.
Contacten ingedeeld als ‘hoog risico’
Deze personen moeten tot 3 weken na het laatste blootstellingsmoment met de index tweemaal daags de lichaamstemperatuur meten. Deze personen dienen daarnaast dagelijks contact te onderhouden met de betrokken GGD of de aangewezen contactpersoon in het ziekenhuis. Indien een temperatuur ≥38oC wordt gemeten of klachten passend bij een filovirusinfectie, dient men contact op te nemen met de betrokken GGD, of de aangewezen contactpersoon in het ziekenhuis voor verdere evaluatie. Daarnaast geldt voor hen een verbod om gedurende de monitoringsperiode het land te verlaten. Er moet individuele evaluatie plaats te vinden door een internist-infectioloog over mogelijkheden voor postexpositieprofylaxe.
Beschermende maatregelen
De beschermende maatregelen die nodig zijn bij beoordeling, vervoer of opname en behandeling van een patiënt met een (vermoeden) van een viraal hemorragische koorts zijn zeer strikt en uitgebreid. Om dit juist uit te voeren, is uitgebreide training onmisbaar. Daarom dient bij een (vermoeden) op een VHK-infectie direct contact gelegd te worden met een ervaren ambulance- en ziekenhuisteam rondom het vervoer en opname van de patiënt. Zie ook bijlage Vervoer (verdachte) ebola-/marburgpatiënten. De volgende richtlijnen zijn van kracht wanneer een patiënt wordt verdacht van virale hemorragische koorts of wanneer deze ziekte is gediagnosticeerd:
- WIP-richtlijn Virale hemorragische koortsen;
- SRI-richtlijn Isolatie;
- Hygiënerichtlijn voor de ambulancezorg.
Gebruik van beschermende kleding (WIP 2017)
- Twee paar niet-steriele handschoenen, waarvan bij reiniging en desinfectie het bovenste paar huishoudhandschoenen (huishoudhandschoenen zijn steviger en daardoor beter bestand tegen scheuren bij huishoudelijke werkzaamheden). Huishoudhandschoenen hoeven niet te voldoen aan NEN-EN 455, omdat ze worden gedragen bij huishoudelijke handelingen.
- Overall met lange mouwen, met of zonder manchetten, eventueel met vaste hoofdbedekking (capuchon) en vaste schoenhoezen.
- (Halter)schort, voor over de overall, van de hals/nek tot halverwege de kuiten.
- Hoofdbedekking (zoals een capuchon of kap) waarbij hals/nek beschermd zijn indien deze niet aan de overall vastzit.
- Overschoenen of laarzen indien er geen overschoenen aan de overall vastzitten. Zorg dat er geen kans is op lekkage van excreta en lichaamsvochten in de overschoen. Onder de overschoenen wordt gesloten schoeisel gedragen, het schoeisel is bestand tegen reinigen én desinfecteren.
- Ademhalingsbeschermingsmasker FFP2 dat tevens voldoet aan de eisen voor een chirurgisch neusmondmasker.
- Ruimzichtbril met indirecte ventilatie.
- Bij gebruik van motoraangedreven ademhalingsbescherming worden de punten d, f en g geïntegreerd.
Aanvullende maatregelen
- Filovirussen kunnen gedurende lange tijd in de convalescentieperiode persisteren in bepaalde lichaamsmaterialen en -vloeistoffen. Het screenen van dergelijke materialen kan behulpzaam zijn bij het versoepelen van isolatiemaatregelen.
- De preventie van seksuele transmissie verdient speciale aandacht. Het advies bij seksueel contact is doorgaans ook nog een periode na herstel een condoom te gebruiken, daar semen lang positief kan blijven, maar ook vaginaal vocht nog positief kan blijven. De duur van dit advies zal casusspecifiek en aan de hand van recente wetenschappelijke inzichten bepaald moeten worden (WHO 2023).
- Voor spoedeisende zaken buiten kantoortijden kan men contact opnemen met de Landelijke Coördinatie Infectieziektebestrijding van het RIVM (Rijksinstituut voor Volksgezondheid en Milieu)/CIb, telefoonnummer 088-689 7000.
Ontslagcriteria
Internationaal worden verschillende criteria voor ontslag uit het ziekenhuis gehanteerd. Het (nog) niet of nauwelijks voorhanden zijn van goede gegevens over de viral load in speeksel, feces en urine in relatie tot besmettelijkheid kan daar aan bijdragen.
Op basis van de ervaringen met de ebolapatiënt in december 2014 in het UMCU (Haverkort 2016), is de huidige consensus in Nederland dat ontslag uit het ziekenhuis of overplaatsing naar een verpleegafdeling kan plaatsvinden als de PCR op plasma en serum twee keer negatief is, waarbij de bloedmonsters minstens 24 uur apart van elkaar zijn afgenomen én indien de PCR op feces, urine en speeksel negatief is. Indien de PCR op plasma en serum bij herhaling negatief is, maar de PCR op feces, urine en/of speeksel niet, wordt in overleg tussen de behandelaren en de LCI het ontslagbeleid bepaald.
Postexpositieprofylaxe
Wanneer een persoon mogelijk contact heeft gehad met infectieus materiaal, zoals omschreven in de paragraaf Besmettingsweg, moet men de volgende procedure volgen:
- onmiddellijk reinigen van het betreffende lichaamsoppervlak;
- huid: wassen met ruime hoeveelheden water en vloeibare zeep; hierbij moet worden voorkomen dat andere lichaamsdelen, met name conjunctivae en mucosa, met het spoelwater in contact komen;
- mucosa en conjunctivae: spoelen met ruime hoeveelheden water of oogspoelvloeistof. Bij het spoelen van een oog moet worden voorkomen dat het andere oog met het spoelwater in contact komt.
- applicatie van een huiddesinfectans wanneer dit mogelijk is;
- patiënt wordt met spoed verwezen naar een internist-infectioloog in een VHK-behandelcentrum of een UMC (Universitair Medisch Centrum Utrecht) voor eventuele profylactische behandeling. Wetenschappelijke onderbouwing voor het gebruik van postexpositieprofylaxe is beperkt. Over eventuele opties daarbij en beschikbaarheid van medicatie dient overlegd te worden met de internist-infectioloog en de LCI.
Wering
Op geleide van besmettelijkheid van de patiënt dient wering van werk, school of kinderdagverblijf, ook na herstel van de ziekte, overwogen te worden. Hiervoor zal een advies op maat worden opgesteld na gezamenlijke afstemming met de GGD/LCI en bedrijfsarts afhankelijk van de setting en/of werkzaamheden.
Literatuur
- Abir MH, Rahman T, Das A, Etu SN, Nafiz IH, Rakib A, et al. Pathogenicity and virulence of Marburg virus. Virulence. 2022;13(1):609-33.
- Agency. 2021.
- Bray M, Chertow DS. Epidemiology and pathogenesis of Ebola virus disease - Uptodate 2024. updated 18-07-2024. Geraadpleegd op 05-08-2024.
- CDC. Ebola (Ebola Virus Disease). (Geraadpleegd: 14-07-2022: https://www.cdc.gov/vhf/ebola/index.html).
- CDC. Marburg (Marburg Virus Disease). Updated 2021. (Geraadpleegd: 14-07-2022: https://www.cdc.gov/marburg/about/?CDC_AAref_Val=https://www.cdc.gov/vhf/marburg/).
- CDC. EVD information for clinicians in U.S. healthcare settings. (Geraadpleegd 22-08-2022: https://www.cdc.gov/ebola/hcp/clinical-guidance/?CDC_AAref_Val=https://www.cdc.gov/vhf/ebola/clinicians/evd/clinicians.html) 2021.
- CDC. History of Ebola Virus Disease (EVD) Outbreaks. (Geraadpleegd: 2022-07-26: https://stacks.cdc.gov/view/cdc/116891) 2022.
- Coltart CE, Lindsey B, Ghinai I, Johnson AM, Heymann DL. The Ebola outbreak, 2013-2016: old lessons for new epidemics. Philos Trans R Soc Lond B Biol Sci. 2017;372(1721). https://doi.org/10.1098/rstb.2016.0297
- Crozier I, Britson KA, Wolfe DN, Klena JD, Hensley LE, Lee JS, et al. The Evolution of Medical Countermeasures for Ebola Virus Disease: Lessons Learned and Next Steps. Vaccines (Basel). 2022;10(8). https://doi.org/10.3390/vaccines10081213
- Dean NE, Halloran ME, Yang Y, Longini IM. Transmissibility and pathogenicity of Ebola virus: A systematic review and meta-analysis of household secondary attack rate and asymptomatic infection. Clinical Infectious Diseases. 2016;62(10):1277-86. https://doi.org/10.1093/cid/ciw114
- Decker BK, Sevransky JE, Barrett K, Davey RT, Chertow DS. Preparing for critical care services to patients with Ebola. Ann Intern Med. 2014;161(11):831-2. https://doi.org/10.7326/m14-2141
- ECDC (European Centre for Disease Prevention and Control). Factsheet about Ebola virus disease. Updated 22 June 2022. (Geraadpleegd 14-07-2022: https://www.ecdc.europa.eu/en/infectious-disease-topics/z-disease-list/ebola-virus-disease/facts/factsheet-about-ebola-virus).
- ECDC. Factsheet about Ebola virus disease. Updated 15 Dec 2023. (Geraadpleegd 01-07-2025: https://www.ecdc.europa.eu/en/infectious-disease-topics/z-disease-list/ebola-virus-disease/facts/factsheet-about-ebola-virus).
- ECDC. Factsheet about Marburg virus disease 2023. Beschikbaar via: https://www.ecdc.europa.eu/en/infectious-disease-topics/ebola-virus-disease/facts/factsheet-about-marburg-virus-disease. Geraadpleegd op 16-8-2024.
- EMA. Ervebo. (Geraadpleegd 29-08-2022: https://www.ema.europa.eu/en/medicines/human/EPAR/ervebo) 2021a.
- EMA. Zabdeno. (Geraadpleegd 29-08-2022: https://www.ema.europa.eu/en/medicines/human/EPAR/zabdeno) 2021b.
- EMA. Mvabea. (Geraadpleegd 29-08-2022: https://www.ema.europa.eu/en/medicines/human/EPAR/mvabea) 2022.
- Feldmann H, Sanchez A, Geisbert T. Filoviridae: Marburg and Ebola Viruses. In: Knipe D, Howley P, editors. Fields virology. 1. 6th ed. Philadelphia: Lippincott Williams & Wilkins; 2014.
- Feldmann H, Sprecher A, Geisbert TW. Ebola. ;N Engl J Med. 2020;382(19):1832-42. https://doi.org/10.1056/NEJMra1901594
- Foeller ME, Carvalho Ribeiro do Valle C, Foeller TM, Oladapo OT, Roos E, Thorson AE. Pregnancy and breastfeeding in the context of Ebola: a systematic review. The Lancet Infectious Diseases. 2020;20(7):e149-e58. https://pubmed.ncbi.nlm.nih.gov/32595045/
- Gayedyu-Dennis D, Fallah MP, Drew C, Badio M, Moses JS, Fayiah T, et al. Identifying Paucisymptomatic or Asymptomatic and Unrecognized Ebola Virus Disease Among Close Contacts Based on Exposure Risk Assessments and Screening Algorithms. J Infect Dis. 2023;227(7):878-87. https://doi.org/10.1093/infdis/jiac359
- Geisbert T. Ch.164 Marburg and Eboal Virus Hemorrhagic Fevers. 2020. In: Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases [Internet]. Philadelphia. . 9th.
- Haverkort JJ, Minderhoud AL, Wind JD, Leenen LP, Hoepelman AI, Ellerbroek PM. Hospital Preparations for Viral Hemorrhagic Fever Patients and Experience Gained from Admission of an Ebola Patient. Emerg Infect Dis. 2016;22(2):184-91. https://doi.org/10.3201/eid2202.151393
- Henao-Restrepo AM, Camacho A, Longini IM, Watson CH, Edmunds WJ, Egger M, et al. Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!). Lancet. 2017;389(10068):505-18. https://doi.org/10.1016/s0140-6736(16)32621-6
- Hunt L, Gupta-Wright A, Simms V, Tamba F, Knott V, Tamba K, et al. Clinical presentation, biochemical, and haematological parameters and their association with outcome in patients with Ebola virus disease: an observational cohort study. Lancet Infect Dis. 2015;15(11):1292-9. https://doi.org/10.1016/s1473-3099(15)00144-9
- Jacob ST, Crozier I, Fischer WA, 2nd, Hewlett A, Kraft CS, Vega MA, et al. Ebola virus disease. Nat Rev Dis Primers. 2020;6(1):13. https://doi.org/10.1038/s41572-020-0147-3
- Johnson E, Jaax N, White J, Jahrling P. Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus. Int J Exp Pathol. 1995;76(4):227-36.
- Kajihara M, Hang'ombe BM, Changula K, Harima H, Isono M, Okuya K, et al. Marburgvirus in Egyptian Fruit Bats, Zambia. Emerg Infect Dis. 2019;25(8):1577-80. https://doi.org/10.3201/eid2508.190268
- Kawuki J, Musa TH, Yu X. Impact of recurrent outbreaks of Ebola virus disease in Africa: a meta-analysis of case fatality rates. Public Health. 2021;195:89-97. https://doi.org/10.1016/j.puhe.2021.03.027
- Kayem ND, Benson C, Aye CYL, Barker S, Tome M, Kennedy S, et al. Ebola virus disease in pregnancy: a systematic review and meta-analysis. Transactions of The Royal Society of Tropical Medicine and Hygiene. 2021;116(6):509-22. https://doi.org/10.1093/trstmh/trab180
- Kelly JD, Van Ryn C, Badio M, Fayiah T, Johnson K, Gayedyu-Dennis D, et al. Clinical sequelae among individuals with pauci-symptomatic or asymptomatic Ebola virus infection and unrecognised Ebola virus disease in Liberia: a longitudinal cohort study. Lancet Infect Dis. 2022;22(8):1163-71. https://doi.org/10.1016/s1473-3099(22)00127-x
- Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH. Hemorrhagic Fevers Caused by Filoviruses: Ebola and Marburg. Red Book: 2021–2024 Report of the Committee on Infectious Diseases: American Academy of Pediatrics; 2021. p. 0.
- Kuhn JH, Amarasinghe GK, Basler CF, Bavari S, Bukreyev A, Chandran K, et al. ICTV Virus Taxonomy Profile: Filoviridae. Journal of General Virology. 2019;100(6):911-2. https://www.microbiologyresearch.org/content/journal/jgv/10.1099/jgv.0.001955
- Languon S, Quaye O. Filovirus Disease Outbreaks: A Chronological Overview. Virology (Auckl). 2019;10:1178122x19849927. https://doi.org/10.1177/1178122x19849927
- Leroy EM, Kumulungui B, Pourrut X, Rouquet P, Hassanin A, Yaba P, et al. Fruit bats as reservoirs of Ebola virus. Nature. 2005;438(7068):575-6.
- Liddell AM, Davey RT, Jr., Mehta AK, Varkey JB, Kraft CS, Tseggay GK, et al. Characteristics and Clinical Management of a Cluster of 3 Patients With Ebola Virus Disease, Including the First Domestically Acquired Cases in the United States. Ann Intern Med. 2015;163(2):81-90. https://doi.org/10.7326/m15-0530
- Malenfant JH, Joyce A, Choi MJ, Cossaboom CM, Whitesell AN, Harcourt BH, et al. Use of Ebola Vaccine: Expansion of Recommendations of the Advisory Committee on Immunization Practices To Include Two Additional Populations - United States, 2021. MMWR (Morbidity and Mortality Weekly Report) Morb Mortal Wkly Rep. 2022;71(8):290-2. https://doi.org/10.15585/mmwr.mm7108a2
- Malvy D, McElroy AK, de Clerck H, Günther S, van Griensven J. Ebola virus disease. The Lancet. 2019;393(10174):936-48.
- Mekibib B, Ariën KK. Aerosol Transmission of Filoviruses. Viruses. 2016;8(5):148.
- Moyen N, Thirion L, Emmerich P, Dzia-Lepfoundzou A, Richet H, Boehmann Y, et al. Risk Factors Associated with Ebola and Marburg Viruses Seroprevalence in Blood Donors in the Republic of Congo. PLoS Negl Trop Dis. 2015;9(6):e0003833. https://doi.org/10.1371/journal.pntd.0003833
- Muzembo BA, Kitahara K, Ohno A, Ntontolo NP, Ngatu NR, Okamoto K, Miyoshi S-I. Rapid diagnostic tests versus RT-PCR for Ebola virus infections: a systematic review and meta-analysis. Bull World Health Organ. 2022;100(7):447-58. https://doi.org/10.2471/blt.21.287496
- Natesan M, Jensen SM, Keasey SL, Kamata T, Kuehne AI, Stonier SW, et al. Human Survivors of Disease Outbreaks Caused by Ebola or Marburg Virus Exhibit Cross-Reactive and Long-Lived Antibody Responses. Clin Vaccine Immunol. 2016;23(8):717-24. https://doi.org/10.1128/cvi.00107-16
- Pattyn S, Jacob W, Van der Groen G, Piot P, Courteille G. Isolation of Marburg-like virus from a case of haemorrhagic fever in Zaire. Lancet. 1977:573-4.
- Peterson AT, Bauer JT, Mills JN. Ecologic and geographic distribution of filovirus disease. Emerg Infect Dis. 2004;10(1):40-7. https://doi.org/10.3201/eid1001.030125
- Ploquin A, Zhou Y, Sullivan NJ. Ebola Immunity: Gaining a Winning Position in Lightning Chess. J Immunol. 2018;201(3):833-42. https://doi.org/10.4049/jimmunol.1700827
- Prescott JB, Marzi A, Safronetz D, Robertson SJ, Feldmann H, Best SM. Immunobiology of Ebola and Lassa virus infections. Nat Rev Immunol. 2017;17(3):195-207.
- Ristanović ES, Kokoškov NS, Crozier I, Kuhn JH, Gligić AS. A Forgotten Episode of Marburg Virus Disease: Belgrade, Yugoslavia, 1967. Microbiol Mol Biol Rev. 2020;84(2). https://doi.org/10.1128/mmbr.00095-19
- Rojek AM, Salam A, Ragotte RJ, Liddiard E, Elhussain A, Carlqvist A, et al. A systematic review and meta-analysis of patient data from the West Africa (2013-16) Ebola virus disease epidemic. Clin Microbiol Infect. 2019;25(11):1307-14. https://doi.org/10.1016/j.cmi.2019.06.032
- Rowe AK, Bertolli J, Khan AS, Mukunu R, Muyembe-Tamfum JJ, Bressler D, et al. Clinical, virologic, and immunologic follow-up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. Commission de Lutte contre les Epidémies à Kikwit. J Infect Dis. 1999;179 Suppl 1:S28-35. https://doi.org/10.1086/514318
- Sadek RF, Khan AS, Stevens G, Peters CJ, Ksiazek TG. Ebola hemorrhagic fever, Democratic Republic of the Congo, 1995: determinants of survival. J Infect Dis. 1999;179 Suppl 1:S24-7. https://doi.org/10.1086/514311
- Schindell BG, Webb AL, Kindrachuk J. Persistence and Sexual Transmission of Filoviruses. Viruses. 2018;10(12). https://doi.org/10.3390/v10120683
- Shu HL, Siegert R, Slenczka W. The pathogenesis and epidemiology of the "Marburg-virus" infection. Ger Med Mon. 1969;14(1):7-10.
- Sneller MC, Reilly C, Badio M, Bishop RJ, Eghrari AO, Moses SJ, et al. A Longitudinal Study of Ebola Sequelae in Liberia. N Engl J Med. 2019;380(10):924-34. https://doi.org/10.1056/NEJMoa1805435
- Thom R, Tipton T, Strecker T, Hall Y, Akoi Bore J, Maes P, et al. Longitudinal antibody and T cell responses in Ebola virus disease survivors and contacts: an observational cohort study. Lancet Infect Dis. 2021;21(4):507-16. https://doi.org/10.1016/s1473-3099(20)30736-2
- Victory KR, Coronado F, Ifono SO, Soropogui T, Dahl BA. Ebola transmission linked to a single traditional funeral ceremony - Kissidougou, Guinea, December, 2014-January 2015. MMWR Morb Mortal Wkly Rep. 2015;64(14):386-8.
- West TE, von Saint André-von Arnim A. Clinical presentation and management of severe Ebola virus disease. Ann Am Thorac Soc. 2014;11(9):1341-50. https://doi.org/10.1513/AnnalsATS.201410-481PS
- WHO (World Health Organization). Guidelines on the management of pregnant and breastfeeding women in the context of Ebola virus disease. 2020.
- WHO. Regional office for Africa. Marburg Haemorrhagic Fever. Factsheet. (Geraadpleegd 14-07-2022: https://www.afro.who.int/health-topics/marburg-haemorrhagic-fever) 2021.
- WHO. Factsheet Ebola disease. (Geraadpleegd 01-07-2025: https://www.who.int/news-room/fact-sheets/detail/ebola-disease) 2025.
- Yang B, Schaefer A, Wang YY, McCallen J, Lee P, Newby JM, et al. ZMapp Reinforces the Airway Mucosal Barrier Against Ebola Virus. J Infect Dis. 2018;218(6):901-10. https://doi.org/10.1093/infdis/jiy230
- Yeh S, Shantha JG, Hayek B, Crozier I, Smith JR. Clinical Manifestations and Pathogenesis of Uveitis in Ebola Virus Disease Survivors. Ocul Immunol Inflamm. 2018;26(7):1128-34. https://doi.org/10.1080/09273948.2018.1484493