Samenvatting
Verwekker: Bacterie Salmonella Typhi en Salmonella Paratyphi A, B en C
Incubatieperiode: Afhankelijk van de besmettingsdosis, in meeste gevallen 7-14 dagen en maximaal 4 weken
Besmettingsweg: Fecaal-oraal; met name via met feces besmet water of voedsel
Besmettelijke periode: Vanaf de 1e ziekteweek tot herstel (onbehandeld). Chronisch dragerschap komt voor
Maatregelen: Meldingsplicht groep B2. Bronopsporing; contactonderzoek op indicatie. Hygiënemaatregelen. Bacteriologische nacontrole en wering op indicatie
Symptomen: (Geleidelijk oplopende) koorts; verscheidene niet-specifieke symptomen zoals hoofdpijn, myalgie, verminderde eetlust, malaise en niet-productieve hoest. Er kan sprake zijn van een beneveld bewustzijn. Buikklachten kunnen bestaan uit diarree, constipatie en buikpijn. Soms huiduitslag (roseolen). Complicaties: gastro-intestinale bloeding, darmperforatie, encefalopathie en shock
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 25 juni 2024. Diagnostiek vastgesteld: 5 juni 2024.
Wijzigingen:
- 10 september 2024: onder 'maatregelen' toegevoegd dat tot de typering van S. Paratyphi B variant Java bekend is, de maatregelen gelden zoals beschreven in deze richtlijn. Na typering als S. Paratyphi B variant Java, komen deze te vervallen.
- 18 juli 2024: Herziene richtlijn gepubliceerd (op 25 juni 2024 vastgesteld door het LOI). De richtlijn is herzien onder leiding van Caroline van den Ende (RIVM-LCI). Nieuw en anders ten opzichte van de oude richtlijn:
- De richtlijnen buiktyfus en paratyfus zijn samengevoegd tot één richtlijn; de ziekten worden nu gemeenschappelijk behandeld.
- Een onderbouwing voor de nu gecombineerde maatregelen bij buiktyfus en paratyfus is toegevoegd.
- Er is expliciet opgenomen dat S. Paratyphi B variant Java is uitgesloten van de meldingsplicht.
- De informatie over het voorkomen van buiktyfus en paratyfus wereldwijd en in Nederland is geüpdatet.
- Diagnostiek vastgesteld 5 juni 2024.
Achtergronden
Verwekker
Buiktyfus en paratyfus worden veroorzaakt door infectie met respectievelijk Salmonella Typhi (S. Typhi) en Salmonella Paratyphi (S. Paratyphi) A, B en C. Dit zijn gramnegatieve bacteriën die behoren tot de familie van de Enterobacteriaceae, geslacht Salmonella.
Van de S. Paratyphi B-varianten is de d-tartraat-fermenterende variant (dT+) S. enterica subsp. enterica serovar Paratyphi B variant Java, kortweg variant Java, geassocieerd met gewone niet-invasieve gastro-enteritis, en niet met een tyfeus ziektebeeld (Chart 2003, Toboldt 2012, Wollin 2007). Zie voor meer achtergrondinformatie over variant Java de Onderbouwing. Deze richtlijn gaat verder niet in op variant Java; de te nemen maatregelen bij deze variant zijn gelijk aan de maatregelen zoals beschreven in de richtlijn Salmonellose.
In deze richtlijn heeft alle informatie betrekking op zowel S. Typhi als op S. Paratyphi spp., tenzij anders vermeld. In de literatuur worden buiktyfus en paratyfus soms tezamen aangeduid met de term ‘enteric fever’.
Epidemiologie
Verspreiding in de wereld
Prevalentie en incidentie van paratyfus en buiktyfus zijn niet exact bekend. De ziekten komen in nagenoeg de gehele wereld voor, maar er zijn grote regionale verschillen in incidentie. In Europa en Noord-Amerika worden ziektegevallen voornamelijk gezien onder reizigers die naar (hoog)endemische landen zijn geweest. Een schatting uit 2017 kwam uit op 14 miljoen gevallen wereldwijd (van paratyfus en buiktyfus gezamenlijk), dit is een daling van ongeveer 45% ten opzichte van 1990. Zo’n 80% van de infecties komen voor in Zuid- en Zuidoost-Azië en Afrika. S. Typhi veroorzaakt 76% van de zieken. Gemiddeld sterft 0,95% van de patiënten aan buiktyfus en paratyfus (GBD 2017 Typhoid and Paratyphoid Collaborators 2019).
Voorkomen in Nederland
In Nederland werd in de periode 2013-2022 jaarlijks tussen 14 en 28 gevallen van buiktyfus in Osiris gemeld met als uitzondering 2020 (6 gevallen) en 2022 (96 gevallen). Het hoge aantal in 2022 werd veroorzaakt door een grote uitbraak (72 gevallen) gerelateerd aan gecontamineerd water op een schip waarop asielzoekers werden opgevangen (zie ook de Onderbouwing). In vrijwel alle overige gevallen waarbij de besmetting meest waarschijnlijk in Nederland had plaatsgevonden, was onduidelijk hoe en waar dit was gebeurd. Rond 90% van de infecties werd echter in het buitenland opgelopen. India is daarbij het meest genoemde land (35% van de buitenlandbesmettingen), gevolgd door Pakistan (17%) en Mexico (12%). Het lage aantal in 2020 kan verklaard worden doordat reizen slechts zeer beperkt mogelijk was in dat jaar als gevolg van de coronapandemie. Ook in 2021 was dit nog zichtbaar (14 gevallen). Van de patiënten betrokken bij de uitbraak in 2022 werd 35% in het ziekenhuis opgenomen. Het percentage ziekenhuisopnames van de overige gevallen in deze 10-jaars periode was 75% (waarschijnlijk is hier sprake van overrapportage: de gevallen met milde ziekteklachten gaan niet naar de huisarts of worden niet getest). Buiktyfus wordt gezien in alle leeftijden, maar de meerderheid is in de leeftijd 18-39 jaar.
Het aantal gevallen van paratyfus A varieerde sterk per jaar: 6-22 gevallen (2013-2022) met als uitzondering de coronajaren 2020 en 2021 (elk 3 gevallen). In totaal waren er 97 gevallen in deze 10 jaar, waarvan 91 (94%) in het buitenland opgelopen. Ook hier wordt India het meest genoemd (35%), gevolgd door Pakistan en Indonesië (beide 14%). Ruim de helft van de zieken (57%) werd in het ziekenhuis opgenomen. De mediane leeftijd varieert over de jaren tussen 26 en 41 jaar, kinderen onder de 10 jaar worden zelden met paratyfus A gemeld.
Paratyfus B werd jaarlijks tussen 8 en 29 keer gemeld met uitzondering van 2020 (3 gevallen). In totaal werden 206 gevallen in de periode 2013-2022 gemeld, waarvan 79% in het buitenland werd opgelopen. De meest genoemde landen voor reisgerelateerde paratyfus B zijn Indonesië (46%), Turkije (10%) en Thailand (7%). Bij 27% van de gevallen werd een ziekenhuisopname gemeld. De mediane leeftijd van de zieken was in deze 10-jaars periode 21-28 jaar, behalve in 2020 (46 jaar, gebaseerd op drie zieken). Ruim de helft van de gevallen (56%) is in de leeftijd 18-39 jaar.
Paratyfus C komt weinig voor in Nederland. In de periode 2013-2022 werden in totaal 17 gevallen gemeld met een variatie van 0 tot 5 gevallen per jaar. Tien infecties zijn in het buitenland opgelopen, waarbij acht verschillende landen in Afrika, Azië en Midden-Amerika worden genoemd. Zeven zieken (41%) werden in het ziekenhuis opgenomen.
Pathogenese
De pathogenese wordt beschreven voor S. Typhi. Voor de drie verwekkers van paratyfus geldt in grote lijnen hetzelfde als voor S. Typhi.
S. Typhi is een invasieve bacterie die zeer efficiënt de darmmucosa passeert via de M-cellen van de plaques van Peyer en vervolgens de monocyten en macrofagen in de mesenteriale lymfeklieren infecteert. De bacterie is in staat om na fagocytose te overleven in macrofagen, en komt via het bloed in de lever, milt en het beenmerg. Na vermenigvuldiging op deze plaatsen komt de bacterie opnieuw in de bloedbaan (secundaire bacteriëmie); dit markeert het begin van klinische ziekte. Via de bloedbaan bereikt de bacterie andere orgaansystemen, waaronder de galblaas, waarvoor S. Typhi een speciale affiniteit heeft. De bacterie kan zich ook nestelen in de galblaas en vanuit daar chronisch dragerschap veroorzaken.
Als de ziekte vordert en de bacterie opnieuw het gastro-intestinaal systeem bereikt, kan dit necrose van lymfoïde weefsel in de darm veroorzaken, met complicaties zoals bloedingen en perforaties in (de buurt van) de plaques van Peyer tot gevolg (Everest 2001, Harris 2015).
Incubatieperiode
De incubatietijd van buiktyfus en paratyfus bedraagt meestal zeven tot veertien dagen, maar kan – afhankelijk van de besmettingsdosis – sterk variëren (Harris 2015). In een meta-analyse uit 2018 was de langst gerapporteerde incubatietijd 41 dagen. De overgrote meerderheid van de zieken in de geïncludeerde studies ontwikkelde echter binnen een maand na blootstelling symptomen (Awofisayo-Okuyelu 2018).
Ziekteverschijnselen
De ziekteverschijnselen van infectie met S. Typhi en S. Paratyphi A, B en C in niet-endemische landen zijn vergelijkbaar (Nabarro 2022). Hoewel het verloop van paratyfus over het algemeen als minder ernstig werd beschouwd dan buiktyfus, suggereert recentere literatuur dat buiktyfus en paratyfus veroorzaakt door S. Paratyphi A op klinische gronden niet van elkaar te onderscheiden zijn (Maskey 2006).
De meest voorkomende klinische manifestatie is koorts, dit loopt vaak geleidelijk op (Harris 2015). Verscheidene andere niet-specifieke symptomen zijn gebruikelijk in het begin van de ziekte, zoals hoofdpijn, myalgie, verminderde eetlust, niet-productieve hoest en malaise. Ook kan er sprake zijn van een beneveld bewustzijn. Buikklachten kunnen bestaan uit buikpijn en diarree, of juist constipatie. Buiktyfus kan gepaard gaan met een grote variëteit aan neurologische en psychiatrische symptomen, al wordt dit meestal pas gezien bij vergevorderde ziekte (Ali 1997). In de eerste ziekteweek kan relatieve bradycardie optreden. In de tweede ziekteweek kunnen (hoewel ongebruikelijk bij ongecompliceerde ziekte) roseolen worden aangetroffen op de romp en de buik; op een donkere huid zijn deze moeilijker te zien. Bij kinderen kan het klinisch beeld enigszins anders zijn dan bij volwassenen; zo lijken bij kinderen pneumonie en koortsstuipen vaker voor te komen (Britto 2017).
Complicaties ontstaan meestal in de derde week van de ziekte en omvatten gastro-intestinale bloeding, darmperforatie, encefalopathie en shock. Ook kunnen hepatomegalie en splenomegalie optreden. De ernst van de ziekte hangt af van verschillende factoren, waaronder de duur van de ziekte voor de start van behandeling, de grootte van het inoculum, vaccinatiestatus, gastheerfactoren (bijvoorbeeld immuunsuppressie) en gebruik van medicatie (zoals maagzuurremmers) (WHO 2003). In niet-endemische settings is de mortaliteit laag (case fatality rate (CFR) <1%); in endemische landen is dit ongeveer 2,5% (Nabarro 2022, Wollin 2007).
Onbehandeld kunnen de symptomen 4 weken of langer aanhouden. Hernieuwde klachten (‘relapse’) na klinische genezing komt voor bij 5-10% van de patiënten. In dergelijke gevallen gebeurt dit meestal 2-3 weken na het verdwijnen van de koorts (Parry 2002).
Natuurlijke immuniteit
Een eerder doorgemaakte infectie lijkt bij S. Typhi slechts gedeeltelijke bescherming (~30%) te geven tegen herinfectie (Dupont 1971, Marmion 1953). Over de verworven immuniteit na een eerdere infectie met S. Paratyphi is minder bekend; in een experimentele studie was eerdere blootstelling aan S. Paratyphi A geassocieerd met een 57% lager risico op ziekte na nieuwe blootstelling (Gibani 2020).
Reservoir
Alleen de mens (m.u.v. S. Paratyphi B variant Java) (Gal-Mor 2014, Saporito 2017).
Transmissie
Besmettingsweg
De besmettingsweg is fecaal-oraal. Personen met een acute infectie en dragers scheiden de bacterie uit via de feces. Transmissie vindt plaats door consumptie van water en/of voedsel, besmet met feces van patiënten/dragers (Harris 2015). De meeste gevallen in Nederland zijn geassocieerd met reizen naar endemische gebieden, waar de (voedsel)hygiëne vaak minder goed is (zie ook de Onderbouwing en de paragaaf Epidemiologie). Ongekookt water en voedingsmiddelen zoals rauwe schelpdieren of rauwe groenten of fruit waar vliegen en andere insecten op hebben gezeten, kunnen daarbij de bron zijn. Bij niet-reisgerelateerde gevallen in Nederland is de bron vaak onduidelijk. Een uitbraak in 2022 op een opvangboot voor asielzoekers werd veroorzaakt door een poreus geworden metalen afscheiding tussen de drink- en afvalwatertank, waardoor er afvalwater in het drinkwater terechtkwam (Ooms 2024).
Besmetting van mens op mens komt vrijwel niet voor. In situaties met kwetsbare groepen en onvoldoende hygiënebesef is er een verhoogde kans op overdracht. Verder is overdracht via seksueel contact beschreven (Reller 2003).
In de literatuur zijn diverse infecties beschreven die werden verkregen tijdens het werken met S. Typhi in een microbiologisch laboratorium. Tussen 2004 en 2017 zijn twee gevallen in Osiris gemeld van buiktyfus waarbij het laboratorium waarschijnlijk de bron van besmetting was. Ook in 2022 is een geval gemeld (Broertjes 2023).
Besmettelijke periode
Uitscheiding van de bacterie via de feces of urine geschiedt tijdens de acute fase en meestal enkele weken tijdens herstel (Vogelsang 1948). Na antibiotische behandeling en het verdwijnen van de symptomen blijft een klein deel (tot 5%) van de patiënten S. Typhi of S. Paratyphi A uitscheiden in hun feces (en zelden urine) (Dongol 2012, Gunn 2014, Nabarro 2022). Uitscheiding van de bacteriën gedurende ten minste 1 jaar wordt als criterium voor chronisch dragerschap gehanteerd; deze uitscheiding kan levenslang blijven bestaan (Harris 2015). Risicofactoren voor chronisch dragerschap zijn pre-existente galblaaspathologie en toenemende leeftijd.
Besmettelijkheid
Secundaire transmissie komt weinig voor; vaak is de meest waarschijnlijke bron eenzelfde (buitenlandse) bron als bij de indexpatiënt de oorzaak van de infectie (Bovée 2002, Russell 2018). Een persoon met buiktyfus of paratyfus kan andere mensen besmetten (bijvoorbeeld doordat de bacterie na toiletbezoek via de handen op de toiletbril en de spoelknop terechtkomt, of op eten of servies, waardoor de bacterie via de handen in de mond terechtkomt). Met hygiënische maatregelen kan dit worden voorkomen. Het aandeel van chronische dragers in de transmissie is onduidelijk, maar in de literatuur wordt gesuggereerd dat dit met name in laag-endemische settings een rol kan spelen (Baker 2011, Dongol 2012).
In studies met vrijwilligers werd gevonden dat na toediening van een dosis van 105 tot 107 bacteriën bij de helft van de vrijwilligers een infectie ontstaat, echter ook een dosis kleiner dan 103 bacteriën kan leiden tot een infectie. Dergelijke studies bootsen natuurlijke blootstelling niet optimaal na (Harris 2015).
Risicogroepen
Verhoogde kans op infectie
Buiktyfus en paratyfus zijn importziekten die veelal in het buitenland worden opgelopen. De meeste infecties komen voor onder reizigers naar endemische gebieden (zie ook de paragraaf Epidemiologie), zoals mensen die daar familie bezoeken (CDC 2023). Persoonlijke risicofactoren voor infectie in deze gebieden zijn onder meer het drinken van ongekookt water en het eten van voedsel dat buitenshuis is bereid, waaronder eten en drinken uit de straatverkoop (Harris 2015). Het gebruik van maagzuurremmers geeft een verhoogd risico op gastro-intestinale infecties, maar bij tyfeuze Salmonella is dit niet onderzocht (Hassing 2016).
Mens-op-mens-transmissie komt weinig voor (zie ook Besmettingsweg), maar bepaald gedrag kan het risico op infectie verhogen. Zo zijn clusters waargenomen onder mannen die seks hebben met mannen (Reller 2003). Ook onvoldoende hygiënebesef (denk aan jonge kinderen of mensen met een verstandelijke beperking) of activiteiten die het risico op overdracht via de fecaal-orale route verhogen (bijvoorbeeld eten geven door medewerkers in de zorg), kunnen leiden tot een verhoogde kans op infectie.
Verhoogde kans op ernstig beloop
De meeste studies naar (risicofactoren voor) complicaties/ernstige ziekte zijn uitgevoerd in endemische landen (Cruz Espinoza 2019). Tijdige behandeling met geschikte antibiotica verlaagt het risico op complicaties. Jonge kinderen in endemische gebieden hebben mogelijk een hoger risico op complicaties dan oudere kinderen en volwassenen, maar in een meta-analyse uit 2019 werd dit niet bevestigd (Marchello 2020). Het is onduidelijk of personen met hiv of andere immuungecompromitteerde personen een verhoogd risico hebben op een ernstig beloop, in tegenstelling tot de beschreven associatie tussen hiv en niet-tyfeuze Salmonella. Ook is er geen bewezen associatie tussen zwangerschap en een hoger risico op complicaties van buik-/paratyfus (Nabarro 2022). In zeldzame gevallen kan buiktyfus tot miskraam of intra-uteriene transmissie leiden, maar in een vergelijkende studie tussen zwangere vrouwen met en zonder buiktyfus werd geen verschil in zwangerschapsuitkomsten gevonden tussen de twee groepen (Sulaiman 2007).
Behandeling
Buiktyfus of een ernstig verlopende infectie met paratyfus worden (bijna) altijd behandeld met antibiotica, oraal of zo nodig intraveneus. De keuze van het middel is afhankelijk van het resistentiepatroon. Voor een behandeladvies zie de SWAB-adviezen Salmonella typhi. (NB. Dit advies geldt ook voor S. Paratyphi.)
Langdurig dragerschap
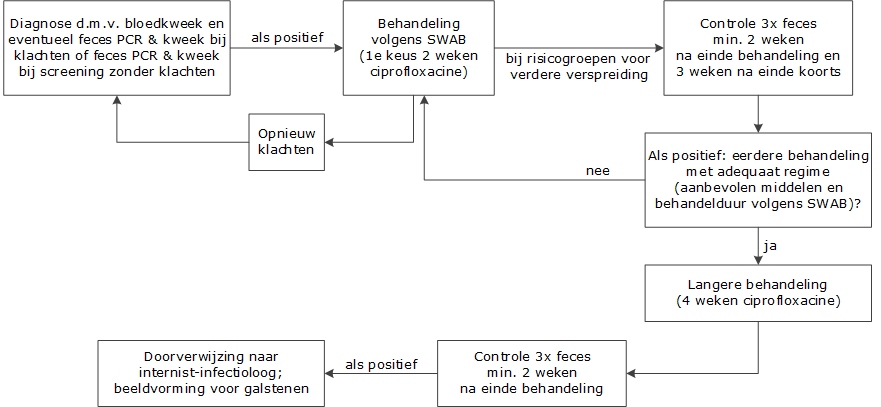
Als er na 6 weken nog uitscheiding van Salmonellae plaatsvindt kan – bij volwassenen – waarschijnlijk het beste behandeld worden met ciprofloxacine gedurende 4 weken, na 2 weken gevolgd door een feceskweek. Indien hierna wederom de kweek positief is, is doorverwijzing naar een specialist (bijvoorbeeld een internist-infectioloog) geadviseerd voor verdere analyse, zoals een echografie van de galblaas om eventuele galstenen op te sporen. Zie ook het stroomdiagram in de paragraaf Maatregelen ten aanzien van index en contacten.
Diagnostiek
Zie ook Diagnostisch Vademecum Salmonella species.
Microbiologische diagnostiek
Directe diagnostiek
De diagnose wordt primair gesteld door middel van een bloed- of beenmergkweek. S. Typhi en Paratyphi kunnen ook worden geïsoleerd uit feces, huidbiopten van roseolen en/of urine. Als twee tot drie sets bloedkweken worden afgenomen, is de sensitiviteit rond 70% van de klinisch verdachte gevallen. Feceskweken zijn (indien eenmalig uitgevoerd) doorgaans slechts bij 45-65% van de patiënten positief, bij kinderen vaker dan bij volwassenen. Een kweek van het beenmerg heeft in de eerste ziekteweek een hoge opbrengst (±90%) en kan tot 5 dagen na het starten van antibiotische therapie positief blijven. Vanwege de invasieve ingreep worden beenmergkweken in Nederland nauwelijks afgenomen.
NAATs specifiek gericht op S. Typhi en/of Paratyphi worden in Nederland niet routinematig gebruikt in de klinische diagnostiek. Wel beschikken veel laboratoria voor de fecesdiagnostiek over een Salmonella-brede NAAT (nucleïnezuur amplificatietest (zoals PCR)), waarmee ook S. Typhi en/of Paratyphi kunnen worden gedetecteerd. Om het betreffende serovar te bepalen is een kweek nodig. Bij positieve NAAT op Salmonella wordt er standaard een kweek ingezet en vervolgens worden de serovar en antibiotische gevoeligheid bepaald. Salmonella spp. groeien op standaard kweekmedia, maar voor feceskweek worden speciale platen gebruikt om de groei van andere darmflora te remmen en kolonies van Salmonella een herkenbaar uiterlijk te geven. Verdachte stammen kunnen worden geïdentificeerd tot speciesniveau door middel van Maldi-TOF. De meeste laboratoria serotyperen door middel van een basisset antistoffen tegen de O- en H-antigenen en het Vi-antigeen, waarmee het mogelijk is om snel Salmonella Typhi, Paratyphi A/B/C, Enteritidis, Typhimurium en Choleraesuis met redelijke zekerheid te onderscheiden van andere serovars. Het is van belang dat deze uitslagen snel bekend zijn, omdat ziekte door S. Typhi en Paratyphi A/B/C meldingsplichtig (categorie B2) is. Ook moeten laboratoria in het geval van S. Typhi extra maatregelen nemen om besmetting van medewerkers te voorkomen. Verdere serotypering wordt door het referentielaboratorium (RIVM) gedaan (zie hieronder).
Voor het vervolgen van dragerschap zijn herhaalde feceskweken het meest gangbaar.
Indirecte diagnostiek
Serologisch onderzoek van het bloed van de patiënt (Widal-test) speelt vrijwel geen rol meer bij de diagnostiek van S. Typhi-infecties. Voor gebruik in endemische landen is een anti-Salmonella Typhi/Paratyphi IgA (immunoglobuline A)-secretie assay (‘TPTest’) ontwikkeld (Khanam 2013); het is echter onduidelijk of deze test ooit in Nederland aangewend zal worden.
Typering voor bron- en contactonderzoek
S. Typhi- en Paratyphi-stammen worden, net als andere Salmonella, in het referentielaboratorium van het RIVM (Rijksinstituut voor Volksgezondheid en Milieu) met moleculaire serotypering onderscheiden in het kader van nationale surveillance. Binnen S. Paratyphi B wordt dan variant Java met behulp van whole genome sequencing onderscheiden.
Niet-microbiologische diagnostiek
N.v.t.
Preventie
Immunisatie
Vaccinatie
Tegen buiktyfus is in Nederland het dode parenterale Vi-antigeenvaccin (ook bekend onder de naam Typhim Vi) geregistreerd. Vaccinatie wordt in Nederland vrijwel uitsluitend toegepast in geval van een reis naar sommige (sub)tropische landen. Voor details wordt verwezen naar de LCR (Landelijke Coördinatiecentrum Reizigersadvisering)-protocollen. Tegen paratyfus is geen vaccin beschikbaar.
Passieve immunisatie
Noch voor buiktyfus, noch voor paratyfus is passieve immunisatie beschikbaar.
Algemene preventieve maatregelen
In Nederland
Alleen de algemene adviezen gericht op het (zoveel mogelijk) voorkomen van overdracht van fecaal-oraal overdraagbare infecties, zoals handhygiëne.
Reizigers
Reizigers naar endemische gebieden dienen af te zien van het nuttigen van ongekookt water, rauwe melk, ijs, ijsblokjes, vruchtensappen, ongeschild/ongewassen of in kraanwater/oppervlakte gewassen fruit en voedsel zoals rauwkost, hamburgers, rauwe schaaldieren en dergelijke. Ook voor reizigers zijn de algemene adviezen voor het voorkomen van fecaal-oraal overdraagbare infecties van belang.
Reiniging, desinfectie en sterilisatie
Conform de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Maatregelen
Deze richtlijn gaat niet in op variant Java; de te nemen maatregelen bij deze variant zijn gelijk aan de maatregelen zoals beschreven in de LCI-ichtlijn Salmonellose.
Meldingsplicht
Buiktyfus en paratyfus zijn meldingsplichtige ziekten groep B2. Dit houdt in dat artsen en hoofden van laboratoria bij vaststelling van de infectieziekte of verwekker dit binnen 1 werkdag moeten melden aan de GGD (Gemeentelijke gezondheidsdienst). De GGD meldt gepseudonimiseerd conform de Wet publieke gezondheid binnen 3 dagen aan het CIb (Centrum Infectieziektebestrijding) en levert gegevens aan voor de landelijke surveillance van meldingsplichtige ziekten.
Meldingscriteria:
[1] Elke persoon bij wie S. Typhi of S. Paratyphi (met uitzondering van S Paratyphi B variant Java*) in het laboratorium is aangetoond, met of zonder klachten/verschijnselen.
[2] Elke persoon met ten minste 1 van de volgende 2 klinische beelden:
- Persisterende koorts
- Ten minste 2 van de volgende 4 symptomen:
- hoofdpijn
- relatieve bradycardie
- non-productieve hoest
- diarree, constipatie, malaise of buikpijn
in combinatie met recent (< 2 weken) contact met een persoon bij wie de infectie door middel van laboratoriumonderzoek is bevestigd.
N.B. Asymptomatisch dragerschap hoeft alleen te worden gemeld wanneer dit voor de eerste keer wordt vastgesteld.
Als zich in een instelling een of meerdere gevallen voordoen met klachten en symptomen passend bij buiktyfus of paratyfus, kan er sprake zijn van meldingsplicht op basis van Artikel 26 Wet publieke gezondheid.
* Salmonella Paratyphi B variant Java valt buiten de meldingsplicht. Totdat de typering, als onderdeel van de nationale surveillance bij het RIVM, bekend is, gelden echter de maatregelen zoals beschreven in deze richtlijn. Na typering als S. Paratyphi B variant Java komen deze te vervallen en kan, waar van toepassing, de LCI-richtlijn Salmonellose gevolgd worden.
Inschakelen van andere instanties
- Bij een uitbraak veroorzaakt door voedsel de NVWA (Nederlandse Voedsel- en Warenautoriteit) inschakelen.
- In geval van een infectie bij een bewoner van een zorginstelling, indien aanwezig, de deskundige infectiepreventie van de organisatie waarschuwen.
- In geval van een infectie bij een medewerker van een zorginstelling de bedrijfsarts van de organisatie waarschuwen.
- In geval van een infectie bij een schoolgaand kind jeugdgezondheidszorg inlichten.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing door de GGD dient altijd plaats te vinden, zowel bij solitaire gevallen als bij uitbraken. Vraag altijd na:
- of betrokkene 1 maand voorafgaand aan de eerste ziektedag in het buitenland is geweest (waar, wanneer, hoelang, of persoon alleen reisde of met reisgenoten met vergelijkbare blootstelling).
- bij buiktyfus of betrokkene tegen buiktyfus was gevaccineerd, wanneer, en met welk vaccin.
Als de patiënt zelf niet recent in het buitenland is geweest, moet worden gezocht naar een bron in de vorm van besmet voedsel/water of een persoon in de omgeving van de patiënt. Zie ook de Onderbouwing.
Contactonderzoek
Contactonderzoek (eenmalig fecesonderzoek) bij alle gezins- of daarmee vergelijkbare contacten wordt geadviseerd indien er sprake is van een indexpatiënt die:
- geen of onvoldoende hygiënebesef heeft (leeftijd tot 6 jaar of verstandelijke beperking);
- (mede) voor de voedselbereiding zorg droeg.
Voor alle andere indexpatiënten geldt het advies voor contactonderzoek bij gezins- of daarmee vergelijkbare contacten uitsluitend als deze contacten:
- werken met voedingsmiddelen (horeca, levensmiddelenindustrie, voedselbereiding in een instelling, etc.);
- werken in de verzorgende sector (zorgmedewerkers of personeel van kinderdagverblijven);
- klachten hebben die mogelijk zouden kunnen passen bij buiktyfus of paratyfus.
Contactonderzoek wordt ook geadviseerd bij de andere leden van een reisgezelschap als de indexpatiënt behoorde tot een reisgezelschap dat dezelfde reis heeft gemaakt (vergelijkbare blootstelling) en er in het gezelschap in totaal twee of meer gevallen van buiktyfus of paratyfus zijn opgetreden.
Bij uitbraken kan uitgebreider contactonderzoek noodzakelijk zijn. Zie ook de Onderbouwing.
Maatregelen ten aanzien van index, contacten en bron
Zie ook de Onderbouwing.
Isolatie
Isolatie van de patiënt is buiten het ziekenhuis of verpleeghuis zelden noodzakelijk.
Hygiënemaatregelen
Hygiënemaatregelen zijn van belang om verspreiding van de bacterie te voorkomen. Zolang er personen met klinische verschijnselen zijn, moet men extra zorgvuldig zijn. Zie voor de te nemen (hygiëne)maatregelen, zowel in de gezinssituatie als in instellingen, de handleiding Maatregelen ter voorkoming van fecaal-orale overdracht. De hygiënemaatregelen moeten worden voortgezet tot minimaal eenmaal de incubatietijd na het ziek worden van het (laatste) ziektegeval (4 weken).
Soms zijn in instellingen nog aanvullende maatregelen noodzakelijk, afhankelijk van de situatie. Of aanvullende maatregelen nodig zijn, is ter beoordeling van de GGD – eventueel in afstemming met de deskundige infectiepreventie van de instelling – op basis van (het verloop van) een concrete situatie.
Bacteriologische nacontrole
Bacteriologische nacontrole van bevestigde gevallen wordt geadviseerd in de volgende groepen die een hoger risico hebben om de ziekteverwekker over te dragen (conform de Engelse Public Health operational guidelines):
- een persoon met twijfelachtige persoonlijke hygiëne of onvoldoende hygiënische faciliteiten thuis, op werk of op school;
- alle kinderen tot 6 jaar die naar school, kinderdagverblijf of een overige opvanggroep gaan;
- alle mensen die werken in de voedselbereiding;
- zorgmedewerkers of personeel van kinderdagverblijven, die werken met jonge kinderen, ouderen of andere kwetsbare mensen, en van wie de activiteiten het risico op overdracht via de fecaal-orale route verhogen (bijv. hulp bij eten, eten geven of het aanraken van voorwerpen die naar de mond kunnen worden gebracht).
Procedure: drie fecesonderzoeken met een interval van ten minste 1 dag (afgenomen ten minste 3 weken na de laatste koortsdag en ten minste 2 weken na het beëindigen van eventuele antibiotische therapie) moeten alle negatief zijn. Zie ook onderstaand stroomdiagram.
Postexpositieprofylaxe
Niet van toepassing.
Wering
Kinderopvang (0 tot 4 jaar) en basisschool groepen 1 en 2 (inclusief buitenschoolse opvang):
- Patiënt weren totdat de feceskweek driemaal negatief is met een interval van ten minste 1 dag (afgenomen ten minste 3 weken na de laatste koortsdag en ten minste 2 weken na het beëindigen van eventuele antibiotische therapie).
- Gezinscontacten van de patiënt alleen weren bij klachten die kunnen passen bij buiktyfus/paratyfus totdat fecesonderzoek is gedaan. Indien positief wering zoals bij patiënt.
Basisschool groep 3 t/m 8:
- Patiënt weren tot klinisch herstel.
- Gezinscontacten van de patiënt alleen bij klachten die kunnen passen bij buiktyfus/paratyfus weren tot klinisch herstel.
Het onderscheid wat betreft de maatregelen voor wering van (school)kinderen (groep 1-2 versus groep 3-8) berust op de mate waarin het kind kan begrijpen wat (hand- en toilet)hygiëne inhoudt (zie ook de Onderbouwing). Voor bijvoorbeeld het speciaal onderwijs of dagcentra voor verstandelijk gehandicapten kan het advies indien nodig worden aangepast.
Wering van werknemers kan van toepassing zijn, zie onder Arbeidsrelevante aanvullingen.
Arbeidsrelevante aanvullingen
Deze aanvullingen zijn geschreven voor en door bedrijfsartsen en beschrijven de preventieve maatregelen om het oplopen van infectieziekten tijdens het werk te voorkomen (werknemer als risicoloper) en de maatregelen/aanpassingen die genomen kunnen worden bij vaststelling van de infectieziekte bij de werknemer (werknemer als risicovormer). In de werksituatie gelden de Arbowet, het Arbeidsomstandighedenbesluit (Arbobesluit) en de Europese Richtlijn 2000/54 gericht op preventie. Zie ook biologische agentia in de wet (Arboportaal.nl).
Wering van werk
Weren totdat de feceskweek driemaal negatief is met een interval van ten minste 1 dag (afgenomen ten minste 3 weken na de laatste koortsdag en ten minste 2 weken na het beëindigen van eventuele antibiotische therapie), indien:
- betrokkenen werkzaam in de levensmiddelensector (afhankelijk van het werk dat gedaan wordt - wel of geen contact met voedingsmiddelen);
- betrokkenen belast met de directe verzorging van :
- patiënten (i.g.v. buiktyfus);
- (ernstig) immuno-incompetente patiënten (i.g.v. paratyfus).
In de overige patiëntenzorg kan gewoon worden gewerkt, mits klachtenvrij en zeer goede handhygiëne wordt toegepast.
Personeel dat gaat werken in de levensmiddelensector wordt tegenwoordig niet meer standaard gescreend op infectie met Salmonella spp.
Literatuur
- Ali G, Rashid S, Kamli MA, Shah PA, Allaqaband GQ. Spectrum of neuropsychiatric complications in 791 cases of typhoid fever. Trop Med Int Health. 1997;2(4):314-8. https://doi.org/10.1111/j.1365-3156.1997.tb00145.x
- Awofisayo-Okuyelu A, McCarthy N, Mgbakor I, Hall I. Incubation period of typhoidal salmonellosis: a systematic review and meta-analysis of outbreaks and experimental studies occurring over the last century. BMC Infectious Diseases. 2018;18(1):483. https://doi.org/10.1186/s12879-018-3391-3
- Baker S, Holt KE, Clements AC, Karkey A, Arjyal A, Boni MF, et al. Combined high-resolution genotyping and geospatial analysis reveals modes of endemic urban typhoid fever transmission. Open Biol. 2011;1(2):110008. https://doi.org/10.1098/rsob.110008
- Bovée LPMJ, van Kessel RPM, Peerbooms PGH, van den Hoek JAR. Buiktyfus in Amsterdam, 1991-2000, en vereenvoudiging van het landelijk protocol voor bron- en contactopsporing. Ned Tijdschr Geneeskd. 2002;146:1833-7.
- Braddick MR, Crump BJ, Yee ML. How long should patients with Salmonella typhi or Salmonella paratyphi be followed-up? A comparison of published guidelines. J Public Health Med. 1991;13(2):101-7.
- Britto C, Pollard AJ, Voysey M, Blohmke CJ. An Appraisal of the Clinical Features of Pediatric Enteric Fever: Systematic Review and Meta-analysis of the Age-Stratified Disease Occurrence. Clin Infect Dis. 2017;64(11):1604-11. https://doi.org/10.1093/cid/cix229
- Broertjes J, Jansen R, Verly I, van der Zwaluw K, van Dam A. Typhoid fever due to laboratory-acquired Salmonella Typhi, confirmed by core genome multi-locus sequence typing. Diagnostic Microbiology and Infectious Disease. 2023;107(2):116016. https://doi.org/10.1016/j.diagmicrobio.2023.116016
- CDC. Typhoid Fever 2023. Beschikbaar via: https://www.cdc.gov/typhoid-fever/about/index.html. Geraadpleegd op 5 februari 2024.
- Chart H. The pathogenicity of strains of Salmonella paratyphi B and Salmonella java. J Appl Microbiol. 2003;94(2):340-8. https://doi.org/10.1046/j.1365-2672.2003.01863.x
- Cruz Espinoza LM, McCreedy E, Holm M, Im J, Mogeni OD, Parajulee P, et al. Occurrence of Typhoid Fever Complications and Their Relation to Duration of Illness Preceding Hospitalization: A Systematic Literature Review and Meta-analysis. Clinical Infectious Diseases. 2019;69(Supplement_6):S435-S48. https://doi.org/10.1093/cid/ciz477
- Dongol S, Thompson CN, Clare S, Nga TVT, Duy PT, Karkey A, et al. The Microbiological and Clinical Characteristics of Invasive Salmonella in Gallbladders from Cholecystectomy Patients in Kathmandu, Nepal. PLOS ONE. 2012;7(10):e47342. https://doi.org/10.1371/journal.pone.0047342
- Dupont HL, Hornick RB, Snyder MJ, Dawkins AT, Heiner GG, Woodward TE. Studies of immunity in typhoid fever. Protection induced by killed oral antigens or by primary infection. Bull World Health Organ. 1971;44(5):667-72.
- Everest P, Wain J, Roberts M, Rook G, Dougan G. The molecular mechanisms of severe typhoid fever. Trends in Microbiology. 2001;9(7):316-20. https://doi.org/10.1016/s0966-842x(01)02067-4
- Gal-Mor O, Boyle EC, Grassl GA. Same species, different diseases: how and why typhoidal and non-typhoidal Salmonella enterica serovars differ. Front Microbiol. 2014;5:391. https://doi.org/10.3389/fmicb.2014.00391
- GBD 2017 Typhoid and Paratyphoid Collaborators. The global burden of typhoid and paratyphoid fevers: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Infect Dis. 2019;19(4):369-81. https://doi.org/10.1016/s1473-3099(18)30685-6
- Gibani MM, Jin C, Shrestha S, Moore M, Norman L, Voysey M, et al. Homologous and heterologous re-challenge with Salmonella Typhi and Salmonella Paratyphi A in a randomised controlled human infection model. PLoS Negl Trop Dis. 2020;14(10):e0008783. https://doi.org/10.1371/journal.pntd.0008783
- Gunn JS, Marshall JM, Baker S, Dongol S, Charles RC, Ryan ET. Salmonella chronic carriage: epidemiology, diagnosis, and gallbladder persistence. Trends Microbiol. 2014;22(11):648-55. https://doi.org/10.1016/j.tim.2014.06.007
- Harris JB, Ryan ET. Enteric Fever and other causes of fever and abdominal symptoms. In: Bennett JE, Dolin R, MJ B, editors. Mandell, Douglas, and Bennett's principles and practice of infectious diseases. Philadelphia: Elsevier Saunders; 2015. p. 1270-9.
- Hassing RJ, Verbon A, de Visser H, Hofman A, Stricker BH. Proton pump inhibitors and gastroenteritis. Eur J Epidemiol. 2016;31(10):1057-63. https://doi.org/10.1007/s10654-016-0136-8
- Marchello CS, Birkhold M, Crump JA. Complications and mortality of typhoid fever: A global systematic review and meta-analysis. Journal of Infection. 2020;81(6):902-10. https://doi.org/10.1016/j.jinf.2020.10.030
- Marmion DE, Naylor GR (Gezondheidsraad), Stewart IO. Second attacks of typhoid fever. J Hyg (Lond). 1953;51(2):260-7. https://doi.org/10.1017/s0022172400015680
- Maskey AP, Day JN, Phung QT, Thwaites GE, Campbell JI, Zimmerman M, et al. Salmonella enterica serovar Paratyphi A and S. enterica serovar Typhi cause indistinguishable clinical syndromes in Kathmandu, Nepal. Clin Infect Dis. 2006;42(9):1247-53. https://doi.org/10.1086/503033
- Nabarro LE, McCann N, Herdman MT, Dugan C, Ladhani S, Patel D, et al. British Infection Association guidelines for the diagnosis and management of enteric fever in England. Journal of Infection. 2022;84(4):469-89. https://doi.org/10.1016/j.jinf.2022.01.014
- Ooms D, de Vries A, Koedijk FD, Generaal E, Friesema IH, Rouvroye M, et al. Large outbreak of typhoid fever on a river cruise ship used as accommodation for asylum seekers, the Netherlands, 2022. Eurosurveillance. 2024;29(5):2300211. https://doi.org/10.2807/1560-7917.ES.2024.29.5.2300211
- Parry CM, Hien TT, Dougan G, White NJ, Farrar JJ. Typhoid Fever. New England Journal of Medicine. 2002;347(22):1770-82. https://doi.org/10.1056/NEJMra020201
- Reller ME, Olsen SJ, Kressel AB, Moon TD, Kubota KA, Adcock MP, et al. Sexual transmission of typhoid fever: a multistate outbreak among men who have sex with men. Clin Infect Dis. 2003;37(1):141-4. https://doi.org/10.1086/375590
- Russell K, Addiman S, Grynszpan D, Freedman J, Lopez Bernal J, Yin Z, et al. The impact of new national guidance for the public health management of enteric fever in England. Public Health. 2018;154:79-86. https://doi.org/10.1016/j.puhe.2017.10.018
- Saporito L, Colomba C, Titone L. Typhoid Fever. In: Quah SR, editor. International Encyclopedia of Public Health (Second Edition). Oxford: Academic Press; 2017. p. 277-83.
- Sulaiman K, Sarwari AR. Culture-confirmed typhoid fever and pregnancy. Int J Infect Dis. 2007;11(4):337-41. https://doi.org/10.1016/j.ijid.2006.09.007
- Toboldt A, Tietze E, Helmuth R, Fruth A, Junker E, Malorny B. Human infections attributable to the D-tartrate-fermenting variant of Salmonella enterica serovar Paratyphi B in Germany originate in reptiles and, on rare occasions, poultry. Appl Environ Microbiol. 2012;78(20):7347-57. https://doi.org/10.1128/aem.01732-12
- van Pelt W, van der Zee H, Wannet WJ, van de Giessen AW, Mevius DJ, Bolder NM, et al. Explosive increase of Salmonella Java in poultry in the Netherlands: consequences for public health. Euro Surveill. 2003;8(2):31-5. https://doi.org/10.2807/esm.08.02.00398-en
- Vogelsang TM, BØE J. Temporary and chronic carriers of Salmonella typhi and Salmonella paratyphi B. J Hyg (Lond). 1948;46(3):252-61. https://doi.org/10.1017/s0022172400036378
- WHO (World Health Organization). Background document: The diagnosis, treatment and prevention of typhoid fever. 2003.
- Wollin R, on behalf of the Enter-net participants. A study of invasiveness of different Salmonella serovars based on analysis of the Enter-net database. Weekly releases (1997–2007). 2007;12(39):3275. https://doi.org/10.2807/esw.12.39.03275-en