Samenvatting
Verwekker: Influenzavirus
Incubatieperiode: 1 tot 4 dagen (meestal 2 dagen)
Besmettingsweg: Aerogeen en (in)direct contact
Besmettelijke periode: Dag voor symptomen tot 5-7 dagen
Maatregelen: Bron- en contactonderzoek niet nodig bij gewone influenza-epidemieën
Symptomen: Acuut begin met meestal koorts, hoesten, keelpijn, kortademigheid, hoofdpijn, spierpijn en vermoeidheid
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 5 maart 2024
Wijzigingen vanaf laatste vaststelling LOI:
- 18 maart 2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en waar van toepassing arbeidsrelevante aanvullingen en veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen.
- 8 oktober 2024: de WHO (World Health Organization) concludeert dat influenzavirus B/Yamagata-lijn niet meer circuleert. Vanaf 2025/2026 bevatten de in Nederland gebruikte influenzavaccins geen B/Yamagata-lijn component meer.
- 22 april 2024: aanpassingen diagnostiekparagraaf mbt typering.
- 31 januari 2024: De richtlijn is herzien onder leiding van Sophie Niemansburg en Linda Smid. Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn:
- Pathogenese verschillende fases in het beloop beschreven en de rol van de immuniteit.
- Bij Ziekteverschijnselen informatie toegevoegd over een verhoogd risico op myocardinfarct in de eerste week na infectie; patiënten met ernstige influenza op de IC (Intensive care) hebben een verhoogd risico op invasieve pulmonale infecties met Aspergillus spp.
- Incubatieperiode is aangepast conform de WHO en CDC.
- Besmettingsweg aangepast: uitleg over aerosolen (druppelkernen) in druppelwolk toegevoegd en dat overdracht op lange afstand nog onvoldoende bewezen is. De relatieve rol van elk van de 3 transmissieroutes is nog onbekend.
- Paragraaf Algemene preventieve maatregelen: conform de LCI (Landelijke Coördinatie Infectieziektebestrijding)-richtlijn COVID-19 de generieke adviezen voor het voorkomen van respiratoire infecties toegevoegd.
- Meldplicht: toegevoegd dat o.b.v. artikel 26 van de Wpg (Wet publieke gezondheid) hoofden van instellingen een ongewoon aantal zieken met een ernstige aandoening van vermoedelijk infectieuze aard, bijvoorbeeld luchtweginfecties, dienen te melden bij de GGD (Gemeentelijke gezondheidsdienst).
- Bij maatregelen toegevoegd dat bij contacten met een zeer hoog risico op ernstig beloop op influenza postexpositieprofylaxe overwogen kan worden. Contacten van een persoon met een resistent virus zijn gedefinieerd.
- Pre-expositieprofylaxe adviezen aangepast met de IDSA guideline 2019 en ECDC (European Centre for Disease Prevention and Control) rapport 2017 als basis.
- Postexpositieprofylaxe aangepast conform de NHG (Nederlands Huisartsen Genootschap)-richtlijn (dit kan overwogen worden bij personen met een zeer hoog risico op ernstig beloop na blootstelling aan influenza). Voor informatie over uitbraakprofylaxe verwezen naar de bijlage Influenza in instellingen voor langdurige verblijf en het Addendum van Verenso.
- Informatie over baloxavir toegevoegd.
Achtergronden
Verwekker
Influenza is een acute (bovenste) luchtweginfectie die wordt veroorzaakt door een van de drie typen influenzavirussen A, B en C (Nicholson 2003). Influenzavirussen behoren tot de RNA-virusfamilie Orthomyxoviridae. Bij influenzavirus A en B is het virus-RNA aanwezig in de vorm van 8 gensegmenten. Het influenzavirus C heeft 7 gensegmenten. Die gensegmenten coderen voor minstens 11 eiwitten. De type A-virussen zijn te verdelen in subtypen op basis van de oppervlakte-eiwitten van het virus: hemagglutinine (H) en neuraminidase (N). Er zijn 18 H-subtypen en 11 N-subtypen van het type A-influenzavirus. Deze virussen zijn oorspronkelijk geïntroduceerd uit het vogelrijk. Van het influenza B-virus bestaan er twee genetische lijnen (lineages) gebaseerd op het gen voor het H-eiwit, die antigeen verschillend zijn: de Victoria/2/87-lineage en de Yamagata/16/88-lineage (Lin 2004). Bij type A en B influenzavirussen zijn het H- en N-eiwit noodzakelijk om een cel binnen te komen en weer vrij te komen van een geïnfecteerde cel. Bij influenzavirus type C is het HE-eiwit voor beide functies verantwoordelijk. Hoewel type C-influenzavirussen bij mensen ziekte kunnen veroorzaken, komt dit dusdanig weinig voor en is dit dusdanig mild dat dit type in deze richtlijn verder buiten beschouwing gelaten wordt.
Overigens laat de influenzasurveillance zien dat sinds maart 2020 van alle onderzochte natuurlijk circulerende influenza B-virussen er wereldwijd geen tot de B/Yamagata-lijn behoorden (Paget 2022). De WHO concludeert dat dit aangeeft dat influenzavirus B/Yamagata-lijn niet langer circuleert en in de toekomst naar alle waarschijnlijkheid geen epidemieën meer zal veroorzaken (WHO 2023).
Het subtype A(H1N1) circuleerde van 1918‑1956 en van 1977‑2009, subtype A(H2N2) van 1957‑1968 en subtype A(H3N2) van 1968 tot heden. In 2009 verscheen een nieuwe A(H1N1)-variant die de influenzapandemie in de 21e eeuw veroorzaakte en de oude A(H1N1)-variant verving. De nieuwe variant vertoont wel overeenkomsten met het A(H1N1)-virus van vóór 1957, waardoor ouderen relatief beschermd waren tegen deze nieuwe variant. Deze A(H1N1)-variant, door de WHO voorzien van de naam A(H1N1)pdm09, circuleert nu nog en is inmiddels een endemisch seizoensinfluenzavirus geworden (Koopmans 2009), zoals ook de subtypes A(H1N1), A(H3N2) en de lineages van influenza B endemische seizoensinfluenzavirussen zijn. Naast het optreden van seizoensinfluenza kan er ook overdracht zijn van influenzavirus van dier-op-mens (zoönotisch). Voor meer informatie, zie de LCI-richtlijn Influenza van dierlijke oorsprong.
Vervanging van het ene door het andere subtype van het type A-influenzavirus vanuit de vogelwereld, waarbij het H en soms ook het N sprongsgewijs verandert, heet antigene shift en kan gepaard gaan met een influenzapandemie omdat er geen immuniteit tegen een voor de mens volledig nieuw subtype bestaat. Ook gelijktijdige besmetting met een dierlijk en een humaan influenzavirus geeft een kans op uitwisseling van erfelijk materiaal tussen deze virussen (reassortment) en de ontwikkeling van een potentieel pandemisch influenzavirus. Tussen de pandemieën in ondergaan H en N frequent kleine cumulatieve aminozuurveranderingen die tot antigene veranderingen kunnen leiden, waar de bestaande afweer onvoldoende tegen beschermd is. Binnen 1 tot 5 jaar kan daardoor telkens weer een nieuwe antigene virusvariant ontstaan, dit heet antigene drift. Antigene drift komt ook voor bij het type B-influenzavirus.
Epidemiologie
Verspreiding in de wereld
Influenza treedt epidemisch op tussen november en april op het noordelijk halfrond en tussen april en november op het zuidelijk halfrond. In tropische gebieden is influenza dikwijls endemisch gedurende het gehele jaar. Wereldwijd resulteren epidemieën van seizoensinfluenza jaarlijks in 3 tot 5 miljoen gevallen van ernstige ziekte en ongeveer 290.000 tot 650.000 dodelijke slachtoffers (WHO 2023).
Voorkomen in Nederland
Het voorkomen van influenza in Nederland volgt het patroon van het noordelijk halfrond. Volgens gegevens van het Nivel over de periode 1970-2006 ligt het begin van de influenza-epidemie in Nederland meestal eind december, maar dit varieert van half november tot begin maart. Ook kan de duur variëren van enkele weken tot ruim 4 maanden (gemiddeld 11 weken) (Donker 2007).
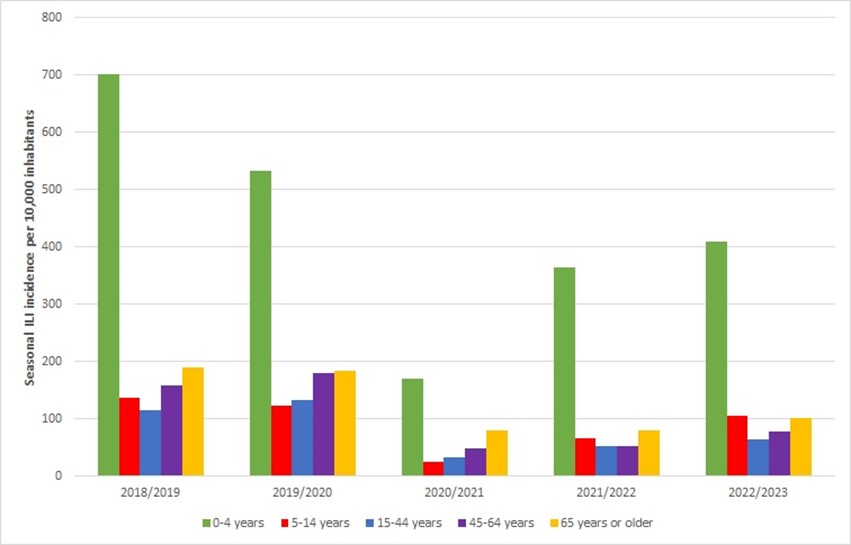
De incidentie van personen met een influenza-achtig ziektebeeld die de huisarts bezoeken varieert van jaar tot jaar. In de respiratoire seizoenen 2018/2019 tot en met 2022/2023 was de incidentie gemiddeld 13 per 1.000 personen per seizoen met een spreiding van 7 tot 17 (RIVM 2023). In dit gemiddelde is het seizoen 2020/2021 geëxcludeerd, omdat er toen nauwelijks influenzavirus werd gedetecteerd, waarschijnlijk als gevolg van de toen geldende coronamaatregelen. Influenza-achtige ziektebeelden komen relatief vaak voor bij kinderen jonger dan 5 jaar (zie figuur hieronder). Tijdens de 5 griepseizoenen tussen 2018 en 2023 kregen gemiddeld 50 op de 1.000 kinderen een influenza-achtig ziektebeeld (RIVM 2023). Voor mensen van 65 jaar en ouder was dat met 14 op de 1.000 een stuk lager. Ook deze gemiddelden zijn zonder data van seizoen 2020/2021. Voor de COVID-19-pandemie spraken het Nivel, NIC-Erasmus MC en NIC-RIVM van een griepepidemie wanneer 2 weken achter elkaar meer dan 58 op de 100.000 mensen zich bij de huisarts meldden met griepachtige klachten en in keel- en neusmonsters van patiënten die zich meldden met griepachtige klachten bij de huisarts griepvirus werd aangetoond. Echter, sinds de COVID-19-pandemie gaan minder mensen met een influenza-achtig ziektebeeld naar de huisarts. Om deze reden baseren Nivel, NIC-Erasmus MC en NIC-RIVM sindsdien de start en het einde van een griepepidemie op basis van de resultaten van alle beschikbare influenza surveillance systemen (RIVM 2023).
Figuur: Incidentie symptomatische influenza in Nederland over de respiratoire seizoenen 2018/2019 t/m 2022/2023 week 40 t/m week 20 (RIVM 2023)
De afgelopen 10 seizoenen (2013/2014 t/m 2022/2023) duurde de griepepidemie gemiddeld 13 weken (exclusief seizoen 2020/2021). De griepepidemie van seizoen 2022/2023 duurde 14 weken. De griepepidemie van 2014/2015 duurde met 21 weken langer dan gebruikelijk en was de langste ooit gemeten. Meestal ligt de piek rond februari (RIVM 2019). Epidemieën worden echter gekenmerkt door grote variatie in start en duur.
Afhankelijk van het type influenzavirus dat dominant is in het seizoen, verschillen de leeftijdsgroepen die het meest getroffen zijn en verschilt de mate van hospitalisatie en sterfte: tijdens het influenza-seizoen 2017/2018 werden ouderen vooral ziek van influenzavirus type A(H3N2), terwijl kinderen, zwangeren en jongvolwassenen met onderliggend lijden vaker ziek werden van A(H1N1)pdm09.
Volgens CBS (Centraal Bureau voor de Statistiek)-gegevens over de jaren 2013-2022 overlijden in Nederland tijdens een gemiddelde winterepidemie gemiddeld 419 (range 21 - 1207) personen direct of indirect aan influenza. Dit is echter een onderschatting van de sterfte waarbij influenza een rol speelt, omdat de doodsoorzakenstatistiek van het CBS vaak de onderliggende doodsoorzaak (bijvoorbeeld een chronische hartaandoening) registreert en niet de directe doodsoorzaak (bijvoorbeeld influenza) (bron: Doodsoorzaken Statistiek CBS).
Zie voor actuele informatie over het voorkomen van influenza in Nederland:
- Griep (RIVM.nl)
- Stand van zaken griep (RIVM.nl)
Pathogenese
De porte d’entrée van humane influenzavirussen wordt gevormd door slijmvliezen van de luchtwegen en incidenteel de conjunctiva (Koopmans 2004, Kuiken 2008). Het virus hecht zich via speciale receptoren aan de cellen van het respiratoire epitheel van neus, conjunctivae, farynx, larynx, trachea en bronchiën, wordt in deze opgenomen en repliceert zich in deze cellen. De besmette cellen kunnen veel virusdeeltjes produceren, maar zullen uiteindelijk sterven. Dit leidt tot beschadiging van (delen van) het respiratoir epitheel, vooral het trilhaarepitheel. Soms kunnen ook de cellen van de pulmonaire alveoli besmet raken, met een virale pneumonie als gevolg (Kuiken 2008). Bepaalde commensale bacteriën (zoals H. influenzae, pneumokokken, S. aureus) kunnen van de celbeschadigingen gebruikmaken, vooral van het verlies van de trilhaarfunctie, en een secundaire bacteriële infectie veroorzaken, bijvoorbeeld otitis media, sinusitis en bacteriële pneumonie (Brundage 2006). Ook kan een virale co-infectie optreden, waarbij bijvoorbeeld een co-infectie met SARS-CoV-2 geassocieerd is met een ernstiger beloop (Swets 2022). Bij muizen werd een verhoogde SARS-CoV-2 besmettelijkheid waargenomen, waarschijnlijk als gevolg van verhoogde ACE2-expressie als gevolg van een influenzavirusinfectie (Bai 2021).
De pathogenese van de ziekte influenza verloopt in twee fases. De eerste fase duurt 1 tot 3 dagen, waarin de piek virale titer wordt bereikt die bepalend is voor de bijkomende inflammatie. Hierin speelt de aangeboren afweer een grote rol, samen met eventuele bestaande verworven immuniteit. De tweede fase kan leiden tot herstel van de ziekte danwel resulteren in ernstige ziekte (bijvoorbeeld ARDS) of overlijden. In deze fase komt de verworven afweer op gang die een cruciale rol speelt bij bescherming tegen infectie en ernstige ziekte. Dit bestaat uit een humorale respons (secretoir IgA en serum IgG) die een grote rol heeft in het opbouwen van immuniteit, en een cellulaire respons (T-cellen) die effectief is in virale eliminatie (Cox 2004, Gounder 2019). Virale en host factoren (waaronder leeftijd, comorbiditeit, microbioom, obesitas) kunnen de immuunrespons dereguleren en leiden tot ernstige ziekte (Gounder 2019).
Incubatieperiode
De incubatieperiode is 1 tot 4 dagen (meestal 2 dagen) (CDC 2022, WHO 2023).
Ziekteverschijnselen
Afhankelijk van het type virus, de gastheer en immuniteit in de populatie, kunnen de ziekteverschijnselen verschillen. Gastheerfactoren zijn onder meer de leeftijd, het geslacht, onderliggend lijden en het hebben van circulerende antistoffen tegen influenza door eerdere infecties en vaccinaties. Infectie met influenzavirus kan asymptomatisch of subklinisch verlopen. De prevalentie hiervan kan sterk variëren: in uitbraakonderzoeken was de asymptomatische fractie gemiddeld 16% (range 4-28%), in trans-epidemische studies was dit zeer heterogeen (range 0-100%) (Leung 2015). Welke factoren hier invloed op hebben, naast het studiedesign en gehanteerde definities van (a)symptomatische infectie, is nog niet duidelijk (Furuya-Kanamori 2016, Leung 2015). Wordt de ziekte symptomatisch, dan ontwikkelt zich meestal het zogenaamde influenza-achtige ziektebeeld (Commissie 2008):
(1) acuut begin en (2) minstens één van: koorts of subfebriele temperatuur, malaise, hoofdpijn, spierpijn, en (3) minstens één van: hoesten, keelpijn, kortademigheid.
Aanvullend komen neusverkoudheid, zwakte en verlies van eetlust frequent voor (Eccles 2005). Het A(H1N1)pdm09-virus heeft inmiddels een vergelijkbare klinische presentatie als seizoensinfuenza (Ong 2009). De beste voorspellers voor influenza zijn hoesten en koorts. Deze combinatie van symptomen heeft een positief voorspellende waarde van 80% in het onderscheiden van influenza in een populatie met griepachtige symptomen (Monto 2000). Koorts is meestal een vroeg symptoom maar is van korte duur (3-4 dagen) (Eccles 2005). Bij kwetsbare ouderen kunnen de verschijnselen aanzienlijk minder 'kenmerkend' zijn. Na daling van de lichaamstemperatuur volgt een herstelperiode van 1 of 2 weken (soms meer) tot volledig herstel (Treanor 2021).
De belangrijkste en meest voorkomende complicaties zijn virale pneumonie, acute bronchitis, myocarditis en secundaire bacteriële infecties, vooral otitis media en pneumonie (Kuiken 2008). Hiernaast is influenza in de eerste week na de infectie geassocieerd met een verhoogd risico op een hartinfarct bij patiënten met pre-existent coronairlijden (Kwong 2018). Onder volwassenen opgenomen op de intensive care met ernstige influenza is in eerdere griepseizoenen een hoge incidentie (ca. 20%) van invasieve pulmonale infecties met Aspergillus spp. waargenomen (SWAB 2023, Vanderbeke 2021).
In een analyse van morbiditeit en mortaliteit door influenza onder personen in Nederland over de periode 2011-2020, werd de case fatality rate (CFR) geschat op 0.12% (95% BI 0.116–0.123%) voor alle leeftijden en alle typen influenzavirusinfecties. De geschatte CFR was het hoogste voor influenza A(H3N2) en personen van 85 jaar of ouder (McDonald 2023).
Natuurlijke immuniteit
De infectie wordt direct bestreden door aspecifieke afweermechanismen, later ondersteund door de specifieke (cellulaire en humorale) afweer (Cox 2004, Tamura 2004). Neutraliserende antistoffen bereiken bij primaire infectie gewoonlijk in 4 weken een maximale titer, na herinfectie eerder. Middels gevormde immuniteit kan gedurende circa 5 jaar herbesmetting met hetzelfde virus worden voorkomen, maar nieuwe virusvarianten, ontstaan door antigene drift, omzeilen deze immuniteit binnen 1 tot 5 jaar. Het is echter wel zo dat bestaande partiële kruisimmuniteit de ziekteverschijnselen vermindert. De celgemedieerde afweer speelt een rol in het herstel van de infectie en het voorkomen van complicaties, maar lijkt geen duidelijke bijdrage te leveren aan het voorkomen van de infectie (Cox 2004).
Pasgeborenen zijn door maternale antistoffen (ook in de moedermelk) beschermd indien nog geen of beperkte antigene drift of shift is opgetreden (Puck 1980, Reuman 1987, Zaman 2008). De mate van bescherming zal ook beïnvloed worden door de timing van de doorgemaakte infectie van de moeder.
Reservoir
Van de humane influenzavirussen is de mens het reservoir (Nicholson 2003). Overdracht vanuit dierlijke virusreservoirs (vogels, varkens, paarden) naar de mens komt sporadisch tot regelmatig voor, afhankelijk van diersoort en type influenzavirus. Een voorbeeld waarbij dit in Nederland optrad, is de A(H7N7)-vogelpestuitbraak in 2003 onder kippen, waarbij meer dan 90 mensen werden geïnfecteerd en een geïnfecteerde dierenarts eraan overleed (Fouchier 2004, Koopmans 2004). Het A(H5N1)vogelgriepvirus infecteert regelmatig mensen. Infecties van mensen met varkensinfluenzavirus worden regelmatig gevonden, maar leidde in 2009 tot een pandemie met het A(H1N1)pdm09-virus. Het paarden A(H7)-virus is anders dan het A(H7) vogelgriepvirus en infecteert zelden mensen. De kans op een nieuw pandemisch virus na een individuele infectie met een dierlijke influenza is erg klein, maar vereist wel een continue surveillance van influenza in de bevolking. In Nederland wordt deze op doorlopende basis verricht door het Nationaal Influenza Centrum (NIC; RIVM en Erasmus MC), in samenwerking met het Nivel, Nederlands instituut voor onderzoek van de gezondheidszorg.
Transmissie
Besmettingsweg
Aerogeen
Transmissie van influenzavirus vindt doorgaans plaats door hoesten of niezen via virusbevattende druppels op korte afstand die vervolgens door een contact worden ingeademd. Bij hoesten of niezen bevat de 'druppelwolk' naast druppels ook druppelkernen (aerosolen) die op verdere afstand en voor een lange duur (meerdere uren) kunnen blijven zweven in de lucht (Killingley 2013). De minimale besmettingsdosis via druppelkernen die in de lagere luchtwegen terecht kunnen komen is zeer gering, in de orde van een of enkele virusdeeltjes (Tellier 2006). Transmissie van druppelkernen op korte afstand lijkt plausibel uit aerobiologische studies, overdracht op langere afstand is tot heden onvoldoende bewezen (Killingley 2013, Kutter 2018). De relatieve bijdrage van druppelkernen in de transmissie is dan ook nog niet bekend.
Contact
Transmissie is daarnaast mogelijk via direct contact, zoals kussen en handen geven (Tellier 2009, Weber 2008). Transmissie via oppervlakken wordt eveneens aannemelijk geacht, waarbij anderen besmet kunnen raken via indirect contact. De duur van overleving van het virus op het oppervlak is zeer heterogeen en afhankelijk van o.a. het type oppervlak, temperatuur en luchtvochtigheid. Dit varieert van een paar uur tot een aantal dagen (langer op harde (niet-poreuze) oppervlakken dan zachte (poreuze) oppervlakken) (Killingley 2013). Er is substantieel bewijs voor overdracht via (in)direct contact, maar de relatieve rol van elke manier van overdracht is onzeker (Treanor 2021).
Besmettelijke periode
De besmettelijke periode komt overeen met de duur van de virusreplicatie en uitscheiding (Baccam 2006, Carrat 2008, Fiore 2008, Leekha 2007, Liao 2010). Virus wordt uitgescheiden 1 dag voordat symptomen optreden, met een piek 1 tot 3 dagen na begin van symptomen, met een snelle afname tot meestal 5 tot 7 dagen na begin van de symptomen (Baccam 2006, CDC 2022, Ip 2016, Liao 2010). Jonge kinderen kunnen virus tot enkele dagen voor begin van symptomen tot meer dan 10 dagen na begin van symptomen uitscheiden. Immuungecompromitteerde personen kunnen influenzavirus weken tot maanden uitscheiden.
Besmettelijkheid
Het aantal uitgescheiden virusdeeltjes per persoon per dag is afhankelijk van virustype, subtype, tijdstip in ziekteperiode, eventueel opgebouwde (kruis)immuniteit en van de leeftijd van de persoon, waarbij het bij kinderen en adolescenten het hoogst is (Baccam 2006).
Omgeving en seizoensvariatie
Luchtvochtigheid en temperatuur spelen een rol in de overleving van influenzavirussen en daarmee in de manier en mate van overdraagbaarheid (Lowen 2007, Lowen 2008, Shaman 2009). Onder koude, droge omstandigheden, zoals in de winter, blijkt transmissie via druppelkernen het meest efficiënt. Bij een hogere temperatuur (30 °C), zoals in de tropen en subtropen, wordt aerogene transmissie via kleine druppelkernen verminderd door een direct temperatuur- en luchtvochtigheideffect op het virus (Lowen 2008). Temperatuur en luchtvochtigheid kunnen daarnaast van invloed zijn op de fysiologische functies en daarmee op de immuniteit van de host (Tamerius 2011).
In gematigde klimaten vinden influenza-epidemieën bijna alleen plaats in de wintermaanden. Mogelijk spelen temperatuur, luchtvochtigheid, zonlicht en sociale factoren hierbij een rol. Seizoensvariatie kan ook worden waargenomen in tropische klimaten met een verhoogde activiteit tijdens een periode met een lage absolute luchtvochtigheid, hoewel influenza het hele jaar door kan voorkomen en de schommelingen niet groot zijn (Azziz Baumgartner 2012). Seizoensvariatie kan ook in verband worden gebracht met gedragsveranderingen die de overdracht kunnen vergroten, zoals drukte ('crowding') binnenshuis of schoolbezoek (Huang 2017, Tamerius 2011).
Risicogroepen
Verhoogde kans op infectie
Iedereen loopt tijdens een epidemie risico met het influenzavirus te worden besmet. De kans hierop is het grootst in besloten, drukbezochte ruimten (kantoor, openbaar vervoer, school, kinderdagverblijven, disco, etc.). De hoogste incidentie van een influenza-achtig ziektebeeld wordt meestal bij 0- tot 4-jarigen gevonden (Voorkomen in Nederland).
Verhoogde kans op ernstig beloop
De groepen met een verhoogd risico op complicaties worden bepaald door patiënt-gerelateerde factoren, zoals de reeds opgebouwde afweer en leeftijd én onderliggende ziektes zoals diabetes en longaandoeningen.
Zuigelingen kunnen een verhoogde kans hebben op een ernstig beloop, waarbij een systematic review een verhoogde incidentie van influenza-gerelateerde ziekenhuisopnames beschrijft (Fell 2017). Deze incidentie loopt in de geïncludeerde studies echter uiteen, mogelijk door jaarlijkse fluctuaties in de incidentie en ernst van de griep, verschillen in zorg en methodologische factoren.
Verschillende studies laten zien dat zwangeren een groter risico lopen om opgenomen te worden in het ziekenhuis ten opzichte van niet-zwangeren (Mazagatos 2018, Mertz 2017, Puig-Barberà 2016). Dit risico bestaat met name in het derde trimester (≥ 28 weken) vanwege de mechanische beperking door de groeiende buik met als gevolg verkleining van de longcapaciteit, waardoor er vaker complicaties zoals een pneumonie optreden, met name naarmate de zwangerschap vordert. Ook treden immunologische veranderingen op tijdens de zwangerschap, waardoor zwangeren gevoeliger zijn voor, of ernstig getroffen worden door bepaalde virale infecties waaronder influenza (Jamieson 2006).
Sterfte door influenza komt vooral voor bij patiënten boven de 60 jaar (95% van de gevallen) en is vaak het gevolg van een complicatie, zoals viruspneumonie, bacteriële pneumonie, hartinfarct, hartfalen, een ontregeling van diabetes mellitus en respiratoire insufficiëntie bij astma of COPD (NHG/SNPG 2016).
Groepen met een verhoogd risico op een ernstig beloop zijn opgenomen in het Nationaal Griep Programma. Voor een overzicht van de groepen zie:
- het Gezondheidsraadsadvies
- de factsheet Influenzavaccinatie
Behandeling
Omdat influenza bij van tevoren gezonde personen meestal een onschuldige aandoening is die vanzelf geneest, behoeft het in het algemeen geen behandeling (Van Essen 2009). Een koorts- en pijnverlagend middel kan gebruikt worden om de symptomen te verlichten. Ook neusdruppels kunnen de symptomen verlichten.
Antivirale middelen
Therapie met antivirale middelen kan overwogen worden bij patiënten met een hoog risico op complicaties, die bewezen of vermoedelijk influenza hebben, zoals bewoners van verpleeghuizen en immuungecompromitteerden.
Voor meer informatie over de antivirale middelen en indicaties zie:
- SWAB Influenza
- NHG-standaard Influenza
- FMS-richtlijn Behandeling influenza
- Addendum richtlijn Influenza preventie in verpleeghuizen en verzorgingshuizen
Diagnostiek
Zie ook Diagnostisch Vademecum Influenzavirus.
Microbiologische diagnostiek
Doel van diagnostiek is het zo snel mogelijk instellen van adequate infectiepreventiemaatregelen, eventueel cohortering van patiënten en het tijdig starten met antivirale therapie. In de huisartsenpraktijk is de infectie vaak een klinische diagnose, tenzij er een indicatie is voor het starten van antivirale therapie. In dat geval wordt indien mogelijk nader onderzoek geadviseerd met PCR (zie Directe diagnostiek).
Directe diagnostiek
Directe influenzadiagnostiek berust op de detectie van viraal RNA met behulp van NAAT (nucleïnezuur amplificatietest (zoals PCR))/PCR. Veel van de huidige commerciële testen combineren een hoge sensitiviteit met een korte doorlooptijd, variërend van < 30 minuten tot enkele uren. Detectie van viraal antigeen is mogelijk met behulp van antigeentesten, al dan niet gekoppeld aan het geautomatiseerd beoordelen van de testresultaten. Antigeentesten zijn over het algemeen snel: binnen 15-30 minuten is het resultaat beschikbaar. De antigeentesten zijn echter minder gevoelig vergeleken met moleculaire testen en zijn daardoor minder toepasbaar in de ziekenhuissetting. Dit type test is wel geschikt voor bijvoorbeeld een snelle triage en analyse van een uitbraak op locatie.
Indirecte diagnostiek
Detectie van antistoffen voor de laboratoriumdiagnose van influenza is van weinig betekenis voor de individuele patiëntenzorg, omdat een gepaard serum met 2-3 weken tussentijd nodig is voor een betrouwbare diagnose, terwijl bij een natuurlijk beloop van de infectie op het tijdstip van afname van het tweede monster de patiënt doorgaans al genezen is. Serologie wordt met name gebruikt voor onderzoek naar de immunogeniciteit van een influenzavaccin en naar populatie-immuniteit. De klassieke methode die hiervoor gebruikt wordt is de hemagglutinatieremmingsreactie waarbij de resultaten iets zeggen over beschermende immuniteit.
Typering voor bron- en contactonderzoek
Het merendeel van de routine diagnostische testen voor detectie van influenzavirus zijn in staat onderscheid te maken tussen influenza A- en B-virus. Dit onderscheid kan tijdens een influenza-epidemie sturing geven aan het cohorteren van geïnfecteerde patiënten. Moleculaire subtypering van influenza type A-virussen (H1pdm09 of H3) kan van belang zijn als een bepaald subtype een eigenschap verkregen heeft die keuzes in de patiëntenzorg beïnvloeden, zoals antivirale resistentie. Daarnaast is verdere subtypering direct na aantonen van de influenza A-infectie noodzakelijk bij het vermoeden op een infectie met influenza van dierlijke origine, zodat eventueel aanvullende maatregelen genomen kunnen worden (zie richtlijn Influenza van dierlijke oorsprong en draaiboek Aviaire influenza). Deze diagnostiek wordt uitgevoerd bij het Erasmus MC en RIVM (samen met het NIC). Het laboratorium dat de influenzavirusinfectie heeft vastgesteld moet hiervoor na overleg oorspronkelijk patiëntmateriaal doorsturen. Indien het laboratorium zelf moleculaire subtypering uitvoert, moet ook materiaal worden doorgestuurd naar het RIVM of Erasmus MC voor verdere karakterisering van het influenzavirus en het delen van data en monsters met de WHO.
Op populatieniveau is subtypering en verdere karakterisering van influenza A- en B-virus met name van belang om op basis van de circulerende varianten uitspraken te kunnen doen over de te verwachten effectiviteit van het influenzavaccin en om te dienen als input voor vaccinontwikkeling. Hiervoor delen wekelijks diagnostische laboratoria influenzavirus-positieve monsters met het NIC om de virussen genotypisch en fenotypisch te karakteriseren voor de overeenkomst met het vaccin van het seizoen. Ook wordt de antivirale gevoeligheid geanalyseerd. Een geselecteerde subset aan virussen wordt met de WHO gedeeld voor karakterisering in de context van wereldwijd gedetecteerde virussen om een besluit te nemen over de samenstelling van het griepvaccin voor het volgende seizoen en om een goede kandidaat-vaccin virussen te selecteren.
Routine genotypische karakterisering van influenzavirussen in het kader van surveillance duurt in het algemeen 1 tot 2 weken. Fenotypische karakterisering van antigene eigenschappen in relatie tot vaccin-overeenkomst duurt langer omdat het virus eerst gekweekt moet worden (>= 1 maand) en wordt alleen bij het NIC-Erasmus MC gedaan. Fenotypisch testen op antivirale gevoeligheid duurt om dezelfde reden ook langer (2-3 weken).
Bij een uitbraak van influenzavirus of bij verdenking van animale influenzavirusinfectie kan genotypische karakterisering binnen 24-48 uur bekend zijn.
Niet-microbiologische diagnostiek
N.v.t.
Preventie
Immunisatie
Vaccinatie
De hoeksteen van de influenzapreventie in Nederland is de jaarlijkse actieve immunisatie volgens het Nationaal Programma Grieppreventie (NPG) van groepen met hoog risico op complicaties volgend op een influenzavirusinfectie, zoals door de Gezondheidsraad (GR) wordt geadviseerd (Gezondheidsraad 2007). Deze groepen zijn in 2021 herzien door de Gezondheidsraad (Gezondheidsraad 2021).
Het geïnactiveerde influenzavaccin bevat hemagglutinine en neuraminidase van influenza A- en B-virusstammen waarvan op basis van wereldwijde surveillancegegevens wordt verwacht dat ze het betreffende seizoen gaan circuleren. Gezien het influenzavirus B/Yamagata-lijn niet langer circuleert en naar alle waarschijnlijkheid geen epidemieën meer zal veroorzaken (zie Verwekker), adviseert de WHO derhalve dat inclusie van de B/Yamagata-lijn-component in influenzavirusvaccins niet langer gerechtvaardigd is en deze dient te worden weggelaten. Dit advies wordt overgenomen; met ingang van influenzaseizoen 2025/2026 bevatten de in Nederland gebruikte influenzavaccins geen B/Yamagata-lijn-component meer.
De beste tijd om te vaccineren is tussen half oktober en half november, vlak voor de periode waarin influenza-epidemieën kunnen worden verwacht. Op deze manier zijn de titers van de antilichamen maximaal op het moment van uitbreken van de griep, gewoonlijk in december of januari. Bovendien zijn zij dan nog voldoende aanwezig bij een late epidemie.
Voor informatie over de beschikbare vaccins, eigenschappen, contra-indicaties, veiligheid, effectiviteit en beschermingsduur, zie de factsheet Influenzavaccinatie.
Passieve immunisatie
Geen.
Algemene preventieve maatregelen
Volg de generieke adviezen voor het voorkomen van respiratoire infecties:
- Blijf zoveel mogelijk thuis als je je ziek voelt en klachten hebt die passen bij een luchtweginfectie (zoals niezen of hoesten) en werk thuis als dat kan (in overleg met je werkgever).
- Als je klachten hebt passend bij een luchtweginfectie, vermijd dan contact met mensen die (bekend zijn, of aangeven) ernstig ziek (te) kunnen worden van een luchtweginfectie. Draag een mond-neusmasker als contact niet te voorkomen is (bijvoorbeeld bij mantelzorg).
- Houd je aan de algemene hygiëneadviezen voor handen wassen, zie Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg voor zorglocaties of Handen wassen (publieksinformatie).
- Nies en hoest in de elleboog of in een papieren zakdoek.
- Zorg voor voldoende ventilatie. Zie hiervoor paragraaf 5.2 van de Algemene hygiënerichtlijn of volg de eigen sectorspecifieke richtlijn.
De mogelijkheden voor interventie tijdens een epidemie met een seizoensinfluenzavirus zijn beperkt. Omdat influenzavirus ook via handen, deurknoppen en andere voorwerpen verspreid kan worden, worden bovenstaande algemene hygiënemaatregelen geadviseerd. Handen wassen, op de juiste momenten gedurende de dag (zie ook Handen wassen op rivm.nl) met water en zeep, gevolgd door goed drogen, kan de kans op besmetting in enige mate verkleinen (Grayson 2009, Jefferson 2023). Er is onzekerheid over het beschermende effect van het dragen van een mond-neusmasker in het openbaar, mogelijk heeft het weinig of geen effect op het optreden van influenza-achtige ziekte en laboratorium-bevestigde influenza ten opzichte van geen masker dragen (Jefferson 2023).
Reiniging, desinfectie en sterilisatie
In het publieke domein volstaat reiniging. Voor de publieke gezondheidszorg: conform LCI-richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Maatregelen
Meldingsplicht
Er bestaat geen meldingsplicht voor humane seizoensinfluenza van individuele patiënten.
Op basis van artikel 26 van de Wet publieke gezondheid dienen hoofden van instellingen een ongewoon aantal zieken met een ernstige aandoening van vermoedelijk infectieuze aard, bijvoorbeeld luchtweginfecties, te melden bij de GGD. Zie voor meer informatie het draaiboek Artikel 26-meldingen Wpg-instellingen.
Humane infectie ten gevolge van dierlijk influenzavirus is een meldingsplichtige ziekte groep B1, zie LCI-richtlijn Influenza van dierlijke oorsprong.
Verzoek tot inlichting
Laboratoria en/of behandelend artsen worden verzocht de GGD (Gemeentelijke gezondheidsdienst) en het NIC in te lichten bij de detectie van een influenza A-virus bij een patiënt waarbij er aanwijzingen zijn voor blootstelling aan (mogelijk) geïnfecteerde dieren, of als een test met subtypering wordt gebruikt en het virus niet gesubtypeerd kan worden voor H1pdm09 of H3 en het virus in te sturen naar het Nationaal Influenzacentrum. Bij vermoeden van resistentie tegen antivirale middelen (rebound tijdens therapie) of bij het vinden van een resistent influenzavirus met eigen test wordt ook gevraagd dit te rapporteren bij NIC-RIVM. Zie voor de procedure Melden resistentie antivirale middelen.
Inschakelen van andere instanties
Bij een uitbraak in een verpleeghuis of verzorgingshuis kan de plaatselijke GGD ingeschakeld worden door het hoofd van de instelling. Dit is volgens de Wpg verplicht indien het aan artikel 26-melding voldoet. Bij een uitbraak in de werkomgeving dient ook de bedrijfsarts geïnformeerd te worden door het hoofd van de instelling.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing en contactonderzoek zijn bij gewone influenza-epidemieën niet zinvol, de betreffende influenzavirussen zijn dan al te zeer verspreid. In de volgende gevallen kan bronopsporing van toepassing zijn:
- Bij een influenzavirus type A met een ander subtype dan de huidig circulerende seizoensinfluenza A virus-subtypen (potentieel pandemisch influenzavirus) of type A of B influenzavirussen met afwijkende eigenschappen (virulentie), kan bronopsporing helpen transmissie na incidentele introductie of opduiken zo lang mogelijk in te dammen.
- Bij detectie van resistentie tegen een of meerdere influenzavirus antivirale middelen van een virus(sub)type waarbij nog niet eerder natuurlijke resistentie tegen betreffende influenzavirus antivirale middel(en) is beschreven, en waarbij de patiënt niet behandeld is met betreffende antivirale middel(en). Het NIC test standaard op resistentie op ingestuurde influenzavirussen, influenzavirussen gedetecteerd in monsters ingestuurd door huisartsen (Nivel-peilstations) en uit het Infectieradar zelfbemonsteringsmonitoring, voor surveillance doeleinden. In dit geval is het zinvol om navraag te doen naar blootstelling aan een persoon met griep die wel met antivirale middelen is behandeld, deze persoon op te sporen en monsters te laten analyseren op aanwezigheid van influenzavirus en resistentie tegen antivirale middelen door het NIC-RIVM.
Contactonderzoek
Indien een resistent virus(sub)type aangetoond is met niet eerder beschreven natuurlijke resistentie, is het zinvol om verspreiding van het virus in te dammen en contacten op te sporen. Contacten van een persoon met een resistent virus zijn:
- gezinsleden en anderen die gezamenlijk met de patiënt een huishouden delen;
- personen die langer dan 4 uur in dezelfde ruimte zijn geweest met de patiënt in diens besmettelijke periode;
- medisch en verplegend personeel voor zover deze geen gebruik hebben gemaakt van persoonlijke beschermingsmaatregelen.
Maatregelen ten aanzien van index, contacten en bron
- Volg de generieke adviezen voor het voorkomen van respiratoire infecties, zie Algemene preventieve maatregelen.
- Overweeg postexpositieprofylaxe bij blootgestelde contacten met een zeer hoog risico op ernstig beloop van influenza, zie Profylaxe.
Gehospitaliseerde influenzapatiënten worden opgenomen in druppelisolatie, voor meer informatie zie de WIP-richtlijn druppelisolatie (SRI-richtlijn Isolatie is ontwikkeling). Voor maatregelen rondom influenza-uitbraken in de langdurige ouderenzorg en gehandicaptenzorg zie de NVVA -richtlijn Influenzapreventie 2004, het addendum Influenzapreventie 2022 en bijlage Influenza in instellingen voor langdurig verblijf. Het is van belang de aanvullende maatregelen (bijvoorbeeld het gebruik van een mond-neusmasker of het dragen van handschoenen) te expliciteren in het infectiepreventiebeleid van de instelling.
Maatregelen bij resistentie
Het NIC test voor surveillance doeleinden standaard influenzavirussen die zijn ingestuurd door diagnostische laboratoria en afkomstig van de huisartsenpeilstations van Nivel Zorgregistraties Eerste Lijn en van Infectieradar op resistentie tegen antivirale middelen.
- Bij een influenzageval met een nieuwe resistentie tegen een antiviraal middel dienen de algemene maatregelen zoals in de paragraaf Algemene preventieve maatregelen beschreven zijn, strikt gevolgd te worden om verspreiding van het resistente virus te limiteren.
- Contacten van een persoon met een resistent virus dienen bemonsterd te worden. Bij een positief monster wordt vrijwillige quarantaine geadviseerd om verdere verspreiding te voorkomen.
- Als er een indicatie is voor behandeling, kan behandeling met een ander antiviraal middel overwogen worden. Voor behandeladviezen bij aangetoonde resistentie tegen oseltamivir zie de FMS-richtlijn Behandeling influenza. Zie de review 2022 van de WHO GISRS Antiviral Working Group voor een overzicht van wereldwijde resistentie tegen neuramidaseinhibitors en baloxavir.
Postexpositieprofylaxe
Voor uitgebreide productinformatie van antivirale middelen, zie:
- Oseltamivir (Tamiflu)
- Zanamivir (Relenza)
- Baloxavir marboxil (Xofluza)
Pre-expositieprofylaxe
Gezien de profylactische effectiviteit van oseltamivir kan profylaxe worden overwogen voor risicogroepen als aanvulling op vaccinatie:
- Als kortdurende profylaxe in combinatie met snelle toediening van het influenzavaccin tijdens een epidemie ter overbrugging van de periode (14 dagen) waarin het vaccin zijn beschermende effect moet opbouwen (Uyeki 2019).
- In de vorm van seizoensprofylaxe (preventie gedurende het influenzaseizoen):
- volwassenen en kinderen met een zeer hoog risico op ernstig beloop van influenza waarbij vaccinatie gecontra-indiceerd is of beperkt effectief (bijv. ernstig immuungecompromitteerden waaronder patiënten na longtransplantatie of kort na stamceltransplantatie) (Uyeki 2019);
- bij een dreigende epidemie (zeer hoge influenza-incidentie in de algemene populatie) voor kwetsbare bewoners in verpleeghuizen (ECDC 2017);
- in uitzonderlijke omstandigheden kan seizoensprofylaxe overwogen worden tijdens een algemene verspreiding van influenza A en B in de bevolking, bijvoorbeeld in geval van een groot antigeenverschil tussen de circulerende stammen en de stam van het vaccin (ECDC 2017).
Het middel van eerste keus als preventie tijdens een epidemie is oseltamivir gedurende een periode tot 6 weken. Bij immuungecompromitteerde patiënten is een duur tot 12 weken onderzocht en de veiligheid consistent bevonden.
Postexpositieprofylaxe
Postexpositieprofylaxe (PEP) middels oseltamivir kan overwogen worden bij een persoon met een zeer hoog risico op een ernstig beloop van influenza, ongeacht vaccinatiestatus, na contact met een geïnfecteerd persoon (conform de NHG-richtlijn Influenza). Bijvoorbeeld bij een bewezen influenzavirusinfectie binnen het huishouden (of daarmee vergelijkbare contacten) van de patiënt.
Personen met een zeer hoog risico zijn (conform de NHG-richtlijn Influenza):
- patiënten met een onvoldoende functionerend afweersysteem;
- patiënten met ernstig lever- of nierfalen of ernstige cardiale of pulmonale aandoeningen;
- kwetsbare ouderen.
Neuramidaseremmers (oseltamivir en zanamivir)
Oseltamivir heeft als PEP (postexpositieprofylaxe) bij gezonde contactpersonen van patiënten met bewezen influenzavirusinfectie een hoge effectiviteit. Er zijn aanwijzingen dat oseltamivir tenminste nog effectief is, indien het ≤ 48 uur na blootstelling wordt gegeven (Beck 2013, Lee 2011, Welliver 2001). Zanamivir is geregistreerd voor een interval van ≤ 36 uur tussen blootstelling en start profylaxe. De werkzaamheid en effectiviteit van neuraminidaseremmers als PEP bij hoogrisicogroepen is weinig onderzocht (Jefferson 2014). Voor meer informatie, zie bijlage Influenza in instellingen voor langdurige verblijf.
Baloxavir
Baloxavir is, naast de behandeling van ongecompliceerde influenza, ook geregistreerd voor de profylaxe van influenza na blootstelling bij personen van 1 jaar en ouder. Het betreft een enkelvoudige dosis die zo snel mogelijk moet worden ingenomen binnen 48 uur na nauw contact met iemand van wie bekend is of vermoed wordt dat deze persoon influenza heeft. In een multicenter RCT uit Japan onder huisgenoten van geïnfecteerde indexpatiënten werd significant minder laboratorium bevestigde klinische influenza gezien in de baloxavirgroep ten opzichte van de placebogroep (1,9% versus 13,6%) (adjusted risk ratio, 0.14; 95% CI, 0.06-0.30; P < 0.001) (Ikematsu 2020). In Nederland is voor baloxavir tot heden geen advies vastgesteld over de plaats in de profylaxe van influenza (Farmacotherapeutisch Kompas, NHG-Influenza).
Uitbraakprofylaxe
Bij dreigende of bestaande uitbraken in instellingen voor langdurige zorg kan in sommige gevallen uitbraakprofylaxe overwogen worden voor een zorgeenheid. Hier zal een deel van de bewoners blootgesteld zijn en een deel (nog) niet. Voor het beleid voor instellingen met medische dienst, zie het opgestelde Addendum van Verenso en NVAVG en Uitbraakbeleid - Verenso. Voor het beleid voor instellingen zonder medische dienst (verblijf zonder behandeling), zie bijlage Influenza in instellingen voor langdurige verblijf.
Wering
Zie Algemene preventieve maatregelen. Wering van werknemers kan van toepassing zijn, zie onder Arbeidsrelevante aanvullingen.
Arbeidsrelevante aanvullingen
Deze aanvullingen zijn geschreven voor en door bedrijfsartsen en beschrijven de preventieve maatregelen om het oplopen van infectieziekten tijdens het werk te voorkomen (werknemer als risicoloper) en de maatregelen/aanpassingen die genomen kunnen worden bij vaststelling van de infectieziekte bij de werknemer (werknemer als risicovormer). In de werksituatie gelden de Arbowet, het Arbeidsomstandighedenbesluit (Arbobesluit) en de Europese Richtlijn 2000/54 gericht op preventie. Zie ook biologische agentia in de wet (Arboportaal.nl).
Ziekteverschijnselen in relatie tot arbeid
Vrijwel uitsluitend in de acute fase kunnen de klachten (zoals hoge koorts) zodanig zijn dat de werknemer niet kan werken of naar het werk kan komen. Na het verdwijnen van de klinische symptomen kan het werk over het algemeen geleidelijk worden opgepakt. Het kan echter nog enige tijd duren voordat iemand weer helemaal fit is. Daarbij kan gedacht worden aan cognitieve beperkingen (zoals geheugen en concentratie) en energetische beperkingen. In geval van co-morbiditeit, bijvoorbeeld bij hart- en longziekten, kan er sprake zijn van een langere herstelperiode en een hogere gevoeligheid voor complicaties.
Arbeidsgerelateerde risicogroepen
Risicolopers zijn werknemers die bij het uitoefenen van hun beroep blootgesteld worden aan influenza. Volgens de Gezondheidsraad zijn dit de beroepen waarbij sprake is van:
- intensief en direct patiëntencontact zoals in huisartsenpartijken, verpleeg-, verzorgings- en ziekenhuizen;
- direct contact met (kleine) kinderen zoals bij kinderdagverblijven en scholen;
- (gericht en ongericht) werken met het virus zelf in laboratoria;
- omstandigheden waarbij (veel) mensen enige tijd dicht in elkaars nabijheid verblijven (zoals tandartsen, mondhygiënisten, fysiotherapeuten, baliemedewerkers, in het openbaar/personenvervoer, taxichauffeurs, militairen die verblijven in barakken, in opvang- en detentiecentra).
Daarnaast is er een verhoogde kans op blootstelling als de arbeidshygiënische strategie niet kan worden opgevolgd. Denk daarbij aan afstand houden, drukte verspreiden, goed ventileren en goede (hand)hygiëne en gebruik van persoonlijke beschermingsmiddelen in de patiëntenzorg (Gezondheidsraad 2023).
Risicovormers zijn werknemers die influenzavirus kunnen overdragen aan derden (waaronder medisch kwetsbaren) als zij werkzaamheden verrichten in de besmettelijke fase, zonder aanvullende maatregelen.
Preventieve maatregelen op het werk
Vaccinatie voor werknemers
De werknemer als risicovormer. De belangrijkste reden voor het aanbieden van de jaarlijkse influenzavaccinatie aan gezondheidswerkers is de bescherming van de bewoners en patiënten (i.e. medisch kwetsbare derden) van verpleeg-, verzorgings- en ziekenhuizen en in huisartspraktijken.
De werknemer als risicoloper. Door de verzorging en behandeling van (on)verdachte influenzapatiënten lopen gezondheidswerkers risico. Het is van belang dat zij de gebruikelijke hygiëneprotocollen naleven en krijgen daarnaast als preventieve maatregel influenzavaccinatie door de werkgever aangeboden.
Recentelijk heeft de Gezondheidsraad de influenzavaccinatie-indicatie voor werkenden uitgebreid (Gezondheidsraad 2023). Naast de gebruikelijke zorg- en laboratoriummedewerkers die gericht met het influenzavirus werken, hebben nu ook werknemers die werken in relatief kleine ruimten met suboptimale ventilatie en veelvuldig in nauw contact komen met derden een vaccinatie-indicatie.
In bijzondere gevallen wordt influenzavaccinatie geadviseerd om het ontstaan van een nieuw influenzavirus tegen te gaan. Dit geldt voor werknemers die een hoog risico lopen op blootstelling aan aviaire influenza of influenza van andere dierlijke oorsprong, zoals pluimveehouders, varkenshouders, dierenartsen en werknemers die betrokken zijn bij het (op)ruimen van met vogelgriep besmette dieren. Zie ook de betreffende factsheet Influenzavaccinatie.
Overige preventieve maatregelen op het werk
- De werkgever is verantwoordelijk voor het geven van (periodieke) voorlichting over arbeidsgerelateerde risicohandelingen, het gebruik en beschikbaar stellen van persoonlijke beschermingsmiddelen (PBM), het belang van hygiënische maatregelen en aanbieden van vaccinatie.
- Medewerkers die bezorgd zijn over hun gezondheid in relatie tot hun werk kunnen (anoniem) een afspraak maken op het arbeidsomstandighedenspreekuur van de bedrijfsarts.
- Ventilatie dient te worden aangepast aan het gebruik van een ruimte. Zie hiervoor de paragraaf 5.2 van de Algemene hygiënerichtlijn.
- Daarnaast wordt het toezien op het opvolgen van de algemene en instelling-specifieke hygiënevoorschriften geadviseerd.
Profylaxegebruik werknemers
Op grond van de huidige richtlijnen is er momenteel geen indicatie voor antivirale profylaxe voor influenza. Alleen in uitzonderlijke situaties kan in een zorginstelling worden overgegaan tot profylactische antivirale behandeling (NVAB 2007) van werknemers op aangeven van een infectiecommissie. De bedrijfsarts is bij voorkeur betrokken bij de indicatiestelling en het vervolg.
Wering van werk
De werknemer als risicovormer: gezondheidswerkers met griep(achtige) symptomen kunnen in de besmettelijke periode patiënten en/of collega's besmetten. In deze periode is het naleven van goede hand- en hoesthygiëne extra van belang. De werknemer met influenza-achtige klachten overlegt met de leidinggevende of het verantwoord is om het werk voort te zetten en of aanvullende maatregelen nodig zijn om besmetting naar patiënten/collega's te voorkomen (NVAB 2007). De bedrijfsarts kan hierin om advies worden gevraagd. Het bovenstaande geldt ook voor het moment van de werkhervatting.
Bij klinisch herstel kan het werk worden hervat. Bij een ongecompliceerde influenzavirusinfectie neemt de kans op besmetting van collega's en cliënten 5 dagen na het begin van de klachten sterk af.
Bij terugkeer naar werk of school dient er rekening mee gehouden te worden dat de luchtwegen nog gevoeliger dan normaal zijn voor secundaire infecties en luchtwegprikkelende middelen (dampen, schimmels of biologische agentia).
Melden als beroepsziekte
Indien de ziekte (waarschijnlijk) is opgelopen tijdens de beroepsuitoefening moet de casus door een geregistreerde bedrijfsarts worden gemeld bij het Nederlands Centrum voor Beroepsziekten.
Literatuur
- Azziz Baumgartner E, Dao CN, Nasreen S, Bhuiyan MU, Mah EMS, Al Mamun A, et al. Seasonality, timing, and climate drivers of influenza activity worldwide. J Infect Dis. 2012;206(6):838-46. https://doi.org/10.1093/infdis/jis467.
- Baccam P, Beauchemin C, Macken CA, Hayden FG, Perelson AS. Kinetics of influenza A virus infection in humans. J Virol. 2006;80(15):7590-9. https://doi.org/10.1128/jvi.01623-05.
- Bai L, Zhao Y, Dong J, Liang S, Guo M, Liu X, et al. Coinfection with influenza A virus enhances SARS-CoV-2 infectivity. Cell Res. 2021;31(4):395-403. https://doi.org/10.1038/s41422-021-00473-1.
- Beck CR, Sokal R, Arunachalam N, Puleston R, Cichowska A, Kessel A, et al. Neuraminidase inhibitors for influenza: a review and public health perspective in the aftermath of the 2009 pandemic. Influenza Other Respir Viruses. 2013;7 Suppl 1(Suppl 1):14-24. https://doi.org/10.1111/irv.12048.
- Bennett JE DR, Blaser MJ. Douglas, and Bennett’s principles and practices of infectious diseases. Philadelphia: Elsevier; 2015.
- Brundage JF. Interactions between influenza and bacterial respiratory pathogens: implications for pandemic preparedness. Lancet Infect Dis. 2006;6(5):303-12. https://doi.org/10.1016/s1473-3099(06)70466-2.
- Carrat F, Vergu E, Ferguson NM, Lemaitre M, Cauchemez S, Leach S, Valleron AJ. Time lines of infection and disease in human influenza: a review of volunteer challenge studies. Am J Epidemiol. 2008;167(7):775-85. https://doi.org/10.1093/aje/kwm375.
- CDC. Key Facts About Influenza (Flu) 2022 2022. Beschikbaar via: https://www.cdc.gov/flu/about/keyfacts.htm#onset. Geraadpleegd op 10 augustus 2023.
- Commissie E. Beschikking van de Commissie van 28 april 2008 tot wijziging van Beschikking 2002/253/EG tot vaststelling van gevalsdefinities voor het melden van overdraagbare ziekten aan het communautaire netwerk krachtens Beschikking nr. 2119/98/EG van het Europees Parlement en de Raad. Publicatieblad van de Europese Unie 2008. Was beschikbaar via: http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:159:004….
- Cox NJ, Subbarao K. Global epidemiology of influenza: past and present. Annu Rev Med. 2000;51:407 21. https://doi.org/10.1146/annurev.med.51.1.407.
- Cox RJ, Brokstad KA, Ogra P. Influenza virus: immunity and vaccination strategies. Comparison of the immune response to inactivated and live, attenuated influenza vaccines. Scand J Immunol. 2004;59(1):1-15. https://doi.org/10.1111/j.0300-9475.2004.01382.x.
- Donker G GJ. De beste tijd voor griepvaccinatie. Huisarts & Wetenschap. 2007;50:40-1.
- Eccles R. Understanding the symptoms of the common cold and influenza. Lancet Infect Dis. 2005;5(11):718-25. https://doi.org/10.1016/s1473-3099(05)70270-x.
- ECDC (European Centre for Disease Prevention and Control). Expert opinion on neuraminidase inhibitors for the prevention and treatment of influenza 2017. Beschikbaar via: https://www.ecdc.europa.eu/sites/default/files/documents/Scientific-advice-neuraminidase-inhibitors-2017.pdf. Geraadpleegd op 10 augustus 2023.
- Fell DB, Johnson J, Mor Z, Katz MA, Skidmore B, Neuzil KM, et al. Incidence of laboratory-confirmed influenza disease among infants under 6 months of age: a systematic review. BMJ Open. 2017;7(9):e016526. https://doi.org/10.1136/bmjopen-2017-016526.
- Fiore AE, Shay DK, Broder K, Iskander JK, Uyeki TM, Mootrey G, et al. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2008. MMWR Recomm Rep. 2008;57(Rr-7):1-60.
- Fouchier RA, Schneeberger PM, Rozendaal FW, Broekman JM, Kemink SA, Munster V, et al. Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome. Proc Natl Acad Sci U S A. 2004;101(5):1356-61. https://doi.org/10.1073/pnas.0308352100.
- Furuya-Kanamori L, Cox M, Milinovich GJ, Magalhaes RJ, Mackay IM, Yakob L. Heterogeneous and Dynamic Prevalence of Asymptomatic Influenza Virus Infections. Emerg Infect Dis. 2016;22(6):1052-6. https://doi.org/10.3201/eid2206.151080.
- Gezondheidsraad. Griepvaccinatie: herziening van de indicatiestelling. Advies 08-03-2007. 2007. Beschikbaar via: https://www.gezondheidsraad.nl/documenten/adviezen/2007/03/08/griepvaccinatie-herziening-van-de-indicatiestelling.
- Gezondheidsraad. Griepvaccinatie: herziening van de indicatiestelling 2021. Advies 20-09-2021. 2021.
- Gezondheidsraad. Advies Vaccinatie van werknemers: griep 2023. Beschikbaar via: https://www.gezondheidsraad.nl/onderwerpen/vaccinaties/alle-adviezen-over-vaccinaties/vaccinatie-van-werknemers-tegen-griep.
- Gounder AP, Boon ACM. Influenza Pathogenesis: The Effect of Host Factors on Severity of Disease. J Immunol. 2019;202(2):341-50. https://doi.org/10.4049/jimmunol.1801010.
- Grayson ML, Melvani S, Druce J, Barr IG, Ballard SA, Johnson PD et al. Efficacy of soap and water and alcohol-based hand-rub preparations against live H1N1 influenza virus on the hands of human volunteers. Clin Infect Dis. 2009;48(3):285-91. https://doi.org/10.1086/595845.
- Huang X, Mengersen K, Milinovich G, Hu W. Effect of Weather Variability on Seasonal Influenza Among Different Age Groups in Queensland, Australia: A Bayesian Spatiotemporal Analysis. J Infect Dis. 2017;215(11):1695-701. https://doi.org/10.1093/infdis/jix181.
- Ikematsu H, Hayden FG, Kawaguchi K, Kinoshita M, de Jong MD, Lee N, et al. Baloxavir Marboxil for Prophylaxis against Influenza in Household Contacts. N Engl J Med. 2020;383(4):309-20. https://doi.org/10.1056/NEJMoa1915341.
- Ip DKM, Lau LLH, Chan KH, Fang VJ, Leung GM, Peiris MJS, Cowling BJ. The Dynamic Relationship Between Clinical Symptomatology and Viral Shedding in Naturally Acquired Seasonal and Pandemic Influenza Virus Infections. Clin Infect Dis. 2016;62(4):431-7. https://doi.org/10.1093/cid/civ909.
- Jamieson DJ, Theiler RN, Rasmussen SA. Emerging infections and pregnancy. Emerg Infect Dis. 2006;12(11):1638-43. https://doi.org/10.3201/eid1211.060152.
- Jefferson T, Dooley L, Ferroni E, Al-Ansary LA, van Driel ML, Bawazeer GA, et al. Physical interventions to interrupt or reduce the spread of respiratory viruses. Cochrane Database Syst Rev. 2023;1(1):Cd006207. https://doi.org/10.1002/14651858.CD006207.pub6.
- Jefferson T, Jones MA, Doshi P, Del Mar CB, Hama R, Thompson MJ, et al. Neuraminidase inhibitors for preventing and treating influenza in adults and children. Cochrane Database Syst Rev. 2014;2014(4):Cd008965. https://doi.org/10.1002/14651858.CD008965.pub4.
- Killingley B, Nguyen-Van-Tam J. Routes of influenza transmission. Influenza Other Respir Viruses. 2013;7 Suppl 2(Suppl 2):42-51. https://doi.org/10.1111/irv.12080.
- Koopmans M, Wilbrink B, Conyn M, Natrop G, van der Nat H, Vennema H, et al. Transmission of H7N7 avian influenza A virus to human beings during a large outbreak in commercial poultry farms in the Netherlands. Lancet. 2004;363(9409):587-93. https://doi.org/10.1016/s0140-6736(04)15589-x.
- Koopmans MP, Meijer A, van der Lubben MI, Boucher C, Fouchier RA, Osterhaus AD, et al. [Combating the new influenza A (H1N1) virus. I. Overview of the relevant virological aspects]. Ned Tijdschr Geneeskd. 2009;153:A770. (Bestrijding van de nieuwe influenza A (H1N1). I. Overzicht van de relevante virologische aspecten).
- Kuiken T, Taubenberger JK. Pathology of human influenza revisited. Vaccine. 2008;26 Suppl 4(Suppl 4):D59-66. https://doi.org/10.1016/j.vaccine.2008.07.025.
- Kutter JS, Spronken MI, Fraaij PL, Fouchier RA, Herfst S. Transmission routes of respiratory viruses among humans. Curr Opin Virol. 2018;28:142-51. https://doi.org/10.1016/j.coviro.2018.01.001.
- Kwong JC, Schwartz KL, Campitelli MA, Chung H, Crowcroft NS, Karnauchow T, et al. Acute Myocardial Infarction after Laboratory-Confirmed Influenza Infection. N Engl J Med. 2018;378(4):345-53. https://doi.org/10.1056/NEJMoa1702090.
- Lee VJ, Yap J, Maurer-Stroh S, Lee RT, Eisenhaber F, Tay JK, et al. Investigation of causes of oseltamivir chemoprophylaxis failures during influenza A (H1N1-2009) outbreaks. J Clin Virol. 2011;50(2):104-8. https://doi.org/10.1016/j.jcv.2010.10.004.
- Leekha S, Zitterkopf NL, Espy MJ, Smith TF, Thompson RL, Sampathkumar P. Duration of influenza A virus shedding in hospitalized patients and implications for infection control. Infect Control Hosp Epidemiol. 2007;28(9):1071-6. https://doi.org/10.1086/520101.
- Leung NH, Xu C, Ip DK, Cowling BJ. Review Article: The Fraction of Influenza Virus Infections That Are Asymptomatic: A Systematic Review and Meta-analysis. Epidemiology. 2015;26(6):862-72. https://doi.org/10.1097/ede.0000000000000340.
- Liao CM, Yang SC, Chio CP, Chen SC. Understanding influenza virus-specific epidemiological properties by analysis of experimental human infections. Epidemiol Infect. 2010;138(6):825-35. https://doi.org/10.1017/s0950268809991178.
- Lin YP, Gregory V, Bennett M, Hay A. Recent changes among human influenza viruses. Virus Res. 2004;103(1-2):47-52. https://doi.org/10.1016/j.virusres.2004.02.011.
- Lowen AC, Mubareka S, Steel J, Palese P. Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathog. 2007;3(10):1470-6. https://doi.org/10.1371/journal.ppat.0030151.
- Lowen AC, Steel J, Mubareka S, Palese P. High temperature (30 degrees C) blocks aerosol but not contact transmission of influenza virus. J Virol. 2008;82(11):5650-2. https://doi.org/10.1128/jvi.00325-08.
- Mazagatos C, Delgado-Sanz C, Oliva J, Gherasim A, Larrauri A. Exploring the risk of severe outcomes and the role of seasonal influenza vaccination in pregnant women hospitalized with confirmed influenza, Spain, 2010/11-2015/16. PLoS One. 2018;13(8):e0200934. https://doi.org/10.1371/journal.pone.0200934.
- McDonald SA, Teirlinck AC, Hooiveld M, van Asten L, Meijer A, de Lange M, et al. Inference of age-dependent case-fatality ratios for seasonal influenza virus subtypes A(H3N2) and A(H1N1)pdm09 and B lineages using data from the Netherlands. Influenza Other Respir Viruses. 2023;17(6):e13146. https://doi.org/10.1111/irv.13146.
- Mertz D, Geraci J, Winkup J, Gessner BD, Ortiz JR, Loeb M. Pregnancy as a risk factor for severe outcomes from influenza virus infection: A systematic review and meta-analysis of observational studies. Vaccine. 2017;35(4):521-8. https://doi.org/10.1016/j.vaccine.2016.12.012.
- Monto AS, Gravenstein S, Elliott M, Colopy M, Schweinle J. Clinical signs and symptoms predicting influenza infection. Arch Intern Med. 2000;160(21):3243-7. https://doi.org/10.1001/archinte.160.21.3243.
- NHG. NHG-standaard Influenza. Maart 2022. Beschikbaar via: Influenza | NHG-Richtlijnen. Laatst herzien op januari 2024.
- NHG/SNPG. Griepvaccinatie. 2016. Beschikbaar via: https://www.snpg.nl/wp-content/uploads/NHG_SNPG-Handleiding_Griepvaccinatie_2016_voor_web-kopie.pdf.
- Nicholson KG, Wood JM, Zambon M. Influenza. Lancet. 2003;362(9397):1733-45. https://doi.org/10.1016/s0140-6736(03)14854-4.
- NVAB. Richtlijn Influenza: preventie en outbreak control. 2007. Beschikbaar via: https://nvab-online.nl/richtlijnen-richtlijnen-NVAB/richtlijn-influenza-preventie-en-outbreak-control.
- Ong AK, Chen MI, Lin L, Tan AS, Nwe NW, Barkham T, et al. Improving the clinical diagnosis of influenza--a comparative analysis of new influenza A (H1N1) cases. PLoS One. 2009;4(12):e8453. https://doi.org/10.1371/journal.pone.0008453.
- Paget John, Caini Saverio, Del Riccio Marco, van Waarden Willemijn, Meijer Adam. Has influenza B/Yamagata become extinct and what implications might this have for quadrivalent influenza vaccines?. Euro Surveill. 2022;27(39):pii=2200753. https://doi.org/10.2807/1560-7917.ES.2022.27.39.2200753.
- Puck JM, Glezen WP, Frank AL, Six HR. Protection of infants from infection with influenza A virus by transplacentally acquired antibody. J Infect Dis. 1980;142(6):844-9. https://doi.org/10.1093/infdis/142.6.844.
- Puig-Barberà J, Natividad-Sancho A, Trushakova S, Sominina A, Pisareva M, Ciblak MA, et al. Epidemiology of Hospital Admissions with Influenza during the 2013/2014 Northern Hemisphere Influenza Season: Results from the Global Influenza Hospital Surveillance Network. PLoS One. 2016;11(5):e0154970. https://doi.org/10.1371/journal.pone.0154970.
- Reuman PD, Ayoub EM, Small PA. Effect of passive maternal antibody on influenza illness in children: a prospective study of influenza A in mother-infant pairs. Pediatr Infect Dis J. 1987;6(4):398-403. https://doi.org/10.1097/00006454-198704000-00011.
- RIVM (Rijksinstituut voor Volksgezondheid en Milieu). Influenza vaccination in the Netherlands: Background information for the Health Council of the Netherlands. 2019. Beschikbaar via: https://rivm.openrepository.com/handle/10029/623130.
- RIVM. Surveillance of acute respiratory infections in the Netherlands: winter 2022/2023. SARS-CoV-2, influenza virus, RSV and other respiratory viruses. 2023. Beschikbaar via: Surveillance of acute respiratory infections in the Netherlands: winter 2022/2023.
- RIVM. Medical microbiology laboratories in the Netherlands can detect animal type A influenza viruses well. External Quality Assessment 2023. DOI: 10.21945/RIVM-2023-039.
- Shaman J, Kohn M. Absolute humidity modulates influenza survival, transmission, and seasonality. Proc Natl Acad Sci U S A. 2009;106(9):3243-8. https://doi.org/10.1073/pnas.0806852106.
- SWAB. Advies diagnostiek en profylaxe ter voorkoming van invasieve aspergillose bij volwassenen patiënten met influenza, opgenomen op een intensive care afdeling (herziene advies) 2023. Beschikbaar via: https://swab.nl/nl/article/nieuws/604/advies-diagnostiek-en-profylaxe-ter-voorkoming-van-invasieve-aspergillose-bij-volwassen-pati%C3%ABnten-met-influenza-opgenomen-op-een-intensive-care-afdeling-herziene-advies. Geraadpleegd op 10 augustus 2023.
- Swets MC, Russell CD, Harrison EM, Docherty AB, Lone N, Girvan M, et al. SARS-CoV-2 co-infection with influenza viruses, respiratory syncytial virus, or adenoviruses. Lancet. 2022;399(10334):1463-4. https://doi.org/10.1016/s0140-6736(22)00383-x.
- Tamerius J, Nelson MI, Zhou SZ, Viboud C, Miller MA, Alonso WJ. Global influenza seasonality: reconciling patterns across temperate and tropical regions. Environ Health Perspect. 2011;119(4):439-45. https://doi.org/10.1289/ehp.1002383.
- Tamura S, Kurata T. Defense mechanisms against influenza virus infection in the respiratory tract mucosa. Jpn J Infect Dis. 2004;57(6):236-47.
- Tellier R. Review of aerosol transmission of influenza A virus. Emerg Infect Dis. 2006;12(11):1657-62. https://doi.org/10.3201/eid1211.060426.
- Tellier R. Aerosol transmission of influenza A virus: a review of new studies. J R Soc Interface. 2009;6 Suppl 6(Suppl 6):S783-90. https://doi.org/10.1098/rsif.2009.0302.
- Treanor. Influenza Viruses, Including Avian Influenza and Swine Influenza. Mandell, Douglas, and Bennett's principles and practice of infectious diseases. Philadelphia: Elsevier Saunders; 2021. p. 2143-68.
- Uyeki TM, Bernstein HH, Bradley JS, Englund JA, File TM, Fry AM, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America: 2018 Update on Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management of Seasonal Influenza. Clin Infect Dis. 2019;68(6):895-902. https://doi.org/10.1093/cid/ciy874.
- Van Essen GA, Bueving HJ, Voordouw ACG, Berg HF, Van der Laan JR, Van Lidth de Jeude CP, et al. NHG-Standaard Influenza en influenzavaccinatie. In: Wiersma T, Boukes FS, Geijer RMM, Goudswaard AN, editors. NHG-Standaarden 2009. Houten: Bohn Stafleu van Loghum; 2009. p. 1314-32.
- Vanderbeke L, Janssen NAF, Bergmans D, Bourgeois M, Buil JB, Debaveye Y, et al. Posaconazole for prevention of invasive pulmonary aspergillosis in critically ill influenza patients (POSA-FLU): a randomised, open-label, proof-of-concept trial. Intensive Care Med. 2021;47(6):674-86. https://doi.org/10.1007/s00134-021-06431-0.
- Weber TP, Stilianakis NI. Inactivation of influenza A viruses in the environment and modes of transmission: a critical review. J Infect. 2008;57(5):361-73. https://doi.org/10.1016/j.jinf.2008.08.013.
- Welliver R, Monto AS, Carewicz O, Schatteman E, Hassman M, Hedrick J, et al. Effectiveness of oseltamivir in preventing influenza in household contacts: a randomized controlled trial. Jama. 2001;285(6):748-54. https://doi.org/10.1001/jama.285.6.748.
- WHO (World Health Organization). Influenza (Seasonal) 2023 2023. Beschikbaar via: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal)). Geraadpleegd op 10 augustus 2023.
- WHO. Influenza (Seasonal) 2024 2024. Beschikbaar via: https://cdn.who.int/media/docs/default-source/influenza/who-influenza-recommendations/vcm-southern-hemisphere-recommendation-2024/202309_recommendation.pdf?sfvrsn=2c2cbebd_8&download=true.
- Zaman K, Roy E, Arifeen SE, Rahman M, Raqib R, Wilson E, et al. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med. 2008;359(15):1555-64. https://doi.org/10.1056/NEJMoa0708630.