Samenvatting
Verwekker: Neisseria gonorrhoeae (gramnegatieve bacterie)
Incubatieperiode: 2 dagen-3 weken, gemiddeld 5 dagen
Transmissieroute: Horizontaal (seksueel) of verticaal (moeder op kind)
Infectieuze periode: Onduidelijk, tijdens de incubatietijd tot aan 24 uur na start behandeling
Maatregelen: Partnernotificatie en contactonderzoek
Symptomen: Ziektebeeld afhankelijk van de locatie. Urogenitale en anogenitale infecties, faryngitis, neonatale infecties
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI-SG (Landelijk Overleg Infectieziektebestrijding-Seksuele Gezondheid): 25 juni 2024.
Wijzigingen:
- 19 januari 2026: Het 4CMenB-vaccin kan via 'vaccineren op eigen verzoek' worden gegeven. De paragraaf Immunisatie is hierop aangepast. Het LOI-SG heeft de gewijzigde paragraaf op 13 januari 2026 vastgesteld.
- 18 maart 2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en waar van toepassing arbeidsrelevante aanvullingen en veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen.
- 29 juli 2024: Herziene richtlijn gepubliceerd (op 25 juni 2024 vastgesteld door het LOI-SG). Nieuw en anders ten opzichte van de oude richtlijn: De richtlijn is aangepast naar aanleiding van de in 2024 herziene Multidisciplinaire richtlijn Seksueel overdraagbare aandoeningen (MDR Soa's). De termijnen voor partnernotificatie en test-of-cure zijn geüpdatet. De mogelijkheid van een urethra-uitstrijk voor diagnostiek is verwijderd. Bijlage 1 (onderbouwing vorige versie) is gearchiveerd. Indien Ct nog niet is uitgesloten wordt er niet meer geadviseerd standaard azitromycine bij te geven. Er is een paragraaf over doxy-PEP toegevoegd.
Achtergronden
Verwekker
De bacterie Neisseria gonorrhoeae (Ng) is een gramnegatieve, niet-beweeglijke en niet-sporenvormende diplokok met als enige reservoir de mens.
Epidemiologie
Verspreiding in de wereld
Van de geschatte 220 miljoen incidente bacteriële seksueel overdraagbare infecties in 2016 betroffen 87 miljoen gevallen gonorroe (Rowley 2019). In 2018 werden in Europa 100.673 infecties gerapporteerd aan ECDC (European Centre for Disease Prevention and Control). Gonorroe werd in Europa drie keer zo vaak bij mannen gediagnosticeerd. Bijna de helft van alle Europese infecties werd bij MSM (mannen die seks hebben met mannen) gevonden (ECDC 2020).
Europese data over 2019 van Euro-GASP lieten zien dat 0,9% van isolaten resistent waren tegen cefixim (MIC > 0,125 mg/L); in de vijf voorgaande jaren was dat stabiel tussen 1,4% en 2,1% geweest van 2014 tot 2018 met een stabiel aantal landen dat ten minste één resistente stam rapporteerde (n=14). Resistentie tegen ceftriaxon blijft in Europa vooralsnog uiterst zeldzaam. Het aantal ceftriaxonresistente isolaten in Europa was 3 in 2019, op een getest aantal van bijna 4.200 monsters (ECDC 2021).
Resistentie tegen ceftriaxon is in het buitenland, ook in Europa, sporadisch vastgesteld (Pinto 2020, Public Health England 2022, Pleininger 2022, Unemo 2021), maar in Nederland nog niet (De Greeff 2022, Van Wees 2022). In China komt resistentie tegen ceftriaxon inmiddels frequent voor (Yan 2021). In een single study werd 30% resistentie gezien. Er bestaat een reëel risico dat in de toekomst ook ceftriaxon niet meer als eerste keus kan worden ingezet. In China worden met hoge doseringen ceftriaxon overigens nog wel goede therapeutische resultaten gezien (Han 2020).
Voorkomen in Nederland
Naast de bijna 8000 gonorroe-infecties die jaarlijks bij de CSG (Centrum Seksuele Gezondheid)’s worden opgespoord, worden elk jaar naar schatting ook nog eens 14.300 gonorroe-infecties door huisartsen gevonden (Van Wees 2022). Het aantal nieuwe gevallen van gonorroe in Nederland stijgt al meer dan tien jaar. Het aantal diagnoses is sinds 2019 ook toegenomen doordat mensen die hiv-PrEP gebruiken viermaal per jaar worden getest voor bacteriële soa’s; er worden dan ook vaker soa’s, waaronder gonorroe, gevonden.
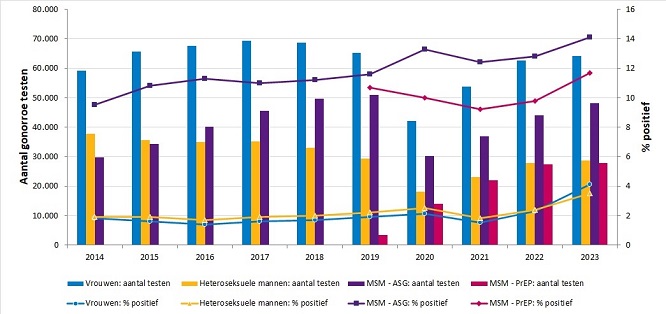
Figuur: Voorkomen gonorroe in Nederland. Het aantal testen (staafdiagrammen) en percentage positieve testen (punten) voor gonorroe in verschillende sleutelpopulaties die de CSG’s bezochten, periode 2014-2023. Bron: RIVM (Rijksinstituut voor Volksgezondheid en Milieu) 2024
In Nederland wordt gonorroe vaker bij mannen dan bij vrouwen vastgesteld. De verhouding man-vrouw is ongeveer 9:1, vooral door de hoge frequentie onder MSM. In 2021 werd 58% van de in totaal 7.842 diagnoses in de CSG bij consulten met MSM in de ASG (aanvullende seksuele gezondheidszorg)-regeling, 26% bij consulten met MSM in de Nationale PrEP (pre-expositieprofylaxe)-pilot, 5% bij heteroseksuele mannen, en 11% bij vrouwen (Van Wees 2022). Bij MSM steeg zowel het absolute aantal opgespoorde gevallen van gonorroe als het percentage positieve testen in de periode 2008-2021. Deze toename was het sterkst bij vrouwen (van 831 naar 1.458; + 75%) en heteroseksuele mannen (van 421 naar 666; + 58%), met name in de tweede helft van 2022 (RIVM, april 2023).
Voor actuele informatie over het voorkomen van gonorroe-infecties in Nederland, zie: Gonorroe (rivm.nl).
Resistentieontwikkeling in Nederland
Tot nu toe wist Ng na kortere of langere tijd resistentie te ontwikkelen tegen alle gebruikte antibiotica (Koedijk 2010, Peerbooms 2001, Van Dam 2014). Daarom is het zeer wel mogelijk dat het slechts een kwestie van tijd is er ook resistentie tegen het enige nog empirisch effectief te gebruiken middel (ceftriaxon) ontstaat (Unemo 2019).
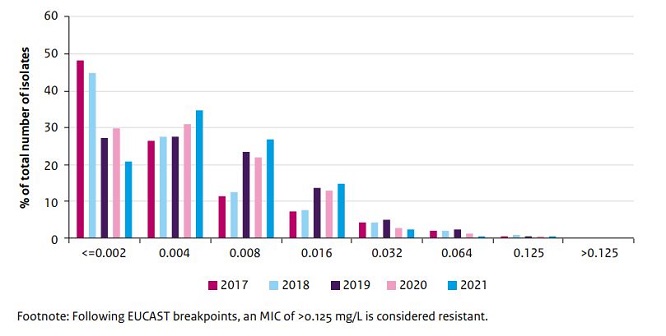
In Nederland bestaat een continue landelijke resistentiesurveillance onder het acroniem GRAS (gonokokkenresistentie tegen antibioticasurveillance) (Visser 2022). Ruim 80% van de soa-centra participeerde in 2015 in GRAS. Ongeveer twee derde van de CSG’s, bij elkaar goed voor > 80% van de gonorroediagnosen bij CSG’s, participeerde in 2021 in GRAS. Het aantal infecties waarbij een resistentiepatroon was bepaald is al jaren stabiel op 40% van alle gediagnosticeerde gonorroe (Van Wees 2022). In Nederland is nog geen resistentie tegen ceftriaxon vastgesteld, maar wel neemt de gemiddelde MIC (minimum inhibitory concentration) gestaag toe (zie figuur). Therapiefalen na gebruik van ceftriaxon is in Nederland nog niet gerapporteerd, maar wel elders in Europa (Pinto 2020, Public Health England 2022, Pleininger 2022, Unemo 2021, ECDC 2020, ECDC 2021).
Figuur: MIC (= minimum inhibitory concentration)-distributie voor ceftriaxon in Nederland, 2017-2021. Bron: Van Wees 2022
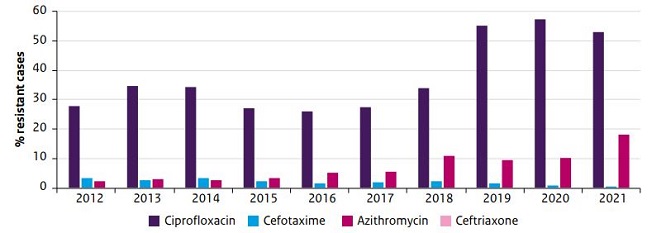
De resistentie tegen ciprofloxacine is de laatste jaren weer toegenomen, tot 53% in 2021. Resistentie tegen azitromycine is de laatste jaren gestaag gestegen, tot 18% in 2021 (zie figuur) (De Greeff 2022).
Figuur: Gonokokkenresistentie (volgens EUCAST breakpoints) in Nederland; proportie van resistente gevallen, 2012-2021. Bron: Van Wees 2022
Omdat het afkappunt voor azitromycine waarop een stam als gevoelig of resistent wordt beoordeeld zoals vastgesteld door het European Committee on Antimicrobial Susceptibility Testing (EUCAST) binnen de verdeling van de MIC’s van natuurlijk voorkomende stammen ligt, kunnen aanzienlijke schommelingen in resistentie optreden tussen verschillende jaren en zijn resultaten van verschillende laboratoria ook niet goed vergelijkbaar. Er zijn relatief veel stammen met een MIC rond het afkappunt. De continue toename van de MIC over de tijd ondersteunt echter de observatie dat gonorroe in Nederland in toenemende mate verminderd gevoelig dan wel resistent is voor azitromycine (Hofstraat 2016, De Greeff 2022), waarmee het inzetten van azitromycine als reservemiddel niet opportuun is.
Zolang er geen alternatief middel beschikbaar is, is vroegopsporing van eventuele verminderd gevoelige en resistente stammen essentieel om verspreiding te voorkomen en tijd te winnen. Het is van belang dat de winst in de bestrijding van gonorroe die behaald is door de snelle en sensitieve NAAT (nucleïnezuur amplificatietest (zoals PCR))-diagnostiek, niet verloren gaat door het niet meer beschikbaar zijn van kweken voor gevoeligheidsbepalingen, waardoor resistentie pas na verspreiding zal blijken. Gevoeligheidsbepalingen o.b.v. kweek zijn essentieel om te bepalen of huidige behandelrichtlijnen nog voldoen of moeten worden bijgesteld.
Voor meer informatie over de resistentieontwikkeling in Nederland, zie Gonorroe en antibioticaresistentie (rivm.nl).
Pathogenese
Gonokokken invaderen epitheelcellen van slijmvliezen waarmee ze in contact komen. De pili van de gonokok bewerkstelligen aanhechting aan slijmvliezen van de tractus urogenitalis (vaak urethra- of cervixslijmvlies) gevolgd door opname van gonokokken in epitheelcellen.
Gonokokken vermenigvuldigen zich vervolgens intracellulair. Na 2 à 3 dagen komen de bacteriën vrij in de submucosale weefsels. Op de plaats van de infectie verzamelen zich polymorfonucleaire granulocyten. Dit kan leiden tot kleine abcessen in de submucosa, met exsudaat en pusvorming. In sommige gevallen kan de bacterie zich direct of via de bloedbaan verplaatsen naar andere delen van het lichaam en aldus complicaties veroorzaken.
Incubatieperiode
Meestal 2 dagen tot 3 weken (gemiddeld 5 dagen) (Korenromp 2002). Na transmissie ontstaan bij mannen klinische symptomen van urogenitale gonorroe, bij 95% binnen 21 dagen. De langst beschreven incubatietijd bedroeg 57 dagen (Sherrard 1996). Bij vrouwen bestaan hier geen gegevens over; wel is beschreven dat geïnfecteerde vrouwen 180 dagen na een contact met verhoogde kans op Ng asymptomatisch bleven (Nielsen 1975). Bij 30-60% van vrouwen met urogenitale gonorroe en bij de meerderheid van orofaryngeale en rectale gonorroe (70-90%) blijft de infectie asymptomatisch (Morris 2006).
Ziekteverschijnselen
Bij de vrouw
Bij een groot deel van de vrouwen met urogenitale gonorroe treden nauwelijks of geen klachten op.
Als er bij de vrouw klachten optreden, gaat het meestal om een toegenomen hoeveelheid vaginale afscheiding. Andere verschijnselen zijn tussentijds bloedverlies, pijn en branderigheid bij het plassen (dysurie). Complicaties bij de vrouw zijn bartholinitis en pelvic inflammatory disease (PID).
PID is de meest voorkomende complicatie van onbehandelde urogenitale gonorroe. PID is een ontsteking in het kleine bekken ten gevolge van verspreiding van micro-organismen, doorgaans vanuit de vagina en de cervix naar het endometrium, de tubae en aangrenzende structuren. Vrouwen met PID kunnen klachten hebben van pijn in de onderbuik, abnormale vaginale afscheiding, koorts en onregelmatige menstruaties. PID bij gonorroe kan ook symptoomloos verlopen en in een aantal gevallen op langere termijn leiden tot complicaties als verminderde vruchtbaarheid en EUG’s.
Minder dan de helft van de gevallen van PID wordt veroorzaakt door Chlamydia trachomatis (Ct) of Ng (Mitchell 2021). Schattingen van het aandeel veroorzaakt door Ng variëren tussen studies en hangen o.a. af van de gebruikte definitie van PID. Bij een klinische definitie en aangetoonde endometritis ligt het percentage van PID waarbij Ng in de hogere genitale tractus wordt aangetroffen tussen de 9 en 25%.
Bij de man
Bij de man staan urethritisklachten op de voorgrond. Urethritisklachten ontstaan meestal binnen enkele dagen na de blootstelling. De klachten bestaan uit een branderig gevoel, pijn bij het plassen en een veelal pussende afscheiding, die gering maar ook heel hevig kan zijn ('druiper'). Complicaties bij de man zijn epididymitis, prostatitis en (bij chronische urethrale infectie) urethrale stricturen. Bij de man verloopt circa 10% van de urogenitale infecties asymptomatisch (Jungmann 2004, Kent 2005).
Bij man en vrouw
Anale infecties kunnen zowel bij mannen als bij vrouwen voorkomen. Symptomen van anale infectie kunnen zijn irritatie, jeuk en soms slijmerige afscheiding. In geval van anorectale gonorroe bij vrouwen is er meestal ook sprake van cervicale gonorroe. De meeste (tot 85%) anorectale gonorroe is asymptomatisch (Kent 2005).
Faryngeale infecties kunnen ook zowel bij mannen als vrouwen optreden. Bij infectie van de keel is meestal sprake van geen of weinig uitgesproken klachten (Morris 2006). Soms is er sprake van purulente faryngitis (Wiesner 1973).
Zowel bij de man als bij de vrouw komt het sporadisch voor dat gonokokken in de bloedbaan terecht komen (bacteriëmie) en een gegeneraliseerde infectie veroorzaken (Carlin 2021, Klausner 2022). De gonokokken kunnen dan op andere plaatsen in het lichaam terechtkomen en daar een infectie veroorzaken. Voorbeelden hiervan zijn een septische artritis, bijvoorbeeld in de knie, een zeer pijnlijke (meestal verspringende) polyartralgie in extremiteiten, sepsis, endocarditis en meningitis.
Een andere ernstige, maar zeldzame complicatie van gonorroe is perihepatitis (syndroom van Fitz-Hugh-Curtis), een ontsteking van het leverkapsel die voornamelijk bij vrouwen voorkomt. Deze complicatie gaat gepaard met pijn in de rechterbovenbuik, koorts en verhoogde leverenzymen in het bloed.
Bij neonaten
Bij neonaten kan een conjunctivitis ontstaan door infectie met gonokokken tijdens passage door het geboortekanaal. Deze ontstaat sneller dan een infectie met Chlamydia trachomatis, meestal drie dagen na de geboorte. Ook hier is onbehandeld het beeld snel progressief tot een keratitis met ulcus en corneaperforatie tot gevolg.
Gonokokkenconjunctivitis en gonokokkenkeratitis (volwassenen)
Ooginfecties zoals conjunctivitis en keratitis als gevolg van een Ng-infectie nemen zowel in Nederland als in de rest van de wereld toe. Het kan eenzijdige of bilaterale conjunctivitis, en in een deel van deze gevallen ook keratitis, veroorzaken. Dit is veelal een fulminant beeld en kan snel resulteren in cornea perforatie; Ng is een van de weinige bacteriën die het intacte epitheel van de cornea kan penetreren. Snelle diagnostiek en therapie zijn van uiterst belang: bij hoge klinische verdenking dient de cliënt met spoed (binnen één dag) naar de oogarts doorverwezen te worden.
Ooginfecties als gevolg van een Ng-infectie komt voor wanneer geïnfecteerd materiaal (o.a. sperma) direct op het gezicht komt, of na overdracht via de handen.
Er is weinig bekend over de antibioticagevoeligheidspatronen van de Ng-stammen die keratitis veroorzaken, hoewel dit van bijzonder belang is gezien de toenemende resistentie van deze organismen tegen de algemeen gebruikte antibiotica (Kate 2021).
Het natuurlijk beloop van gonorroe is doorgaans zelflimiterend: de urethritis bij mannen geneest doorgaans spontaan in enkele weken en asymptomatische infecties bij vrouwen worden ook spontaan geklaard. De voornaamste klinische redenen voor antibiotische behandeling zijn de klachten bij urethritis en bij proctitis en de mogelijke complicaties, met name PID, maar ook artritis. Daarnaast bestaat er een duidelijk belang voor de volksgezondheid om ook asymptomatische infecties te behandelen en zo transmissie te voorkomen.
Natuurlijke immuniteit
Een eerder doorgemaakte infectie met Ng resulteert niet in bescherming tegen herinfectie. Lokale antistoffen tegen Ng zijn wel gevonden in het slijmvliesepitheel, waardoor aanhechting van gonokokken mogelijk wordt verhinderd, maar de antistoffen verdwijnen zodra de infectie is verdwenen. Systemische antistoffen worden ook gevonden, maar deze blijken niet of slechts tijdelijk en partieel tegen herinfectie te beschermen. Infecties met gonokokken zijn doorgaans lokaal, maar sommige stammen kunnen een gegeneraliseerde infectie veroorzaken (Cartee 2022). Ook deze gegeneraliseerde infecties resulteren niet in blijvende bescherming en immuniteit.
Reservoir
De mens.
Transmissie
Transmissieroute
Seksueel contact (horizontale transmissie)
Transmissie vindt plaats via seksueel contact waarbij slijmvliezen met elkaar in aanraking komen. De belangrijkste verspreidingswegen zijn genitaal contact te weten contact tussen penis-vagina (genitogenitaal contact) en penis-anus (genitoanaal contact), en daarnaast orogenitaal (pijpen of beffen) of oroanaal contact (rimmen). De transmissie kan zowel via insertief als receptief contact plaatsvinden. Anale infectie met gonorroe kan ook ontstaan door geïnfecteerde genitale secreta en hoeft niet altijd door anale seks te worden veroorzaakt. Ook is de verspreiding via de handen (bij vingeren en aftrekken) mogelijk. Door overbrenging via de vingers of door sperma in het gelaat kan ook conjunctivitis ontstaan.
Australische onderzoekers hebben aannemelijk gemaakt dat transmissie van gonorroe via tongzoenen mogelijk is (Chow 2019, Tran 2022). Hoe vaak dat voorkomt en in welke mate deze transmissieroute bijdraagt aan de verspreiding van gonorroe is onduidelijk.
Ng infecteert in de meeste gevallen eerst het epitheel van de tractus urogenitalis. Primaire infectie van het rectum en de keel komen ook veel voor. Infectie van de ogen is in Nederland zeldzaam.
Moeder op kind (verticale transmissie)
Tijdens de vaginale baring kan het kind worden geïnfecteerd. Meestal gaat het dan om een conjunctivitis gonorrhoica.
Infectieuze periode
Gonorroe is tijdens de incubatietijd al overdraagbaar. Vierentwintig uur na het einde van behandeling met antibiotica waarvoor de stam gevoelig is, is de overdraagbaarheid voorbij.
Het is onduidelijk of de mate van besmettelijkheid bij een asymptomatische infectie anders is dan bij een infectie waarbij zich wel klachten voordoen.
Overdraagbaarheid
De transmissiekans is afhankelijk van de plaats van infectie en van het aantal seksuele contacten met de geïnfecteerde sekspartner, maar is bij gonorroe over het algemeen hoog (Lycke 1980, Cohen 1994).
De kans op transmissie bij een eenmalig onbeschermd vaginaal seksueel contact is met behulp van een model geschat op 20-30% van vrouw naar man en 50% van man naar vrouw op (Lin 1998). Bij meer seksuele contacten met dezelfde partner zullen deze kansen toenemen tot ongeveer 50% bij vrouw naar man en 90% bij man naar vrouw. Voor mannen die seks hebben met mannen (MSM) werd d.m.v. modellering de kans van urethraal naar rectaal op 80% geschat, van urethraal naar farynx op 60%. Van rectaal naar urethra werd uitgegaan van een kans van 2%, van farynx naar urethra 8% (Hui 2015).
Buiten het lichaam is de bacterie slechts kort levensvatbaar, onder andere door de grote gevoeligheid voor uitdroging. Dit is van belang bij het transport van voor kweek aangeboden materialen.
Risicogroepen
Verhoogde kans op infectie
Sleutelpopulaties zijn MSM, personen die een partnernotificatie ontvingen, personen die klachten hebben passend bij gonorroe, sekswerkers, en migranten of kinderen van migranten afkomstig uit gebieden met hoge prevalentie. Onder gebieden met hoge prevalentie vallen: Suriname, de voormalige Nederlandse Antillen, Turkije, Marokko, Afrika, Zuid-Amerika, Azië en Oost-Europa. Daarnaast pasgeborenen van wie de moeder gonorroe heeft.
Verhoogde kans op ernstig beloop
Bij instrumentele intra-uteriene ingrepen, waarbij de cervixbarrière wordt doorbroken (abortus, plaatsing van een spiraaltje), is de kans verhoogd op het opstijgen van een cervicale Ng-infectie en complicaties. Factoren die de kans vergroten op gedissemineerde gonorroe zijn complement-deficiënties en gebruik van eculizumab (Cartee 2022).
Verhoogde kans op ernstig beloop bij zwangerschap
Infectie tijdens de zwangerschap kan resulteren in een septische abortus, chorioamnionitis, te vroeg gebroken vliezen en postpartumendometritis.
Bij een pasgeborene kan conjunctivitis gonorrhoica optreden. Onbehandeld kan dit leiden tot blindheid.
Diagnostiek
Microbiologische diagnostiek
Nucleïnezuur amplificatietest (NAAT)
NAAT van de eerstestraals urine is de eerste keus om urogenitale gonorroe bij mannen aan te tonen of uit te sluiten. Als alternatief kan gekozen worden voor NAAT van pus uit de urethra; een urethra-uitstrijk (onaangenaam en pijnlijk) wordt afgeraden.
Bij MSM dient routinematig op drie locaties getest te worden (urethra, orofarynx en rectaal).
Vrouwen
Bij vrouwen is de eerste keus NAAT van materiaal diep vaginaal door de patiënt zelf afgenomen (zelfswab) (Hoebe 2006). Bij vaginaal onderzoek kan materiaal van de cervix afgenomen worden door de zorgverlener. De zelfswab heeft de voorkeur, vanwege de patiëntvriendelijkheid. In een vergelijking bleek dat de sensitiviteit van de NAAT op materiaal van de diep vaginaal afgenomen wattenstok voor Ng 100% was, terwijl die van de endocervixswab 95% bedroeg (Fang 2008). Een ander onderzoek vond bij gebruik van een Aptima-assay een sensitiviteit van 96% bij beide materialen (Schachter 2005). Een mogelijke tweede keus bij vrouwen is een NAAT (of kweek) van eerstestraals urine. Bij zwangeren met verdenking op gonorroe en bij patiënten met PID dient altijd een diepvaginale swab of cervixuitstrijk afgenomen te worden voor een NAAT. Bij vrouwen wordt diagnostiek op eerstestraals urine echter als minder sensitief beschouwd en daarom ontraden (Bignell 2011, Cook 2005).
Mannen en vrouwen
Bij anamnestische blootstelling (receptief anale en/of orale seks) en/of klachten kan zowel bij mannen als bij vrouwen een uitstrijk van keel en/of proctum en/of conjunctiva voor NAAT afgenomen. De tweede keus is een kweek.
De sensitiviteit van de NAAT is hoger dan van de kweek, waarbij het wel uitmaakt welke NAAT op welk materiaal wordt gebruikt (Schachter 2008). De specificiteit van de huidige generatie NAAT is zeer hoog en benadert voor sommige NAAT-testen de 100% (Masek 2009, Maze 2011). RNA en DNA kunnen nog steeds aanwezig zijn na succesvolle behandeling, en het aantonen ervan d.m.v. een NAAT te snel na behandeling geeft dan ook geen uitsluitsel over het al dan niet persisteren van de infectie (Wind 2016). Voor NAAT's die RNA detecteren kan bij urogenitale infecties vanaf één week na behandeling opnieuw getest worden; en bij orofaryngeale infecties na twee weken (Barbee 2022). Voor NAAT's die DNA detecteren kan bij urogenitale infecties pas vanaf twee weken na behandeling opnieuw getest worden (Wind 2016); de termijn waarop bij orofaryngeale infecties met DNA-gebaseerde NAAT's een 'test-of-cure' kan worden gedaan is onbekend. Voor specifieke NAAT's kan dit afwijken; raadpleeg hiervoor eventueel de arts-microbioloog of medisch moleculair microbioloog van het laboratorium.
Commerciële NAAT's zijn doorgaans gevalideerd voor urogenitale materialen. Wanneer deze testen door laboratoria ook voor diagnostiek op proctum- en keeluitstrijken gebruikt worden, is het de verantwoordelijkheid van het uitvoerend laboratorium om te valideren of een confirmatietest na een uitgevoerde NAAT nog noodzakelijk is. Schachter et al (2008) beschrijven een specificiteit van de Strand Displacement Assay (BD) en de Aptima Combo 2 (Genprobe) voor deze materialen van meer dan 99%. Ook bij een specificiteit van meer dan 99% kunnen toch fout-positieve resultaten voorkomen (afhankelijk van de in het laboratorium gebruikte NAAT). Bij grote consequenties van een positief testresultaat (bijvoorbeeld bij verdenking van seksueel misbruik bij kinderen) kan een confirmatietest toch zeer wenselijk zijn (Tielemans 2022).
Kweek (plus resistentiebepaling)
Een positieve kweek is bewijzend voor gonorroe, maar een kweek is minder gevoelig dan NAAT. Een kweek op Ng met resistentiebepaling dient in elk geval te worden verricht bij aanhoudende klachten na behandeling. In het licht van de toenemende frequentie van stammen die verminderd gevoelig zijn voor derdegeneratie-cefalosporinen verdient het aanbeveling om bij elke patiënt met door NAAT aangetoonde gonorroe ook te kweken voor resistentiebepaling. De gevoeligheid van kweken varieert tussen anatomische locaties: de gevoeligheid is het grootst bij urethra-materiaal (86%), minder bij de anus (55%) en cervix (50%), en het minste bij de keel (26%) (Kayaert 2023).
Optimaal is dat het afgenomen materiaal bij kamertemperatuur getransporteerd en bewaard wordt en binnen 6 uur in het microbiologisch laboratorium wordt verwerkt, omdat bij langere transporttijden de gevoeligheid van de kweek drastisch afneemt.
Indien de transporttijd naar het laboratorium langer is dan 6 uur kan (naast materiaal voor NAAT) een extra wattenstok afgenomen worden en verzonden worden in e-swabmedium. Het is ook mogelijk een e-swab in vers geloosde urine te dopen en daarna in e-swabmedium te transporteren. Afhankelijk van transporttijd (24 of 48 uur) en materiaal (urine geeft betere resultaten dan rectale en cervicale uitstrijken) is de sensitiviteit van een binnen 48 uur ingezette kweek nog 50-90% (Wind 2015). Zo is het dus mogelijk om een kweek te verrichten bij alle symptomatische Ng en alle aangetoonde Ng bij patiënten met een hoge kans op soa’s die gezien worden bij de CSG en in de tweede lijn.
Daarnaast moet altijd gekweekt worden wanneer om welke reden dan ook gekozen wordt voor een andere therapie dan ceftriaxon, omdat resistentie voor andere antibiotica geregeld waargenomen wordt.
Grampreparaat of methyleenblauwkleuring
Grampreparaat of methyleenblauwkleuring van urine of urethraswab bij mannen met urethraal écoulement toont intracellulaire (gramnegatieve) diplokokken in neutrofiele granulocyten en heeft in dergelijke gevallen een goede sensitiviteit. Bij vrouwen heeft het directe preparaat van cervicale of vaginale materialen een geringe sensitiviteit en ook de specificiteit is lager voor de diagnostiek van gonorroe. Het gebruik ervan wordt daarom afgeraden bij vrouwen. Ook bij anale secreten hebben gram- en methyleenblauwpreparaten een geringe sensitiviteit en specificiteit.
Bij gedissemineerde gonorroe is kweek en/of NAAT van pustels, bloed, synoviale vloeistof of liquor geïndiceerd.
Wanneer men bij een persoon gonorroe wil uitsluiten na een contact met verhoogde kans om Ng te hebben opgelopen, moet men rekening houden met de incubatietijd; in deze windowfase is een foutnegatieve uitslag mogelijk. Het is onbekend of na een contact de NAAT voor Ng al positief wordt voordat er klachten ontstaan. Een andere vraag is hoe lang gonorroe asymptomatisch kan persisteren. Voor de praktijk geldt: wanneer het contact (met verhoogde kans om Ng te hebben opgelopen) langer geleden is en de persoon nog geen klachten heeft, is het zinvol om tot drie maanden na dit contact te testen op asymptomatische urogenitale gonorroe bij mannen en vrouwen, en op indicatie op orofaryngeale en rectale gonorroe.
Overige diagnostiek
Serologie
Serologische bepalingen bij de diagnostiek van een infectie met N. gonorrhoeae zijn niet zinvol.
Thuisafnametesten/zelftesten
Er zijn (onder andere via internet) ook commerciële (zelf)testen beschikbaar waarbij de afname thuis kan worden gedaan. Bij sommige van deze testen dient het afgenomen materiaal naar een erkend laboratorium te worden gestuurd voor diagnostiek (thuisafnametesten); bij andere testen kan het testresultaat direct thuis worden afgelezen (zelftesten). De betrouwbaarheid van deze laatste categorie is vooralsnog onvoldoende gevalideerd. Soa Aids Nederland heeft een publieke toegankelijke testwijzer waarin verwezen wordt naar zowel aanbieders van soa-thuisafnametesten als hiv-zelftesten die tegen een vaste set criteria worden getoetst.
Preventie
Immunisatie
Een vaccin gericht tegen gonorroe is niet beschikbaar. Er is echter aangetoond dat buitenmembraanvesikelvaccins gericht tegen meningokokken B een matige bescherming tegen andere Neisseria-soorten kunnen bieden, zoals N. gonorrhoeae. De bescherming van deze vaccins tegen gonorroe ligt op populatieniveau tussen de 22 en 46% (Wang 2024). In Nederland is het 4CMenB-vaccin (Bexsero) het enige beschikbare buitenmembraanvesikel-MenB-vaccin. Bescherming neemt waarschijnlijk af over de tijd, blijkt uit een studie waarin de geschatte vaccineffectiviteit voor gonorroe 3 jaar na vaccinatie ruim 10% gedaald was (Wang 2023).
In het Verenigd Koninkrijk is vaccinatie met 4CMenB opgenomen in het programmatisch vaccineren van risicogroepen voor het oplopen van gonorroe, met name MSM (zie voor advies: JCVI 2023; advies opgevolgd in 2025). In Nederland wordt de kruisbescherming tegen gonorroe niet meegewogen in het Gezondheidsraadadvies betreffende 4CMenB, omdat het vaccin voor deze indicatie niet is geregistreerd.
4CMenB zou wel via vaccineren op eigen verzoek kunnen worden toegediend. Dit kan bij de GGD (Gemeentelijke gezondheidsdienst) (niet CSG) of bij bijvoorbeeld de huisarts of een private aanbieder. Hierbij dient goed te worden geïnformeerd over de effectiviteit, de mogelijke afname van bescherming over de tijd, bijwerkingen en de noodzaak om te blijven testen op gonorroe bij klachten. Het vaccineren op eigen verzoek is op eigen kosten en off-label; ook hierover dient de cliënt te worden geïnformeerd. Voor meer informatie over de eigenschappen, het doseringsschema, contra-indicaties en bijwerkingen, zie de LCI-factsheet Meningokokken B-vaccinatie.
Algemene preventieve maatregelen
Vermijden dat geïnfecteerde urethrale, vaginale, anale excreten van de ene partner in aanraking komt met het slijmvlies van de andere partner.
Seksuele overdracht van gonorroe kan sterk worden verminderd door het gebruik van condooms en/of beflapjes. Verschillende factoren kunnen van invloed zijn op het al dan niet gebruiken van een condoom (attitude, gedrag, vaardigheden). Het is van belang om deze te bespreken tijdens counseling.
Reiniging, desinfectie en sterilisatie
Conform de LCI-richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Maatregelen
Meldingsplicht
Voor individuele gevallen bestaat geen meldingsplicht. Voor alle artsen geldt een meldplicht aan de GGD als zij een voor hun praktijk ongewoon aantal gevallen van gonorroe vaststellen, als die een gevaar vormen voor de volksgezondheid (Wet Publieke Gezondheid, Hfdst V, paragraaf 2, Artikel 21.3).
Inschakelen van andere instanties
Ter ondersteuning van bron en contactopsporing kan een beroep op de lokale GGD worden gedaan.
Bron- en contactonderzoek
Bronopsporing
Vaak niet is vast te stellen wie de uiteindelijke infectiebron is geweest. Daarom wordt in de soa-bestrijding niet meer gesproken van bronopsporing, maar van partnernotificatie en contactonderzoek.
Contactonderzoek
Uitgebreide adviezen ten aanzien van partnernotificatie vindt u in het LCI-draaiboek partnermanagement.
Indien uit een cliënt een ceftriaxonresistent N. gonorrhoeae-isolaat wordt gekweekt ligt er een grote verantwoordelijkheid bij behandelaars en public-health professionals om zorg te dragen voor een optimale opsporing van contacten die zijn blootgesteld, zodat bij hen diagnostiek en eventueel behandeling plaats kan vinden. Een ongecontroleerde uitbraak van een ceftriaxonresistente stam zou aanleiding kunnen geven tot een groot public-healthprobleem.
Maatregelen ten aanzien van index en contacten
Bij een adequate therapie is de kans op overdracht waarschijnlijk, maar niet geheel zeker, binnen 24 uur verdwenen. Over het algemeen wordt geadviseerd tot zeven dagen na de behandeling geen seksueel contact te hebben. Om pingponginfecties te voorkomen moet(en) ook de seksuele partner(s) onderzocht, getest en behandeld worden. Tot een week nadat cliënt en partner behandeld zijn, wordt seksueel contact afgeraden. Indien de cliënt dit advies niet op wil volgen, wordt aangeraden in elk geval een condoom (of bij beffen een beflapje) te gebruiken, ook als de partner gelijktijdig wordt behandeld.
Maatregelen ter preventie van recidiefinfecties en ter voorkoming van andere soa
Het is van belang dat er zo snel mogelijk een gesprek wordt gehouden met de cliënt en voorlichting wordt gegeven over de transmissieroute, de infectieuze periode, de overdraagbaarheid, behandeling en preventie. Daarnaast is het belangrijk om gedragsverandering te ondersteunen door counseling. Motivational interviewing kan hierbij een goed hulpmiddel zijn.
Postexpositieprofylaxe
Er is geen indicatie voor profylactische behandeling.
Er zijn recent meerdere studies gedaan naar PrEP- en PEP (postexpositieprofylaxe)-strategieën ter voorkoming van bacteriële soa’s zoals chlamydia, gonorroe en syfilis (Grant 2020). Mocht een dergelijke interventie beschikbaar komen, is het de verwachting dat deze door mensen die een grote kans hebben op een soa (zoals MSM) zeer acceptabel zou zijn in gebruik (Wilson 2011). Dit blijkt ook uit het feit dat in een onderzochte Londense groep PrEP-gebruikers 8% reeds doxycycline, verkregen buiten de reguliere gezondheidszorg, als PEP-strategie gebruikte; in Nederland lijkt dit vooralsnog beperkt (Carveth-Johnson 2018, Evers 2020).
Een grote dubbel-geblindeerde placebo-gecontroleerd randomised controlled trial (RCT) onderzocht de effectiviteit van 200 milligram doxycycline als PEP binnen 24 uur na seksueel contact zonder condoom bij MSM (Molina 2018). De hazard ratio's (HR) voor PEP-gebruikers versus non-PEP-gebruikers waren 0,30 (95% CI 0,13-0,70; p = 0,006) voor chlamydia-infecties en 0,27 (95% CI 0,07-0,98; p = 0,047) voor syfilisinfecties. Er was geen significante reductie van gonorroe-infecties. Op het internationale AIDS-congres in Montreal in 2022 is een vergelijkbare RCT gepresenteerd met eveneens klinisch zeer significante reducties in chlamydia- en syfilisinfecties, en tevens een statistisch significante reductie in het aantal gonorroe-infecties (Luetkemeyer 2022).
Wat in deze onderzoeken vooralsnog ontbreekt is een evaluatie van de negatieve effecten op het vóórkomen van antimicrobiële resistentie. Zowel resistentieontwikkeling door het micro-organisme waartegen de PEP werd voorgeschreven alsmede resistentie van de commensale huid-/darm-microbiota is momenteel onvoldoende onderzocht. Dit hiaat maakt dat deze preventiestrategie momenteel nog niet geschikt is voor implementatie in de dagelijkse praktijk, ondanks veelbelovende eerste resultaten (Molina 2018, Luetkemeyer 2022). Mochten zorgprofessionals van cliënten de vraag krijgen doxycycline (of andere antimicrobiële middelen) als PEP voor te schrijven, moet derhalve deze strategie vooralsnog worden afgeraden. In het kader van schadebeperking kan, bij cliënten die doxycycline buiten het reguliere zorgcircuit verkrijgen, wel overwogen worden een doseerschema te benoemen dat gebruikt is in de RCT's.
Wering
Niet van toepassing.
Behandeling
Primaire behandeling
Geadviseerd wordt om behandeling te starten als een van de onderstaande diagnostische testen positief is:
- een positieve amplificatietest (NAAT);
- een positieve kweek;
- een positief grampreparaat/ methyleenblauwkleuring van urinesediment of urethrale purulente écoulement bij mannen (cave: foutpositieve testuitslag ten gevolge van aanwezigheid van andere Neisseriaceae) (Leeman 1996).
Behandeling kan eveneens worden gestart na afname van materiaal voor diagnostiek bij:
- syndroommanagement (behandeling instellen op basis van een persoon met urethritisklachten (dysurie en/of exsudaat);
- sekspartners (zie hiervoor draaiboek Partnermanagement).
Bij hoge verdenking op gonokokkenconjunctivitis op basis van het klinisch beeld dient de cliënt met spoed (binnen één dag!) naar de oogarts doorverwezen te worden voor microbiologische diagnostiek en uitsluiten gonokokkenkeratitis. Behandeling verloopt via de oogarts.
Aanbevolen behandeling van gonorroe
Bij een klinisch verdachte urethrale/anale gonorroe
- Ceftriaxon 500 mg i.m. (intramusculair) eenmalig; poeder (500 mg) voor i.m. injectie oplossen in 2 ml lidocaïnehydrochloride 10 mg/ml (1%) oplossing (pijnpreventie)
Soms zijn ampullen à 500 mg niet leverbaar of voorradig; in dat geval kan 1000 mg i.m. gegeven worden. Het wordt afgeraden een dosering van 1000 mg te delen, omdat er mogelijk ongelijke deling plaatsvindt (en dus mogelijk te lage dosering), en vanwege mogelijke verwisselingen en kruisbesmettingen.
Bij klinisch verdachte of bewezen faryngeale gonorroe
- Ceftriaxon 1000 mg i.m., eenmalig; poeder (1000 mg) voor i.m. injectie oplossen in 3,5 ml lidocaïnehydrochloride 10 mg/ml (1%) oplossing (pijnpreventie)
Indien patiënt reeds behandeld is met ceftriaxon 500 mg, dan is nieuwe behandeling niet noodzakelijk, maar wordt nacontrole middels NAAT geadviseerd na 3 weken.
Contra-indicaties voor het geven van ceftriaxon
- Absolute contra-indicatie: ernstige onmiddellijke of vertraagde allergische reactie op ceftriaxon of een cefalosporine met een vergelijkbare zijketen;
- Relatieve* contra-indicatie: een voorgeschiedenis van ernstige overgevoeligheid (zoals een anafylactische reactie) voor andere bètalactamantibiotica (d.w.z. een penicilline, monobactam of carbapenem);
- Aangetoonde ernstige allergie voor lidocaïne.
* De kruisactiviteit met cefalosporinen in patiënten met gerapporteerde penicilline-allergie is ongeveer 1%. Zie voor aanbevelingen: SWAB guideline for the approach to suspected Antibiotic Allergy.
Ook bij zwangere vrouwen kan ceftriaxon worden gebruikt en in lidocaïnehydrochloride (1%) worden opgelost. Dit is in tegenstelling tot wat in sommige bijsluiters wordt geschreven (op basis van informatie van Lareb).
Sommige internationale richtlijnen (o.a. Australië en IUSTI-Europe) bevelen een combinatie van cefalosporinen en azitromycine aan als eerste keus voor de behandeling van ongecompliceerde gonorroe (Unemo 2020, ASHM 2022). Andere internationale richtlijnen (m.n. van de VS en het VK) die voorheen ook deze combinatie aanraadden, zijn in hun meest recente versie daarop teruggekomen en raden nu weer ceftriaxonmonotherapie aan (Workwoski 2021, Fifer 2020). Ook voor Nederland wordt combinatietherapie niet aangeraden.
Standaard toevoegen van azitromycine wordt voor de Nederlandse situatie nu alleen geadviseerd om een eventuele chlamydia-infectie mee te behandelen.
Informatie waarom in Nederland geen combinatiebehandeling met cefalosporine en azitromycine als eerste keus plaatsvindt van ongecompliceerde gonorroe staat uitgewerkt in de MDR Soa's, hoofdstuk C2 Gonorroe.
Alternatieve behandeling van gonorroe
Indien ceftriaxon niet beschikbaar is, is een goed alternatief:
- cefotaxim 1000 mg i.m., eenmalig
Alleen op geleide gevoeligheidsbepaling (kweek of moleculair):
- ciprofloxacine 500 mg p.o., eenmalig
Tweede keuze bij absolute contra-indicatie voor ceftriaxon i.m. (en dus ook voor cefotaxim i.m.) en ontbreken van resistentiepatroon van de stam:
- azitromycine, 2000 mg p.o., eenmalig (vier tabletten van 500 mg)
Hoewel deze behandeling in het verleden bewezen effectief was (Handsfield 1994) is intussen resistentie voor azitromycine en therapiefalen beschreven. In Nederland lag het resistentiepercentage in 2021 op 18% en het is niet onaannemelijk dat dit verder toeneemt. Daarnaast zijn de gastro-intestinale bijwerkingen bij deze dosering aanzienlijk groter dan na een dosering van 1 g, maar deze laatste dosering is niet bewezen effectief. Na orale behandeling met azitromycine is een controle middels NAAT vanaf 1 à 2 weken na behandeling geïndiceerd, afhankelijk van welke test gebruikt wordt.
- ertapenem, 1000 mg i.m., eenmalig
Recent heeft een Nederlandse RCT de effectiviteit van ertapenem voor behandeling van Ng aangetoond (De Vries 2022). Het is echter onbekend of ertapenem ook effectief is tegen stammen met resistentie tegen ceftriaxon.
In de meest recente IUSTI/WHO-richtlijn worden als alternatieve therapie bij ceftriaxon therapiefalen de volgende combinaties geadviseerd (Unemo 2020):
- combinatie van ceftriaxon 1000 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig;
- combinatie van gentamicine 240 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig;
- combinatie van spectinomycine (in Nederland niet verkrijgbaar) 2000 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig.
De combinatie van gentamicine 240 mg + azitromycine 2 g voor de behandeling van anogenitale en orofaryngeale gonorroe was zeer effectief (100% [95% CI 95-100%]) in twee recente RCT’s (Rob 2020, Kirkcaldy 2014, Unemo 2020). De combinatie gentamicine 240 mg met azitromycine 1 g bleek in een grote Engelse RCT minder effectief (91%) (Ross 2019). Indien een kweek beschikbaar is, kan een antibioticum geselecteerd worden waar Ng nog wel gevoelig voor is. Nota bene: er zijn geen EUCAST-breekpunten voor ertapenem, azitromycine en gentamicine.
Behandeling van kinderen
Behandeling voor gonorroe kan worden overwogen als er een verhoogd risico voor infectie bestaat (bijvoorbeeld bij seksueel misbruik waarbij de dader mogelijk geïnfecteerd is), testen niet kunnen worden gedaan of worden geweigerd, als niet wordt verwacht dat het kind terug komt voor behandeling, of als tijdens follow-upklachten zijn ontstaan (Woods 2005).
De behandeling van kinderen < 18 jaar in geval van gonorroe met vulvovaginitis bestaat uit:
- ceftriaxon 50 mg/kg i.m. eenmalig, maximaal 500 mg
Behandeling van gonokokkenconjunctivitis en -keratitis bij volwassenen
Bij hoge klinische verdenking op gonokokkenconjunctivitis of -keratitis dient de cliënt met spoed (binnen één dag) naar de oogarts doorverwezen te worden voor (aanvullende) microbiologische diagnostiek en uitsluiten gonokokkenkeratitis. Een kweek met resistentiebepaling, NAAT en grampreparaat (cito) dienen te worden aangevraagd door de oogarts. Geadviseerd wordt om behandeling te starten zodra een van deze diagnostische testen positief is.
Behandeling van faryngeale gonokokkeninfectie bij volwassenen
Bijzondere situatie vanwege afwijkende dosering ceftriaxon; echter ook reeds hierboven genoemd:
- 1e keus: ceftriaxon 1000 mg i.m., eenmalig;
- 2e keus: ciprofloxacine 500 mg p.o., eenmalig (indien stam bewezen chinolonengevoelig).
Behandeling van gonokokkeninfectie bij borstvoeding of zwangerschap
- 1e keus: ceftriaxon 500 mg i.m., eenmalig;
- alternatief: op geleide gevoeligheidsbepaling (kweek), bijvoorbeeld amoxicilline 3000 mg p.o., eenmalig.
Behandeling bij anafylaxie voor penicilline
In het geval dat ceftriaxon na overwegen niet wordt gekozen (Farmacotherapeutisch Kompas z.d., Campagna 2012, Pichichero 2014):
- ertapenem, 1000 mg i.m., eenmalig;
- ciprofloxacine 500 mg p.o., eenmalig (alleen bij bewezen gevoeligheid);
- azitromycine 2000 mg p.o., eenmalig vier tabletten van 500 mg (met nacontrole, zie boven).
Voor behandeling van ophthalmia neonatorum, gegeneraliseerde infectie (bacteriëmie) gonokokkenconjunctivitis of -keratitis dient de persoon verwezen te worden naar de tweede lijn.
Behandeling bij recidief/onderhoudsbehandeling
Geen onderhoudsbehandeling. Behandeling bij recidief verschilt niet van eerste behandeling.
Controle
Controle na therapie is niet nodig indien behandeld is volgens de eerste keus standaardtherapie (ceftriaxon intramusculair).
Controle is wel geïndiceerd:
- na elke alternatieve behandeling van gonorroe en behandeling die niet conform bovenstaande richtlijn is geschied of die niet behandeld is met preparaat van eerste keus;
- bij persisterende klachten (in dit geval ook kweek afnemen);
- bij re-expositie aan onbehandelde bron (in dat geval ook testen op andere soa's).
Omdat de behandeling van orofaryngeale gonorroe minder effectief is dan de behandeling van ongecompliceerde anogenitale gonorroe, en vanuit het oogpunt van monitoring van optredende resistentie, is het controleren na behandeling van faryngeale gonorroe zinvol. Dit is echter kostbaar wegens de vele extra bezoeken. Het wordt inmiddels nauwelijks meer gedaan.
De controletest dient indien NAAT o.b.v. RNA plaatsvindt minimaal één week na het beëindigen van de behandeling plaats te vinden voor anogenitale gonorroe, en minimaal twee weken na het eindigen van de behandeling voor orofaryngeale gonorroe. Kweekonderzoek met resistentiebepaling bij persisterende klachten kan al 3-4 dagen na het beëindigen van de behandeling gedaan worden (De Vries 2022).
Bij syndromale behandeling van gonorroe (op basis van evidente klachten of directe diagnostiek) wordt soms een mogelijke Ct-infectie wel al meebehandeld. Voorkeursbehandeling daarvoor is 1000 mg azitromycine eenmalig (zie ook de LCI-richtlijn Chlamydia trachomatis). Er is geen bewijs dat dit nuttig is bij een negatieve NAAT voor Chlamydia trachomatis.
Als algemene richtlijn: bij een adequate therapie is de kans op overdracht waarschijnlijk binnen 24 uur verdwenen. Over het algemeen wordt echter geadviseerd tot een week na de behandeling geen seksueel contact te hebben. Dit is o.a. om partnerbehandeling mogelijk te maken (zie draaiboek Partnermanagement).
Ten slotte: zowel bij vrouwen als heteroseksuele mannen met vastgestelde gonorroe is het advies om te testen op hiv en syfilis (bij MSM is deze test standaard, ook zonder gonorroediagnose).
Literatuur
- Abara WE et al. Effectiveness of a serogroup B outer membrane vesicle meningococcal vaccine against gonorrhoea: a retrospective observational study. Lancet Infect Dis 2022; 22 (7): 1021-1029.
- ASHM. Gonorrhoea. In: Australian STI Management Guidelines for use in primary care. Via: sti.guidelines.org.au.
- Barbee LA et al. Time to Clearance of Neisseria gonorrhoeae RNA at the pharynx following treatment. J Clin Microbiol 2022; 60 (6): e0039922.
- Bignell C, Fitzgerald M. UK national guideline for the management of gonorrhoea in adults, 2011. Int J STD AIDS 2011; 22 (10): 541-547.
- Campagna JD et al. The use of cephalosporins in penicillin-allergic patients: a literature review. J Emerg Med 2012; 42: 612-620.
- Carlin E, Marzo-Ortega H, Flew S. British Association of sexual health and HIV national guideline on the management of sexually acquired reactive arthritis 2021. Int J STD AIDS. 2021; 32 (11): 986-997.
- Cartee JC et al. Phylogenomic comparison of Neisseria gonorrhoeae causing disseminated gonococcal infections and uncomplicated gonorrhea in Georgia, United States. Open Forum Infect Dis 2022; 9 (7): ofac247.
- Carveth-Johnson T et al. Doxycycline use in MSM (mannen die seks hebben met mannen) taking PrEP (pre-expositieprofylaxe). Lancet HIV 2018; 5 (9): e482.
- Cohen MS et al. Human experimentation with Neisseria gonorrhoeae: rationale, methods, and implications for the biology of infection and vaccine development. J Infect Dis 1994; 169 (3): 532-7.
- van Dam AP et al. Verified clinical failure with cefotaxime 1 g for treatment of gonorrhoea in the Netherlands: a case report. Sex Transm Infect 2014; 90: 513-514.
- EUCAST. Clinical breakpoints and dosing of antibiotics. Via: eucast.org.
- ECDC (European Centre for Disease Prevention and Control). Gonorrhoea. In: Annual epidemiological report for 2018. Stockholm: European Centre for Disease Prevention and Control; 2020.
- ECDC. Gonococcal antimicrobial susceptibility surveillance in the EU (Europese Unie)/EEA: summary of results for 2019. Stockholm: European Centre for Disease Prevention and Control; 2021.
- Evers YJ et al. Use of doxycycline and other antibiotics to prevent STIs among men who have sex with men visiting sexual health clinics in the Netherlands. Sex Transm Infect 2020; 96 (7): 550-1.
- Fang J et al. Evaluation of self-collected vaginal swab, first voided urine and endocervical swab specimens for the detection of Chlamydia trachomatis and Neisseria gobnorrhoeae in adolescent females. J Pediatr Adolesc Gynecol 2008; 21: 355-360.
- Farmacotherapeutisch Kompas. Geneesmiddelen: ceftriaxon. Via: farmacotherapeutischkompas.nl.
- Fifer H et al. 2018 UK national guideline for the management of infection with Neisseria gonorrhoeae. Int J STD AIDS 2020; 31 (1): 4-15.
- Grant et al. Doxycycline prophylaxis for bacterial sexually transmitted infections. Clin Infect Dis 2020; 70 (6): 1247-1253.
- de Greeff SC et al. 2022. Neisseria gonorrhoeae. In: NethMap 2022: consumption of antimicrobial agents and antimicrobial resistance among medically important bacteria in the Netherlands in 2021. RIVM (Rijksinstituut voor Volksgezondheid en Milieu) rapport 2022-0057. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu; 2022: 172-175.
- Han Y et al. Widespread use of high-dose ceftriaxone therapy for uncomplicated gonorrhea without reported ceftriaxone treatment failure: results from 5 years of multicenter surveillance data in China. Clin Infect Dis 2020; 70 (1): 99-105.
- Hoebe JPA et al. Acceptability of self taken vaginal swabs and first-catch urine samples for the diagnosis urogenital Chlamydia trachomatis and Neisseria gonorrhoeae with an amplified DNA assay in young women attending a public health sexually transmitted disease clinic. Sex Transm Dis 2006; 33: 491-495.
- Hofstraat S et al. Trends en determinanten van resistentie van Neisseria gonorrhoeae in Nederland. NVMM (Nederlandse Vereniging voor Medische Microbiologie) 2016; 24: 69-74.
- Hui B et al. Oral and anal sex are key to sustaining gonorrhoea at endemic levels in MSM populations: a mathematical model. Sex Transm Dis 2015; 91: 365-369.
- Jungmann E et al. Gonorrhoea in young heterosexuals attending urban STD clinics in Britain: a cross-sectional survey. Int J STD AIDS 2004; 15: 243-248.
- JCVI (Joint Committee on Vaccination and Immunisation). JCVI advice on the use of meningococcal B vaccination for the prevention of gonorrhoea. Independent report. Published 10 November 2023.
- Kate A et al. Risk factors, clinical features and outcomes of Neisseria keratitis. Int Ophthalmol 2021; 41 (10): 3361-3369.
- Kayaert L et al. Sexually transmitted infections in the Netherlands in 2022. RIVM rapport 2023-0161. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu; 2023.
- Kent CK et al. Prevalence of rectal, urethral, and pharyngeal chlamydia and gonorrhea detected in 2 clinical settings among men who have sex with men: San Francisco, California, 2003. Clin Infect Dis 2005; 41: 67-74.
- Klausner JD et al. Disseminated gonococcal infection. Via: uptodate.com. Geraadpleegd 2022.
- Koedijk FDH et al. Increasing trend in gonococcal resistance to ciprofloxacin in The Netherlands, 2006-8. Sex Transm Infect 2010; 86: 41-45.
- Korenromp EL et al. What proportion of episodes of gonorrhoea and chlamydia becomes symptomatic? Int J STD AIDS 2002; 13: 91-101.
- Leeman FWJ et al. Besmetting met anogenitale meningokokken. SOA-bulletin 1996; 17: 18-20.
- Luetkemeyer A et al. Doxycycline post-exposure prophylaxis for STI prevention among MSM and transgender women on HIV PrEP or living with HIV: high efficacy to reduce incident STI's in a randomized trial. AIDS conference 2022 abstract nr. OALBX0103.
- Lycke E et al. The risk of transmission of genital Chlamydia trachomatis infection is less than that of genital Neisseria gonorrhoea infection. Sex Transm Dis 1980; 7: 6-10.
- Marshall HS et al. An observational study to assess the effectiveness of 4CMenB against meningococcal disease and carriage and gonorrhea in adolescents in the northern territory, Australia-study protocol. Vaccines (Basel) 2022; 10 (2): 309.
- Masek BJ, et al. Performance of three nucleic acid amplification tests for detection of Chlamydia trachomatis and Neisseria gonorrhoeae by use of self-collected vaginal swabs obtained via an Internet-based screening program. J Clin Microbiol 2009; 47: 1663-1667.
- Maze MJ et al. Nucleic acid amplification of the opa gene for detection of Neisseria gonorrhoeae: experience from a diagnostic laboratory. J Clin Microbiol 2011; 49: 112.
- Mitchell CM et al. Etiology and diagnosis of pelvic inflammatory disease: looking beyond gonorrhea and chlamydia. J Infect Dis 2021; 224 (12 Suppl 2): S29-S35.
- Molina J-M et al. Post-exposure prophylaxis with doxycycline to prevent sexually transmitted infections in men who have sex with men: an open-label randomised substudy of the ANRS IPERGAY trial. Lancet Infect Dis 2018; 18 (3): 308-317.
- Morris SR et al. Prevalence and incidence of pharyngeal gonorrhea in a longitudinal sample of men who have sex with men: the EXPLORE study. Clin Infect Dis 2006; 43: 1284-1289.
- Nielsen R & Søndergaard J. Asymptomatic male and female gonorrhoea. Acta Derm Venereol 1975; 55: 499-501.
- Peerbooms PGH et al. Toename van chinolonresistentie bij Neisseria gonorrhoeae in Amsterdam. Ned Tijdschr Geneeskd 2001; 145: 1899-1900.
- Petousis-Harris H et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet 2017; 390 (10102): 1603-1610.
- Pichichero ME & Zagursky R. Penicillin and cephalosporin allergy. Ann Allergy Asthma Immunol 2014; 112: 404-412.
- Pinto M et al. Cephalosporin-resistant Neisseria gonorrhoeae isolated in Portugal, 2019. Sex Transm Dis 2020; 47 (11): e54-e56.
- Pleininger S et al. Extensively drug-resistant (XDR) Neisseria gonorrhoeae causing possible gonorrhoea treatment failure with ceftriaxone plus azithromycin in Austria, April 2022. Euro Surveill 2022; 27 (24): 2200455.
- Public Health England. More cases of antibiotic resistant gonorrhoea identified in England. Press release 7 February 2020. UK Health Security Agency. 2020 Feb. Via: gov.uk.
- Rob F et al. Gentamicin 240 mg plus azithromycin 2 g vs. ceftriaxone 500 mg plus azithromycin 2 g for treatment of rectal and pharyngeal gonorrhoea: a randomized controlled trial. Clin Microbiol Infect 2020; 26: 207-212.
- Rowley J et al. Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016. Bull World Health Organ 2019; 97 (8): 548-562P.
- Schachter J et al. Vaginal swabs are the specimens of choice when screening for Chlamydia trachomatis and Neisseria gonorrhoeae: results from a multicenter evaluation of the aptima assays for both infections. Sex Transm Dis 2005; 32: 725-728.
- Schachter J et al. Nucleic acid amplification tests in the diagnosis of chlamydial and gonococcal infections of the orofarynx and rectum in men who have sex with men. Sex Transm Dis 2008; 35: 637-642.
- Sherrard J & Barlow D. Gonorrhoea in men: clinical and diagnostic aspects. Genitourin Med 1996; 72: 422-426.
- Tielemans M et al. Confirmatory testing of Neisseria gonorrhoeae in a sexual health clinic: implications for epidemiology and treatment policy. Sex Transm Infect 2022; 98 (2): 121-124.
- Tran J et al. Kissing, fellatio, and analingus as risk factors for oropharyngeal gonorrhoea in men who have sex with men: A cross-sectional study. EClinicalMedicine 2022; 51: 101557.
- Unemo M, Golparian D, Eyre DW. Antimicrobial resistance in Neisseria gonorrhoeae and treatment of gonorrhea. Methods Mol Biol 2019; 1997: 37-58.
- Unemo M et al. 2020 European guideline for the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2020 Oct 29: 956462420949126.
- Unemo M, et al. Background review for the '2020 European guideline for the diagnosis and treatment of gonorrhoea in adults'. Int J STD AIDS 2021; 32 (2): 108-126.
- Visser M et al. Trends and regional variations of gonococcal antimicrobial resistance in the Netherlands, 2013 to 2019. Euro Surveill 2022; 27 (34): 2200081.
- de Vries HJC et al. Efficacy of ertapenem, gentamicin, fosfomycin, and ceftriaxone for the treatment of anogenital gonorrhoea (NABOGO): a randomised, non-inferiority trial. Lancet Infect Dis 2022; 22 (5): 706-717.
- Wang B et al. 4CMenB sustained vaccine effectiveness against invasive meningococcal B disease and gonorrhoea at three years post programme implementation. J Infect 2023; 87 (2): 95-102. Doi: 10.1016/j.jinf.2023.05.021
- Wang B et al. Vaccine effectiveness and impact of meningococcal vaccines against gonococcal infections: a systematic review and meta-analysis. J Infect 2024; 89 (3): 106225. Doi: 10.1016/j.jinf.2024.106225
- van Wees DA et al. Sexually transmitted infections in the Netherlands in 2021. RIVM rapport 2022-0023. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu; 2022.
- Whelan J et al. Ecologic study of meningococcal B vaccine and Neisseria gonorrhoeae infection, Norway. Emerg Infect Dis 2016; 22 (6): 1137-1139.
- Wiesner PJ et al. Clinical spectrum of gonococcal pharyngitis. N Engl J Med 1973; 288: 181-185.
- Wilson DP et al. Chemoprophylaxis is likely to be acceptable and could mitigate syphilis epidemics among populations of gay men. Sex Transm Dis 2011; 38 (7): 573-579.
- Wind CM et al. Successful combination of nucleic acid amplification test diagnostics and targeted deferred Neisseria gonorrhoeae culture. J Clin Microbiol 2015; 53: 1884-1890.
- Wind CM et al. Test of cure for anogenital gonorrhoea using modern RNA-based and DNA-based nucleic acid amplification tests: a prospective cohort study. Clin Infect Dis 2016; 62 (11): 1348-1355.
- Woods CR. Gonococcal infections in neonates and young children. Semin Pediatr Infect Dis 2005; 16: 258-270.
- Yan J et al. High percentage of the ceftriaxone-resistant Neisseria gonorrhoeae FC428 clone among isolates from a single hospital in Hangzhou, China. J Antimicrob Chemother 2021; 76 (4): 936-939.