COVID-19-vaccinatie Uitvoeringsrichtlijn
Versie 1 juli 2024 (versie 6.2)
Zie het versiebeheer onderaan de pagina voor een overzicht van de wijzigingen.
Of zie paragraaf 1.1 voor een meer uitgebreide toelichting op de wijzigingen in deze versie ten opzichte van de vorige versie van de COVID-19-vaccinatierichtlijn.
1. Over deze richtlijn
1.1 Inleiding en wijzigingen
Dit is de zesde versie van de uitvoeringsrichtlijn COVID-19-vaccinatie voor professionals. De vorige versies van deze richtlijn zijn niet meer actueel en zijn gearchiveerd.
Wijzigingen ten opzichte van vorige versie
Ten opzichte van de vorige versie (6.1) is op 1 juli 2024 de volgende wijziging doorgevoerd in de richtlijn:
- De houdbaarheid van de voorraad Nuvaxovid XBB.1.5 (het COVID-19 eiwitvaccin van Novavax) is per 30 juni 2024 verlopen. Nuvaxovid XBB.1.5 is vanaf 1 juli 2024 niet meer beschikbaar in het COVID-19-vaccinatieprogramma. De richtlijn is hierop aangepast.
1.2 Verantwoording
In deze professionele uitvoeringsrichtlijn COVID-19-vaccinatie staan de kaders voor de uitvoering van COVID-19-vaccinatie en de medische informatie over de uitvoering. De uitvoeringsrichtlijn is tot stand gekomen op basis van: rapporten van de Wereldgezondheidsorganisatie (WHO), het Europees Centrum voor ziektebestrijding en preventie (ECDC) en het Europees Geneesmiddelenbureau (EMA), brieven en adviezen van de Gezondheidsraad en het OMT-Vaccinatie (OMT-V), bijsluiters van de betreffende vaccins, recente wetenschappelijke publicaties en algemene principes zoals beschreven in het handboek Plotkin’s Vaccines (2017). Het is van belang om altijd de laatste online versie van de uitvoeringsrichtlijn te consulteren. Belangrijke wijzigingen in de richtlijn zullen via de website, via de organisaties van professionals en via de Nieuwsbrief COVID-19-vaccinatie kenbaar gemaakt worden.
De oude versies van de uitvoeringsrichtlijn COVID-19-vaccinatie zijn gearchiveerd. Deze oude versies blijven beschikbaar in het sitearchief, maar zijn niet meer actueel. (Versie 1 was beschikbaar vanaf 31 december 2020 t/m 8 december 2021, versie 2 vanaf 9 december 2021 t/m 19 september 2022, versie 3 vanaf 20 september 2022 t/m 23 maart 2023, versie 4 vanaf 24 maart 2023 t/m 21 september 2023, en versie 5 vanaf 22 september 2023 t/m 1 januari 2024.)
De eerste versie van de richtlijn (versie 1.0) is opgesteld door het RIVM in samenwerking met gemandateerden vanuit de beroepsverenigingen NVAVG, NHG, Verenso, NVAB, NVIB, AJN, LCR, V&VN en NIV. Daarmee is ook de basis gelegd voor volgende versies van de richtlijn COVID-19-vaccinatie. In samenwerking met de genoemde gemandateerden is deze richtlijn (versie 6) aangepast op basis van het Gezondheidsraadadvies ‘Structureel vaccinatieprogramma tegen COVID-19’, het besluit van het ministerie van Volksgezondheid, Welzijn en Sport (VWS) en nieuwe medische informatie. De richtlijn kan waar nodig op onderdelen worden aangepast aan de (veranderende) praktijk, in overleg met koepels van de uitvoerende partijen en/of betrokken specialisten.
1.3 Doelgroep
De richtlijn is bedoeld voor alle professionals die betrokken zijn bij de uitvoering van de COVID-19-vaccinatie. De richtlijn is ook bedoeld om medisch specialisten te informeren over de praktijk uitvoering van de COVID-19-vaccinatie om zo mogelijk vragen van specifieke patiëntengroepen te kunnen beantwoorden.
1.4 Reikwijdte
Personen woonachtig in Nederland en ingeschreven bij de gemeente komen in aanmerking voor COVID-19-vaccinatie indien zij behoren tot één van de doelgroepen voor vaccinatie. Daarnaast komen ook ongedocumenteerden, (uitgezette) personen in detentiecentra, personen die niet in Nederland wonen of zijn geregistreerd maar langer dan 1 maand in Nederland verblijven, asielzoekers, en Nederlandse diplomaten en militairen die in het buitenland zijn in aanmerking voor een COVID-19-vaccinatie, indien zij behoren tot de doelgroepen voor vaccinatie. Zie hoofdstuk 2 voor de indicatie voor de COVID-19-vaccinatie in 2024.
Caribisch deel van het Koninkrijk
Ook op de BES-eilanden (Bonaire, Sint Eustatius en Saba) is deze richtlijn van toepassing. De eilanden zijn zelf verantwoordelijk voor de lokale opslag en distributie van vaccins. Het RIVM heeft hierbij een adviserende rol en controleert of aan de randvoorwaarden voor correct vaccinbeheer wordt voldaan.
1.5 Wettelijke kaders en organisatie
In opdracht van de minister van VWS is het Centrum Infectieziektebestrijding van het RIVM (RIVM-CIb) verantwoordelijk voor de regie van het COVID-19-vaccinatieprogramma. Daaronder valt de ontwikkeling van de professionele richtlijn voor de uitvoering, het opzetten en de coördinatie van de communicatie over de COVID-19-vaccinatie naar professionals en de controle en evaluatie van het vaccinatieprogramma.
Deze professionele richtlijn komt tot stand in overleg met de medisch professionals die de vaccinaties (laten) toedienen. De richtlijn Uitvoering COVID-19-vaccinatie is de professionele norm voor medisch verantwoord handelen in het COVID-19-vaccinatieprogramma. Alleen in individuele gevallen kan een medisch professional, met argumenten onderbouwd, hiervan afwijken.
Vanuit de Rijksoverheid zijn partijen gecontracteerd voor de uitvoering van de vaccinaties. Het Besluit publieke gezondheid is voor het Rijksvaccinatieprogramma (RVP)-deel betreffende een vaccinatie tegen de infectie veroorzaakt door SARS-CoV-2 (het virus dat COVID-19 veroorzaakt) in maart 2021 aangepast. De uitvoering van deze vaccinatie is daarmee vastgelegd op twee niveaus: dit besluit en deze professionele richtlijn. De status van deze richtlijn is daarmee wettelijk vastgelegd.
De overheid heeft via de Europese Commissie contractafspraken gemaakt met verschillende vaccinontwikkelaars. Zodra een vaccin door het EMA is goedgekeurd en voor de Nederlandse markt beschikbaar is, verzorgt het Logistiek Coördinatiecentrum COVID-19-vaccinatie, een afdeling van de Dienst Vaccinvoorziening en Preventieprogramma’s binnen het RIVM (RIVM-DVP/LCC), de opslag en distributie naar de uitvoerende partijen.
Artsen, die op grond van de Wet Beroepen Individuele Gezondheidszorg (BIG) bekwaam zijn tot het vaccineren, dragen zorg voor de uitvoering. Onder hun verantwoordelijkheid kan de vaccinatie efficiënt en laagdrempelig worden uitgevoerd. De organisaties waaraan deze artsen verbonden zijn, worden hierna uitvoeringsorganisaties genoemd. Zie ook paragraaf 1.9.
Vervolgens gaan de gegevens van de toedieningen naar het RIVM voor centrale registratie. De gevaccineerde wordt om toestemming gevraagd (zie paragraaf 11.3). De centrale registratie van COVID-19-vaccinatie is van groot belang voor de gevaccineerde persoon, voor de uitvoering van het programma, de bewaking van de volksgezondheid en voor de monitoring van de effectiviteit en veiligheid. Het RIVM-DVP verzorgt de centrale registratie van de vaccinaties en de toegediende vaccins in het COVID-vaccinatie Informatie- en Monitoringssysteem (CIMS) en controleert de gegeven vaccinaties op juistheid wat betreft het merk van het vaccin en de expiratiedatum.
1.6 Toestemming en informatieverstrekking minderjarigen
De KNMG-wegwijzer Toestemming en informatie behandeling van minderjarigen bevat een praktische uitwerking van de wettelijke regels over toestemming en informatie bij de behandeling van minderjarige kinderen. Er staat beschreven wie de arts moet informeren en om toestemming moet vragen in verband met een medische handeling zoals de COVID-19-vaccinatie. Dit is afhankelijk van de leeftijd van de minderjarige.
In de praktijk van het vaccineren van kinderen en jongeren komt het op het volgende neer, zoals dat ook binnen het Rijksvaccinatieprogramma gebruikelijk is:
- Kinderen tot en met 11 jaar vallen volledig onder de zeggenschap van de ouders, gezaghebbenden of wettelijke vertegenwoordigers.
- Jongeren vanaf 12 tot en met 15 jaar hebben volgens de wet bij medische behandelingen of onderzoeken een belangrijke eigen stem. Bij verschil van mening tussen kind en ouders is de mening van het kind doorslaggevend als duidelijk is dat het kind goed weet waarover het gaat. Dit betekent dat als een jongere op de vaccinatielocatie verschijnt er in principe toestemming is voor vaccineren.
- Jongeren vanaf 16 jaar en ouder worden door de wet geneeskundige behandelingsovereenkomst (WGBO) op één lijn gesteld met volwassenen.
1.7 Uitvoeringsvragen professionals
Voor professionals met uitvoeringsvragen over de COVID-19-vaccinatie is bij het RIVM een speciaal telefoonnummer ingesteld: 088-689 8900. Het telefoonnummer voor uitvoeringsvragen is dagelijks bereikbaar. Met behulp van een keuzemenu worden de vragen over de betreffende afdelingen verdeeld:
- Beloptie 1 (08.30-17.00) voor logistieke vragen, ‘cold chain’-incidenten en productmeldingen: voor vragen over het bestellen van vaccins, vaccinlevering, vaccinbeheer, productklachten en vaccinincidenten. Productmeldingen kunnen worden gedaan door een e-mail voorzien van foto’s te sturen naar support.lcc@rivm.nl. Voor urgente situaties bij uitzonderlijke vaccinincidenten is een noodnummer beschikbaar. Het noodnummer is bereikbaar tussen 17:00‑20:00 uur. Mocht u daarvan gebruik moeten maken, luister dan het gehele bericht af onder beloptie 1 voor professionals.
- Beloptie 2 (08.30-17.00 op werkdagen) voor medisch-inhoudelijke vragen: voor alle medisch-inhoudelijke vragen waarop geen antwoord is te vinden in deze uitvoeringsrichtlijn COVID-19-vaccinatie of op de webpagina COVID-19-vaccinatie voor professionals op de RIVM-website. Uiteraard is de LCI voor calamiteiten 24 uur per dag bereikbaar voor de dienstdoende arts IZB van de GGD voor overleg.
- Beloptie 3 (08.30-17.00) voor registratievragen: voor het opvragen van vaccinatiegegevens, voor zover deze in het CIMS zijn geregistreerd.
Het telefoonnummer +31 88 689 8900 is ook beschikbaar voor professionals uit het Caribisch deel van het Koninkrijk.
Zorgprofessionals die vragen hebben over hun eigen gezondheidssituatie kunnen contact opnemen met de uitvoerende organisatie (bijvoorbeeld GGD of ziekenhuis).
Het melden van bijwerkingen hoort thuis bij het Bijwerkingencentrum Lareb. Voor het melden van bijwerkingen na coronavaccinatie is een speciaal COVID-19-bijwerkingen-meldformulier ontwikkeld (dit formulier is ook te vinden via www.lareb.nl). Meer informatie over bijwerkingen na coronavaccinatie kunt u vinden op www.lareb.nl/image-widget/bijwerkingen-coronavaccins. Zowel zorgverleners als gevaccineerden kunnen een bijwerking melden. Zie ook hoofdstuk 10.
1.8 De vaccins, vaccindistributie en -beheer
De minister van VWS bepaalt welk vaccin wanneer, bij wie en voor wie wordt geleverd. VWS wordt geadviseerd door de Gezondheidsraad en het OMT-V. Het voortschrijden van kennis, ontwikkelingen rondom vaccinaties, de beschikbaarheid van nieuwe vaccins en de epidemiologische situatie betekenen dat strategie en prioritering met regelmaat aan de actualiteit worden aangepast.
De vaccinatie wordt uitgevoerd met een COVID-19-vaccin geleverd door het RIVM.
Het RIVM is verantwoordelijk voor de distributie van de vaccins, oplosvloeistof, spuiten en naalden. De uitvoerende organisaties worden bevoorraad door de logistiek dienstverlener van het RIVM. De vaccins worden verstrekt op voorwaarde dat ze alleen worden gebruikt voor de geïndiceerde doelgroep. Het RIVM-DVP/LCC is verantwoordelijk voor distributie en ‘cold chain’ tot en met de levering aan de uitvoerder. Het vaccin blijft eigendom van het RIVM. Zie hoofdstuk 8 voor meer informatie.
De uitvoerder is verantwoordelijk vanaf levering tot en met de toediening en registratie van het vaccin. Vaccins moeten onder gecontroleerde omstandigheden worden bewaard en vervoerd en mogen alleen worden toegediend als dat te allen tijde is gegarandeerd. Bij vaccinincidenten en vragen over vaccins moet men contact opnemen met het RIVM‑DVP/LCC via het telefoonnummer 088-689 8900. Zie ook hoofdstuk 8.
1.9 Verantwoordelijkheid en aansprakelijkheid bij vaccinatie
De indicatie voor vaccinatie staat vermeld in deze richtlijn en hoeft dus niet bij iedereen afzonderlijk gesteld te worden. Voor het vaststellen van eventuele contra-indicaties is een arts eindverantwoordelijk.
Vaccineren is een voorbehouden handeling. Op de Rijksoverheid staat een overzicht van alle voorbehouden handelingen en welke beroepsgroep deze uit mag voeren.
Zie voor meer informatie over welke zorgverleners (zelfstandig) bevoegd zijn om te vaccineren ook het nieuwsbericht op de BIG-website en ook bijlage 2 Taakverdeling.
Taken kunnen door de arts worden gedelegeerd aan verpleegkundigen met een functionele zelfstandige bevoegdheid en professionals zonder een functionele zelfstandige bevoegdheid, conform de Wet op de beroepen in de individuele gezondheidszorg (BIG).
Degene die vaccineert, is verantwoordelijk voor de juiste toediening en dient zich te houden aan de professionele standaard zoals is beschreven in deze richtlijn.
De uitvoerende organisatie is eindverantwoordelijk voor het inrichten van het vaccinatieproces binnen de eigen organisatie en voor het laatste stuk in de keten van het vaccinbeheer (zie ook hoofdstuk 8). Iedere uitvoerende organisatie beschikt over een vaccinverantwoordelijke. De praktische uitwerking van deze richtlijn is aan de uitvoerende partijen zelf, kan per beroepsgroep enigszins verschillen en valt buiten deze richtlijn.
Voor de procedure voor het toedienen van COVID-19-vaccinaties door verpleegkundigen zonder lokale aanwezigheid van een arts is vanuit de GGD een notitie opgesteld voor verpleegkundigen werkzaam voor de GGD. Hierin worden de procedure en voorwaarden hiervoor beschreven. Deze notitie is afgestemd met het ministerie van VWS en de Inspectie Gezondheidszorg en Jeugd (IGJ), en is voor GGD-medewerkers te vinden op GGD GHOR Kennisnet.
De maatregel van de minister met het bijbehorend kader voor de inzet van voormalig artsen en verpleegkundigen met een recent verlopen BIG-registratie is per 1 augustus 2022 vervallen. Het ministerie heeft aangegeven dat binnen de wet BIG (art. 38) en de wet kwaliteit, klachten en geschillen zorg (WKKGZ) deze personen werkzaam kunnen blijven op de GGD-vaccinatielocaties. Vanuit de GGD’en (GGD GHOR) is hiervoor een notitie met kaders opgesteld, in overleg met VWS. De IGJ is hiervan op de hoogte gesteld. Deze notitie is voor GGD-medewerkers te vinden op GGD GHOR Kennisnet.
Het RIVM is verantwoordelijk voor de deskundigheidsbevordering van professionals (inclusief deze richtlijn) en voor het vaccinbeheer volgens GDP (‘good distribution practice’). De fabrikant is verantwoordelijk voor de kwaliteit van het vaccin.
Zie ook de veelgestelde juridische vragen en antwoorden over COVID-19-vaccinatie op de KNMG-website.
1.10 Financiële regels
VWS is verantwoordelijk voor de financiering. Mensen die zich laten vaccineren betalen geen bijdrage voor COVID-19-vaccinaties.
1.11 Gehanteerde definities
Arts: Tenzij anders aangegeven, kan waar ‘arts’ staat ook verpleegkundig specialist AGZ of ‘physician assistent’ worden gelezen (mits binnen deskundigheidsgebied, zie paragraaf 1.9).
Doelgroep: hiermee worden groepen bedoeld die een indicatie hebben voor een COVID-19-vaccinatie.
2 Vaccinatiestrategie COVID-19
In 2024 is de COVID-19-vaccinatie (coronaprik) doorlopend beschikbaar voor volwassenen en kinderen uit medische hoogrisicogroepen (als dat geadviseerd wordt door een behandelend arts) en voor personen die op individuele basis door een behandelend arts zijn verwezen voor vaccinatie. In het najaar van 2024 wordt een vaccinatieronde georganiseerd voor verschillende doelgroepen. Zie ook het besluit van de (demissionair) minister van VWS en het Gezondheidsraadadvies ‘Advies COVID-19-vaccinatie in 2024’.
2.1 Indicatie voor coronaprik
In de periode tot aan de najaarsronde 2024 is de COVID-19-vaccinatie mogelijk voor:
- volwassenen en kinderen uit medische hoogrisicogroepen indien de behandelend arts op individuele basis (extra) vaccinatie(s) adviseert, bijvoorbeeld als er sprake is van ernstige immuunsuppressie. Dit kan gaan om een extra vaccinatie (revaccinatie buiten de najaarsronde) of een hele nieuwe vaccinatieserie (hervaccinatie). Zie paragraaf 2.3 voor meer informatie over hervaccinatie;
- mensen die op individuele basis door een behandelend arts zijn verwezen voor vaccinatie (maatwerk).
In beide situaties betreft dit maatwerk; extra vaccinaties voor individuen waarvoor een verwijzing van een behandelend arts nodig is. Vóór de start van de najaarsronde 2024 komen geen specifieke risicogroepen in aanmerking. Indien iemand zonder verwijzing van een behandelend arts gevaccineerd wil worden, valt dit buiten de kaders van het vaccinatieprogramma en is vaccinatie in principe niet mogelijk.
In het najaar van 2024 zal een vaccinatieronde worden georganiseerd waarbij er wél specifieke risicogroepen in aanmerking komen voor vaccinatie.
Toelichting en onderbouwing van het vaccinatieprogramma
De vaccinatiestrategie is gebaseerd op het advies ‘Structureel vaccinatieprogramma tegen COVID-19’ van de Gezondheidsraad dat op 28 juni 2023 is gepubliceerd, het ‘Advies COVID-19-vaccinatie in 2024’ van de Gezondheidsraad dat op 27 maart 2024 is gepubliceerd, de Kamerbrief over diverse onderwerpen met betrekking tot COVID-19 (18 december 2023) en de Kamerbrief over de invulling aanbod COVID-19-vaccinatie naar aanleiding van geactualiseerd Gezondheidsraadsadvies die op 4 april 2024 is gepubliceerd.
Omdat een infectie met SARS-CoV-2 nog steeds tot aanzienlijke ziektelast en ziekenhuisopname kan leiden, met name onder personen met een medisch (hoog)risico en onder ouderen, adviseerde de Gezondheidsraad om aan risicogroepen periodiek (jaarlijks) in het najaar een vaccinatie aan te bieden om de bescherming tegen ernstige ziekte en ziekenhuisopname te verbeteren. Hoofdstuk 3 biedt een overzicht van de risicogroepen.
Naast een jaarlijkse vaccinatieronde heeft de Gezondheidsraad geadviseerd om vaccinatie het hele jaar door beschikbaar te houden voor zwangeren en voor mensen in de medische hoogrisicogroep die een (extra) vaccinatie of hervaccinatie nodig hebben. Sinds het Gezondheidsraadadvies uit 2023 zijn er meer gegevens over de ziektelast van COVID-19 tijdens de zwangerschap beschikbaar. Omdat het verhoogde risico op ernstige ziekte door COVID-19 tijdens de zwangerschap momenteel laag is, acht de Gezondheidsraad de toegevoegde waarde van vaccinatie voor alle zwangeren inmiddels te beperkt. Zwangerschap op zich is geen indicatie voor een COVID-19-vaccinatie.
Beschikbare vaccins
In het COVID-19-vaccinatieprogramma zijn de volgende vaccins beschikbaar voor de COVID-19-vaccinatie (de coronaprik):
| Fabrikant | Merknaam | Leeftijd | Soort vaccin | Dosis |
|---|---|---|---|---|
| Pfizer/BioNTech | Comirnaty Omicron XBB.1.5 |
6 mnd t/m 4 jaar | mRNA | 3 µg (0,2 ml) |
| Pfizer/BioNTech | Comirnaty Omicron XBB.1.5 |
5 t/m 11 jaar | mRNA | 10 µg (0,3 ml) |
| Pfizer/BioNTech | Comirnaty Omicron XBB.1.5 |
vanaf 12 jaar | mRNA | 30 µg (0,3 ml) |
In geval van vaccineren tijdens de zwangerschap heeft een mRNA-vaccin de voorkeur (zie verderop paragraaf 2.4).
Zie hoofdstuk 6 voor uitgebreide informatie over het Pfizer/BioNTech-vaccin.
Dosering
Aan volwassen en kinderen uit medische hoogrisicogroepen en personen die door een arts zijn verwezen voor vaccinatie kan één dosis gegeven worden, ongeacht aantal en soort eerder gegeven vaccin(s). Echter, indien er niet vanuit kan worden gegaan dat er al bestaande immuniteit door infectie of vaccinatie aanwezig is of indien er sprake is van verlies van immuniteit, volstaat 1 vaccinatie niet. Zie hiervoor paragraaf 2.3.
Interval na eerdere COVID-19 vaccinatie
Na de vorige COVID-19-vaccinatie wordt bij voorkeur een interval van 6 maanden of langer aangehouden, maar ten minste 3 maanden (12 weken).
Interval na doorgemaakte SARS-CoV-2-infectie
Een infectie stimuleert het immuunsysteem en leidt tot een versteviging van de immuniteit. Vaccinatie binnen 6 maanden na een SARS-CoV-2-infectie heeft immunologisch beperkte toegevoegde waarde. Een recente SARS-CoV-2-infectie is echter geen contra-indicatie voor vaccinatie.
Interval met andere vaccins
Bij het toedienen van een COVID-19-vaccinatie hoeft geen specifiek interval gehanteerd te worden met andere vaccinaties. Het gelijktijdig toedienen van een ander vaccin kan veilig en heeft geen duidelijke invloed op de immunogeniciteit of reactogeniciteit van de vaccins (paragraaf 7.5).
Een uitzondering is de toediening van een mRNA-COVID-19-vaccin aan mannen tot 40 jaar en een Imvanex®-vaccinatie tegen de mpox. Dit staat beschreven in paragraaf 7.5.
2.2 Extra coronaprik (revaccinatie)
Eén (jaarlijkse) dosis van een COVID-19-vaccin volstaat voor de meeste mensen uit de risicogroepen. Sommige volwassenen en kinderen uit de medisch hoogrisicogroep houden ondanks vaccinatie een verhoogd risico op een ernstig beloop van COVID-19. Zij kunnen mogelijk baat hebben bij revaccinaties vaker dan 1 keer per jaar binnen het behandeltraject van hun medisch specialist.
Vanwege een onderliggende ziekte of medicatie is het mogelijk dat enkele patiëntencategorieën in mindere mate een afweerrespons opbouwen na vaccinatie. Ook kan bij immuungecompromitteerde patiënten de duur van bescherming korter zijn dan bij personen zonder immuunstoornis. Dat is de reden dat bij sommige (ernstig) immuungecompromitteerde patiënten een COVID-19-vaccinatie vaker dan één keer per jaar is geïndiceerd.
De medisch specialist stelt de indicatie voor een extra coronavaccinatie en kan patiënten verwijzen naar de GGD middels een verwijsbrief met informatie over het optimale vaccinatiemoment. Voor afwegingen bij de indicatiestelling en vaccinatietiming, zie de Handleiding COVID-19-vaccinatie van immuungecompromitteerde patiënten.
Desondanks zullen er patiënten blijven die ondanks meerdere revaccinaties geen beschermende afweerrespons opbouwen.
2.3 Primaire vaccinatieserie en hervaccinatie
Eén (jaarlijkse) dosis van een COVID-19-vaccin volstaat voor de meeste mensen uit de risicogroepen. Indien er niet vanuit kan worden gegaan dat er al bestaande immuniteit aanwezig is door infectie of vaccinatie óf indien er sprake is van verlies van immuniteit, kan er een indicatie zijn voor een primaire vaccinatieserie.
De medisch specialist stelt hiervoor de indicatie en kan patiënten verwijzen naar de GGD middels een verwijsbrief met informatie over het aantal te halen prikken en het optimale vaccinatiemoment.
Kinderen jonger dan 5 jaar
Voor kinderen jonger dan 5 jaar met een medisch hoog risico gelden de volgende adviezen:
- kinderen van 6 maanden tot 5 jaar met een voorgeschiedenis van voltooiing van een primaire serie COVID-19-vaccinatie en/of een (anamnestisch) doorgemaakte infectie met SARS-CoV-2 volstaat een enkele dosis vaccin.
- voor kinderen van 6 maanden tot 5 jaar zonder voorgeschiedenis van voltooiing van een primaire serie COVID-19-vaccinatie of een eerdere infectie met SARS-CoV-2 kan overwogen worden om een volledige primaire vaccinatieserie aan te bieden (3 doses Comirnaty Omicron XBB.1.5 (3µg)). Uitgangspunt is dat eerder gegeven vaccins niet opnieuw toegediend hoeven te worden.
De (kinder)arts die de indicatie voor vaccinatie stelt, bepaalt het aantal benodigde vaccinaties.
Onderbouwing: Uit de PICO-data blijkt dat bijna alle kinderen in de leeftijd van 2-12 jaar COVID-19 heeft doorgemaakt. Voor kinderen <2 jaar zijn geen betrouwbare gegevens beschikbaar. Zie de resultaten van het PIENTER Corona onderzoek.
Hervaccinatie na een stamceltransplantatie of B-cel-depleterende therapie
Na een stamceltransplantatie (allogeen of autoloog) of een B-cel-depleterende therapie is de door vaccinatie opgebouwde immuniteit niet meer aanwezig of onvoldoende ontwikkeld. Bij autologe transplantaties ontvangen patiënten hun eigen stamcellen terug, bij allogene transplantatie ontvangen patiënten stamcellen van een donor. Beide groepen patiënten komen in aanmerking voor een hervaccinatie, waarbij de patiënt een nieuwe primaire serie krijgt, eventueel gevolgd door een revaccinatie, zie onderstaande tabel. Voor verdere informatie, zie de Handleiding COVID-19-vaccinatie van immuungecompromitteerde patiënten.
| Leeftijd | Primaire serie | Interval | Revaccinatie | Streefinterval voor revaccinatie | Route vaccinatie |
|---|---|---|---|---|---|
| ≤5 jaar | 3 doses Comirnaty XBB.1.5, 3 µg (0,2 ml) | 3 weken na 1e*, 8 weken na 2e |
**** | 6 maanden of meer |
|
| 5 t/m 11 jaar | 2 doses Comirnaty XBB.1.5, 10 µg (0,3 ml) | 4-8 weken** | **** | 6 maanden of meer |
|
| Vanaf 12 jaar | 2 doses Comirnaty XBB.1.5, 30 µg (0,3 ml)*** | 3 weken*** | **** | 6 maanden of meer |
|
* De tweede vaccinatie wordt bij voorkeur 4 weken na de eerste vaccinatie gegeven; het minimale interval is 3 weken.
** Bij voorkeur worden de 2 doses in de basisserie gegeven met een interval van 4 weken en anders z.s.m. daarna. Indien het interval langer is dan 8 weken hoeft de primaire vaccinatiereeks niet opnieuw te worden gestart.
*** Zie de Handleiding COVID-19-vaccinatie van immuungecompromitteerde patiënten voor meer informatie over de patiëntengroepen van 12 jaar en ouder die in aanmerking kunnen komen voor een derde prik in de primaire serie, op indicatie van de medisch specialist. De derde prik in de primaire serie wordt minimaal 4 weken na de laatste vaccindoses gegeven.
**** Revaccinatie kan in een eventuele jaarlijkse vaccinatiecampagne plaatsvinden. Op indicatie kan ook eerder een extra revaccinatie gegeven worden. De behandelend kinderarts of medisch specialist kan dit aangeven op de verwijsbrief.
In geval van hervaccinatie bij immuungecompromitteerde patiënten wordt bij voorkeur gebruik gemaakt van een mRNA-vaccin. Voor uitzonderingsgevallen, bij een contra-indicatie voor een mRNA-vaccin of indien men op eigen verzoek opteert voor een niet-mRNA-vaccin, is tijdelijk geen alternatief vaccin beschikbaar.
2.4 Vaccineren tijdens de zwangerschap
COVID-19-vaccinatie wordt niet standaard aan alle zwangeren geadviseerd. Zwangerschap op zich is geen reden voor vaccinatie.
Indien de behandelend arts een indicatie stelt voor de COVID-19-vaccinatie bij een zwangere (bijvoorbeeld vanwege een medisch hoog risico), kan dit door het jaar heen gegeven worden.
Personen die in het najaar in aanmerking komen voor een COVID-19 vaccinatie omdat zij tot één van de doelgroepen behoren, kunnen als zij zwanger zijn veilig gevaccineerd worden.
De COVID-19-vaccinatie met een mRNA-vaccin kan veilig gegeven worden op elk moment in de zwangerschap, bij een zwangerschapswens en tijdens de borstvoedingsperiode.
Ziektelast bij omikron
Diverse onderzoeken laten een milder verloop zien van een SARS-CoV-2-infectie door omikronvarianten dan door eerdere virusvarianten bij zwangeren (Adhikari 2022, Floyd 2022, Birol Ilter 2022). Dit betreft zowel minder complicaties bij de zwangere, zoals een pneumonie of ziekenhuisopname, als ook minder complicaties bij het ongeboren kind, zoals een vroeggeboorte. In 2020 en 2021 was een SARS-CoV-2-infectie tijdens de zwangerschap een belangrijke risicofactor voor vroeggeboorte, maar daarna is het risico grotendeels verdwenen (Torche 2023).
Veiligheid tijdens zwangerschap
Een groot Canadees onderzoek toont de veiligheid van mRNA-vaccins aan tijdens zwangerschap (Sadarangani 2022).
Verschillende onderzoeken laten geen associatie zien tussen COVID-19-vaccinatie en het risico op abortus, zwangerschapsverlies en vroeggeboorte (Lipkind 2022, Magnus 2022). Ook is geen associatie met ernstige bijwerkingen als myocarditis, pericarditis en trombose gevonden (DeSilva 2022). Tot slot is er geen verhoogd risico gevonden op foetale aangeboren afwijkingen na maternale vaccinatie (Goldshtein 2022, Ruderman 2022). De conclusie van een recente meta-analyse, die tien observationele studies bevat, is dan ook dat vaccinatie veilig is en geen ernstige zwangerschapsuitkomsten veroorzaakt zoals eclampsie, beroerte en de noodzaak van een bloedtransfusie (Hameed 2023).
In geval van vaccineren tijdens de zwangerschap heeft een mRNA-vaccin de voorkeur.
Veiligheid bij zwangerschapswens
Hoewel vaccinatie kortdurende effecten kan hebben op de menstruatiecyclus (Edelman 2022, Trogstad 2022, Laganà 2022) laten dierproefonderzoeken, onderzoeken in IVF-centra en vaccintrials geen verminderde vruchtbaarheid zien na mRNA-COVID-19-vaccinatie. Een onderzoek in Israël toont aan dat COVID-19-vaccinatie niet leidt tot functionele veranderingen van het Graafse follikel of eiblaasje (Bentov 2021). Ook wordt geen kruisreactiviteit gezien tussen antilichamen tegen het SARS-CoV-2-spikeproteïne en een proteïne betrokken bij de placenta-ontwikkeling (Prasad 2021).
Veiligheid tijdens de borstvoedingsperiode
Vaccinatie met een mRNA-vaccin kan veilig tijdens de borstvoedingsperiode gegeven worden. Er worden na vaccinatie geen ernstige nadelige gevolgen gezien bij moeder of kind (Bertrand 2021, Perl 2021, Low 2021b). Sommige vrouwen meldden dat ze enkele dagen meer of minder melk produceren na vaccinatie (Bertrand 2021, McLaurin-Jiang 2021). Mogelijk hangt verminderde melkproductie samen met systemische bijwerkingen bij de moeder zoals vermoeidheid, koorts en braken (Covelli 2023). In één studie werd in een deel van de onderzochte moedermelkmonsters een minimale hoeveelheid mRNA gevonden (Low 2021a). De hoogst gevonden concentratie mRNA in de melk was 2 ng/ml; naar verwachting niet relevant voor het kind, omdat dit in de maag van het kind wordt afgebroken.
Het melden van bijwerkingen
Moeders van Morgen (www.moedersvanmorgen.nl) is onderdeel van Bijwerkingencentrum Lareb en het kenniscentrum op gebied van geneesmiddelen bij kinderwens, tijdens de zwangerschap en in de borstvoedingsperiode. Door deelname aan Moeders van Morgen wordt de ervaring met COVID-19-vaccinatie tijdens de zwangerschap systematisch gedocumenteerd. (Ernstige) bijwerkingen tijdens de zwangerschap kunnen via het reguliere coronavaccin-meldformulier worden gemeld aan Bijwerkingencentrum Lareb (zie paragraaf 10.4).
3. Definitie medische (hoog)risicogroepen
In 2024 is de COVID-19-vaccinatie (coronaprik) doorlopend beschikbaar voor volwassenen en kinderen uit medische hoogrisicogroepen als dat geadviseerd wordt door een behandelend arts en voor personen die op individuele basis door een behandelend arts zijn verwezen voor vaccinatie. Zie paragraaf 2.1 voor de indicatie voor de coronaprik (vaccinatiestrategie) in 2024. In het najaar van 2024 wordt een vaccinatieronde georganiseerd voor verschillende doelgroepen.
Onderstaande overzichten geven ter informatie de samenstelling van de medische risicogroepen en de medische hoogrisicogroepen weer die een hoger risico lopen op een ernstig beloop van een SARS-CoV-2-infectie. Zie paragraaf 2.1 voor de indicaties en vaccinatiestrategie in 2024.
Voor een onderbouwing van de indeling van medische (hoog)risicogroepen, zie de adviesnota Vaststelling volwassen medische risicogroepen COVID-19-vaccinatiecampagne. De medische hoogrisicogroep voor COVID-19 is een subcategorie van de medische risicogroep die een indicatie heeft voor de jaarlijkse influenzavaccinatie. Voor kinderen met een verhoogd medisch risico zijn de criteria opgesteld door de Nederlandse Vereniging voor Kindergeneeskunde (NVK).
3.1 Medische risicogroep/griepprikgroep vanaf 18 jaar
Tot de medische risicogroep voor COVID-19 (grotendeels overeenkomstig met de indicatie voor de influenzavaccinatie) behoren:
3.2 Kinderen medische hoogrisicogroep vanaf 6 maanden t/m 17 jaar oud
| Sectie | Selectiecriteria |
|---|---|
| Erfelijke en aangeboren aandoeningen |
|
| Cardiologie | Met name kinderen met een zogenoemde fontancirculatie (kinderen met een half hart), kinderen met hartfalen en kinderen met pulmonale hypertensie |
| Endocrinologie | N.v.t. |
| Hematologie |
|
| Longziekten |
|
| Kindermaag-darm-leverziekten |
|
| Nefrologie |
|
| Reumatologie |
Kinderen die behandeld worden met:
|
| Metabole ziekten |
|
| Pediatrische infectieziekten en immunologie |
|
| Kinderoncologie |
|
| Allergologie | N.v.t. |
| Neurologie |
|
NB. Naar inzicht van de behandelend kinderarts kunnen ook andere kinderen met vergelijkbare diagnoses in aanmerking komen voor (re)vaccinatie.
3.3 Volwassenen medische hoogrisicogroep vanaf 18 jaar
Tot de medische hoogrisicogroep voor COVID-19 behoren:
|
* Dit betreft instellingen waar ouderen, verstandelijk gehandicapten en GGZ-cliënten wonen met zorg of begeleiding.
4. Contra-indicaties
4.1 Absolute contra-indicaties
Voor het stellen van een contra-indicatie voor een vaccinatie moet een individuele afweging gemaakt worden. Voor de COVID-19-vaccins gelden als absolute contra-indicaties:
- een bevestigde allergie voor bestanddelen van het COVID-19-vaccin, waarbij door een allergoloog* is bevestigd dat er geen COVID-19-vaccinatie kan worden toegediend;
- een aangetoonde ernstige en/of onmiddellijke** voor allergie verdachte reactie na een eerdere toediening van het COVID-19-vaccin, waarbij door een allergoloog* is bevestigd dat er geen volgende COVID-19-vaccinatie kan worden toegediend.
* In geval van een contra-indicatie in verband met een mogelijke allergie moeten deelnemers altijd met een behandelend arts/allergoloog overleggen of ze alsnog een volgende COVID-19-vaccinatie (ongeacht merk) mogen krijgen. Zie paragraaf 4.3.
** Met ‘ernstig’ worden geobjectiveerde major symptomen bedoeld zoals acute dyspneu, hypotensie met snelle pols of gegeneraliseerde huidreactie met urticaria/angio-oedeem. Met ‘onmiddellijk’ wordt binnen 4 uur bedoeld. Ook een acute (niet ernstige) gegeneraliseerde voor allergie verdachte huidreactie (zoals jeukend erytheem) is een contra-indicatie. Zie ook de handreiking Beoordelen van een voor allergie verdachte reactie na COVID-19-vaccinatie.
Zie de bijsluiters voor de bestanddelen van de vaccins, frequente bijwerkingen en andere absolute contra-indicaties.
Het onderscheid maken tussen anafylactische reacties en stressgerelateerde reacties kan lastig zijn. Voor het beoordelen van stressreacties versus anafylactische reacties gerelateerd aan de vaccinatie is een handreiking van de WHO beschikbaar, waarin met name Table 4.1 ‘Differences between anaphylaxis, general acute stress response and vasovagal reaction with syncope’ goed bruikbaar is in de praktijk (zie paragraaf 4.5).
Voor verdere postvaccinale verschijnselen, zie hoofdstuk 10.
4.2 Verhoogde bloedingsneiging
Zowel aangeboren als verworven (door medicatie) verhoogde bloedingsneiging kan een contra-indicatie zijn voor intramusculair (i.m.) vaccineren in verband met een verhoogde kans op spierbloedingen. COVID-19-vaccins worden in principe niet subcutaan (s.c.) toegediend en zijn alleen geregistreerd voor intramusculaire toediening.
Subcutane toediening is niet in een vergelijkende studie onderzocht en het is niet bekend of het vaccin subcutaan een even goede effectiviteit kan bieden als intramusculair. Wel bleek bij een groep gezonde volwassenen die per ongeluk subcutaan gevaccineerd was, het vaccin voldoende immunogeen (Friedensohn 2021). Het is onbekend of s.c. vaccinatie meer kans geeft op lokale bijwerkingen.
Vrijwel altijd kan er ondanks stollingsstoornissen toch i.m. gevaccineerd worden. In een aantal gevallen zijn er bij i.m. vaccinatie wel extra voorzorgsmaatregelen nodig of moet eerst contact opgenomen worden met de behandelaar. Soms kan er na overleg met de behandelend specialist gekozen worden voor subcutane vaccinatie. Bijvoorbeeld bij mensen met een ernstige stollingsstoornis die niet te corrigeren is en waarbij i.m. vaccinatie gecontraïndiceerd is, terwijl het onwenselijk is om helemaal van vaccinatie af te zien.
Indien i.v.m. (mogelijke) stollingsstoornissen contact met de behandelend specialist of trombosedienst nodig is:
- Vraag of bij de betreffende persoon de kleine hoeveelheid COVID-19-vaccin die van toepassing is i.m. mag worden toegediend.
- Vraag welke aanvullende maatregelen eventueel nodig zijn, zoals: i.m. vaccinatie kort of langer na inname van de medicatie en/of de prikplek langer afdrukken.
- Er wordt standaard met een dunne naald 23G gevaccineerd (geleverd door het RIVM).
- Als de behandelaar i.m. vaccineren afraadt, bespreek dan de mogelijkheid van s.c. vaccineren met behandelaar en cliënt (informed consent).
- De optie voor s.c. vaccineren is uitsluitend van toepassing op de mRNA vaccins. Mocht er besloten worden tot s.c. vaccinatie druk dan na het vaccineren 10 minuten stevig af.
Als er een andere medische contra-indicatie is voor i.m. vaccinatie (naast stollingstoornissen) kan in voorkomende gevallen na overleg met de behandelaar en informed consent van de client of diens wettelijke vertegenwoordiger eveneens gekozen worden voor een s.c. vaccinatie.
Bij het gebruik van cumarinederivaten – ook wel vitamine K-antagonisten (VKA) genoemd
De patiënt wordt in de gezondheidsvragenlijst gevraagd om zelf contact op te nemen met de trombosedienst. Check of de patiënt inderdaad voor de vaccinatie contact heeft gehad met de trombosedienst en of de trombosedienst akkoord was met de vaccinatie, al dan niet na aanpassing van de dosering. Indien er geen contact is geweest met de trombosedienst wordt het beleid bij 18 jaar en ouder bepaald op basis van de anamnese en (indien bekend) INR; zie onderstaand tabel 4.2. Bij minderjarigen moet er alsnog eerst contact opgenomen worden met de trombosedienst; zie de aparte tabel Stollingsstoornissen bij minderjarigen.
NB. Factor-V-Leiden is een erfelijke aandoening waarbij een verhoogde kans bestaat op spontane trombose en longembolie. Dit is géén contra-indicatie voor intramusculair vaccineren.
Tabel 4.2 Stollingsstoornissen bij mensen van 18 jaar en ouder.
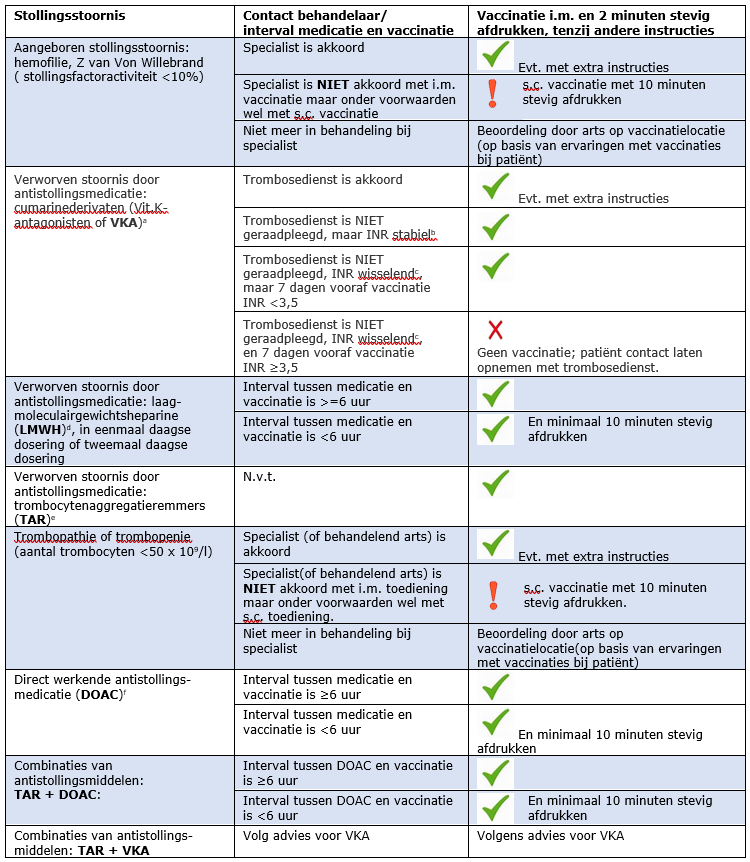
a VKA voorbeelden: acenocoumarol en fenprocoumon (Marcoumar).
b INR stabiel: de afgelopen 3 maanden hoefde het medicatiebeleid niet aangepast te worden op basis van de INR-controles.
c INR wisselend: er wordt regelmatig gecontroleerd door de trombosedienst.
d LMWH voorbeelden: nadroparine (Fraxiparine, Fraxiparine Forte), dalteparine (Fragmin), tinzaparine (Innohep) en enoxaparine (Clexane, Inhixa, Lovenox). Deze worden onder andere voorgeschreven aan patiënten met veneuze trombose of longembolie bij kanker of aan zwangere vrouwen die antistolling nodig hebben.
e TAR voorbeelden: acetylsalicylzuur (Aspro, Aspirine, Alka-Seltzer), clopidogrel (Grepid, Iscover, Plavix), dipyridamol (Persantin), prasugrel en ticagrelor.
f DOAC voorbeelden: rivaroxaban of edoxaban (eenmaal daags gedoseerd) en apixaban of dabigatran (tweemaal daags gedoseerd).
De tabel is gebaseerd op de standaard richtlijnen van het LCR, maar is op diverse punten aangepast mede na overleg met hematologen en behandelaren van hemofiliepatiënten. Alle voorkomende situaties staan in de tabel hierboven. Klik hier om de tabel te downloaden als pdf op A4-formaat.
Let op: voor minderjarigen is een aparte tabel van toepassing (Tabel Stollingsstoornissen bij minderjarigen, 6 maanden t/m 17 jaar). Klik hier om deze tabel te downloaden als pdf op A4-formaat.
Toelichting toediening van LMWH of DOAC en moment van vaccinatie
- Eenmaal daagse dosering van LMWH of DOAC:
Bij eenmaal daagse dosering van DOAC of LMWH minimaal 6 uur ná de laatste inname van de DOAC of LMWH-injectie vaccineren. Indien een patiënt ’s avonds de DOAC of LMWH neemt, kan de ochtend erna worden gevaccineerd. Indien een patiënt ’s ochtends de DOAC of LMWH neemt, dan moet er minimaal 6 uur na deze ochtenddosis worden gevaccineerd. Na de vaccinatie minimaal 2 minuten afdrukken zonder te wrijven. - Tweemaal daagse dosering van LMWH of DOAC:
Bij tweemaal daagse dosering van DOAC of LMWH moet de vaccinatie 1 uur vóór de volgende inname van de DOAC of de LMWH-injectie worden uitgevoerd. Bij vaccineren in de ochtend betekent dit dat de ochtenddosis DOAC of LMWH moet worden uitgesteld en pas kan worden ingenomen of geïnjecteerd tot minimaal 1 uur ná de COVID-19-vaccinatie. Bij vaccineren in de middag moet minimaal 6 uur na de ochtenddosis DOAC of LMWH worden gevaccineerd. Na de vaccinatie minimaal 2 minuten afdrukken zonder te wrijven. - DOAC of de LMWH korter dan 6 uur geleden gehad én patiënt is al op de vaccinatielocatie:
Indien een patiënt de DOAC of de LMWH korter dan 6 uur geleden voordat de vaccinatie moet plaatsvinden heeft genomen op het moment van vaccinatie, of indien hij/zij een combinatie van TAR en DOAC of LMWH gebruikt, kan er wel gevaccineerd worden.
Idealiter wordt een interval van 6 uur aangehouden, maar het is onwenselijk om de patiënt een nieuwe vaccinatieafspraak te laten maken. In deze situatie is langer afdrukken noodzakelijk: na de vaccinatie afdrukken gedurende minimaal 10 minuten, zonder te wrijven. - Tijdstip laatste dosis DOAC of LMWH onbekend én patiënt is al op de vaccinatielocatie:
Indien een patiënt niet meer weet wanneer de laatste dosis DOAC of LMWH is genomen, kan er wel gevaccineerd worden. Idealiter wordt een interval van 6 uur aangehouden, maar het is onwenselijk om de patiënt een nieuwe vaccinatieafspraak te laten maken. In deze situatie is langer afdrukken noodzakelijk: na de vaccinatie afdrukken gedurende minimaal 10 minuten, zonder te wrijven.
4.3 Allergie
De handreiking Beoordelen van een voor allergie verdachte reactie na COVID-19-vaccinatie is een hulpmiddel voor de arts bij het beoordelen of iemand een volgende COVID-19-vaccinatie mag krijgen, onder normale observatie, onder verlengde observatie of helemaal niet (contra-indicatie). Dit is op basis van (allergische) symptomen die optraden na de vorige COVID-19-vaccinatie. In geval van een contra-indicatie in verband met een mogelijke allergie moet altijd met een behandelend arts/allergoloog overlegd worden of alsnog een volgende COVID-19-vaccinatie (ongeacht merk) gegeven mag worden.
Vervolgbeleid bij verdenking allergische reactie na vaccinatie:
- Mensen met een ernstige en/of onmiddellijke voor allergie verdachte reactie op het COVID-19-vaccin kunnen door de vaccinatie-arts verwezen worden naar de huisarts.
- Indien er geen sprake is van een contra-indicatie volgens de huisarts kan de patiënt terugverwezen worden naar de GGD voor toediening van de volgende dosis. De huisarts kan patiënten die voldoen aan bovenstaande contra-indicatie ook doorverwijzen naar een allergoloog voor beoordeling. De allergoloog beoordeelt na verwijzing van de huisarts of de volgende vaccinatie kan worden toegediend bij de GGD en zo ja of daarbij extra voorzorgsmaatregelen nodig zijn, of dat een poliklinische vaccinatie geïndiceerd is.
- De GGD kan de vaccinatie alleen uitvoeren als de deelnemer een schriftelijk advies heeft van de behandelend (huis)arts/allergoloog en dit advies met documentatie kan overleggen bij de GGD. Dit traject is afgestemd met LHV, GGD GHOR Nederland en NVvAKI (Nederlandse Vereniging voor Allergologie en Klinische Immunologie).
- Als een patiënt een vaccinatie bij de allergoloog heeft gekregen zonder dat een allergische reactie is opgetreden, kan de volgende vaccinatie met identiek vaccin weer door de GGD gegeven worden. Bij een volgende vaccinatie met hetzelfde vaccin wordt niet alsnog een ernstige allergische reactie verwacht. In de brief van de allergoloog die de patiënt mee moet nemen naar de GGD of andere priklocatie, moet dit duidelijk beschreven staan, inclusief of de patiënt wel reageerde, maar met niet-allergische klachten.
Patiënten die antihistaminica als chronische onderhoudsmedicatie gebruiken (bijvoorbeeld vanwege hooikoorts), hoeven deze voor vaccinatie niet te staken. Verergering van bestaande allergieklachten door het staken ervan kan zorgen voor onduidelijkheid over de oorzaak van klachten na vaccinatie. Een antihistaminicum doorbreekt niet het mechanisme dat een anafylactische shock veroorzaakt.
Tijdens de observatieperiode van 15 minuten na de vaccinatie is het advies om bij onmiddellijk ontstane symptomen geen orale antihistaminica toe te dienen. Effect van antihistaminica oraal kan pas na meer dan een uur worden verwacht. Indien er daadwerkelijk verdenking is op een anafylactische reactie, is gebruik van een adrenalineauto-injector (bijvoorbeeld EpiPen) geïndiceerd. Toediening van adrenaline vanwege een (vermoedelijke) allergische reactie na een vaccinatie is altijd een reden voor verwijzing naar de huisarts en eventueel de allergoloog.
Langere observatie (minimaal 30 minuten in plaats van 15 minuten) wordt altijd geadviseerd bij:
- patiënten die in het verleden een of meerdere anafylactische reacties hebben gehad (ongeacht oorzaak);
- personen waarvoor de (GGD-)arts uit voorzorg, vanwege een mogelijke ernstige allergische reactie, aangeeft dat er 30 minuten moet worden geobserveerd;
- personen die een vermoede allergische reactie hebben doorgemaakt op de eerste vaccinatie, maar voor wie geen (absolute) contra-indicatie voor een tweede vaccinatie bestaat, op basis van beoordeling en advies van de allergoloog.
Vanaf de tweede helft van oktober 2021 werd gestart met het zogenaamde "allergie-traject" (zie kamerbrief september 2021). De relevante verwijzers en uitvoerders zijn hierover geïnformeerd en het is afgestemd met LHV, GGD GHOR Nederland en NVvAKI. Vanaf 2022 is deze regeling door de minister niet verlengd en daarmee valt de verwijzing van huisarts naar allergoloog onder de gebruikelijke regels die gelden voor de verdenking op een mogelijke medicatie gerelateerde allergie; vergoeding verloopt via de zorgverzekering, en voor de patiënt zijn er vanaf 2022 mogelijk kosten vanwege het eigen risico.
4.4 Relatieve contra-indicaties
Bij relatieve contra-indicaties moet overwogen worden waar op dat moment het grootste risico ligt: bij de vaccinatie of bij de door deze vaccinatie te voorkomen ziekte. Het kan een tijdelijke contra-indicatie zijn en een reden om de vaccinatie uit te stellen of om extra voorzorgsmaatregelen te nemen.
In deze paragraaf worden de volgende relatieve contra-indicaties besproken:
- anesthesie;
- bloed- en plasmaproducten;
- epilepsie;
- koorts;
- myocarditis en pericarditis;
- TTS (trombose met trombocytopeniesyndroom);
- fillers;
- allergie en specifieke subcutane immunotherapie (desensibilisatietherapie).
Anesthesie
Een geplande medische ingreep onder volledige anesthesie kan een reden zijn om een vaccinatie uit te stellen. Vaak wordt een interval van minimaal 48 uur tussen geïnactiveerd vaccin of vaccin zonder levend viraal materiaal en anesthesie gehanteerd. In geval van een medische ingreep onder anesthesie kan het beste bij het ziekenhuis geïnformeerd worden welk interval daar gehanteerd wordt. Ná de medische ingreep hoeft geen interval gehanteerd te worden. Ook als er in verband met de ingreep regulier plasma of immunoglobuline is toegediend, wordt bij vaccinatie met het COVID-19-vaccin geen interval aangehouden.
Dit minimale interval van 48 uur tussen vaccin zonder levend viraal materiaal en anesthesie wordt geadviseerd om de volgende redenen:
- De mogelijke bijwerkingen van de vaccinatie zijn dan meestal over de piek of verdwenen, waardoor er geen verwarring op kan treden met eventuele pre- of postoperatieve complicaties. Tevens wordt de kans beperkt dat door bijwerkingen de ingreep moet worden uitgesteld.
- Het is prettiger om geen anesthesie en medische ingreep te ondergaan tijdens een periode waarin iemand zich niet lekker voelt door mogelijke vaccinatiebijwerkingen.
Bloed- en plasmaproducten
Na toediening van gewone bloedproducten en plasmaproducten, anders dan plasma met COVID-19-antistoffen of monoklonale antistoffen, wordt geen interval geadviseerd.
Epilepsie
Bij sommige patiënten met epilepsie kan een vaccinatie of koorts na vaccinatie een convulsie uitlokken. De meerderheid van deze patiënten heeft van zijn of haar behandelaar een protocol wat te doen als dit optreedt. Echter, personen die behandeld worden met anti-epileptica, bekend zijn met het krijgen van herhaalde convulsies na vaccinatie of koorts, én die van hun neuroloog geen protocol hebben voor wat zij moeten doen bij koorts, stress of vaccinatie moeten eerst contact opnemen met hun behandelaar. Bij deze patiënten kan de vaccinatie gepland worden als ze hun behandelaar geconsulteerd hebben over instructies rond het vaccinatiemoment.
Alle overige patiëntengroepen hebben ofwel een dermate laag of afwezig risico (bijvoorbeeld eenmalige koortsconvulsie op kinderleeftijd) ofwel ze zijn vanwege het risico al goed geïnstrueerd. Bij deze patiëntengroepen kan op reguliere wijze een vaccinatiemoment gepland worden.
Koorts
Als een persoon te ziek is, kan een vaccinatie beter uitgesteld worden om verwarring tussen ziekteverschijnselen en bijwerkingen te voorkomen. Koorts is daarvoor een graadmeter. Bij een temperatuur van 38°C of hoger wordt de vaccinatie uitgesteld.
Myocarditis en pericarditis
Myocarditis en pericarditis zijn zeldzame bijwerkingen van de coronavaccins van Pfizer/BioNTech (Comirnaty), Moderna (Spikevax) en Novavax (Nuvaxovid). Zie paragraaf 10.2 voor meer informatie.
Post-vaccinatie-myocarditis en -pericarditis zijn relatieve contra-indicaties en kunnen een reden zijn om een vervolgvaccinatie uit te stellen of ervan af te zien. Het advies is daarom om met de behandelend cardioloog te overleggen over vervolgvaccinatie en een langer interval aan te houden voor het toedienen van een vervolgvaccinatie. Met name in het geval van een ernstige myocarditis dient een afweging of risico-batenanalyse gemaakt te worden in overleg met de behandelend cardioloog om wel of niet een vervolg vaccinatie toe te dienen. Eventueel kan op individueel niveau besloten worden om een niet-mRNA-vaccin te geven als vervolg, hoewel van Novavax (Nuvaxovid) ook is vastgesteld dat er een risico is op post-vaccinatie-myocarditis en -pericarditis (Saint-Gerons 2023). Engelse richtlijnen adviseren na herstel van myocarditis en pericarditis minimaal 3 maanden (12 weken) te wachten voordat een volgend mRNA-vaccin wordt gegeven (GOV.UK 2023). Ook de Amerikaanse richtlijnen adviseren met vervolgvaccinatie te wachten tot herstel van myocarditis of pericarditis en de noodzaak van een boosterdoses te heroverwegen (CDC 2023).
TTS (trombose met trombocytopeniesyndroom) of VITT (vaccine-induced immune thrombotic thrombocytopenia)
TTS, een combinatie van uitgebreide trombose en een laag aantal bloedplaatjes, is een zeldzame bijwerking van de vaccins Vaxzevria (AstraZeneca) en Jcovden (Janssen). Vaxzevria en Jcovden zijn respectievelijk per 1 november 2021 en per 31 juli 2023 niet langer beschikbaar in het COVID-19-vaccinatieprogramma. Na vaccinatie met een mRNA-vaccin is TTS (VITT) zeer zelden beschreven (Sangli 2021, Welsh 2021, Iba 2022, See 2022).
Cosmetische behandeling met zogenaamde fillers
Bij mensen die een behandeling met fillers krijgen of die een behandeling met fillers hebben ondergaan, kan een overgevoeligheidsreactie optreden na COVID-19 vaccinatie. Zie paragraaf 10.2 voor meer informatie. De Nederlandse Vereniging Cosmetische Geneeskunde (NVCG) heeft haar leden geadviseerd om geen fillerbehandeling uit te voeren in een periode van 2 weken vóór tot 2 weken ná COVID-19-vaccinatie. De medewerker die de COVID-19 vaccinatie toedient, hoeft een behandeling met fillers niet na te vragen. De genoemde klachten op de plaats van de fillers zijn vooral jeuk, roodheid, zwelling en pijn. De overgevoeligheidsreacties vormen doorgaans geen belemmering voor een eventuele vervolgvaccinatie, aangezien ze meestal kort duren en goed te behandelen zijn.
Allergie en specifieke subcutane immunotherapie (desensibilisatietherapie)
In principe wordt er bij allergeen-specifieke subcutane immunotherapie (SCIT) een interval aangehouden van 7 dagen tussen een sc-injectie met allergeenextract (boompollen, graspollen, huisstofmijten, wespengif, bijengif) en een vaccinatie. Bewijs of dit nodig is ontbreekt. Als iemand kort van tevoren gevaccineerd is, is de kans op bijwerkingen op SCIT theoretisch verhoogd, maar het is meestal wel mogelijk de SCIT 7 dagen uit te stellen. Als iemand SCIT gehad heeft, wordt een interval van 7 dagen gehanteerd met de vaccinatie, tenzij het echt niet anders kan. De behandelaar die de desensibilisatietherapie uitvoert, wijst de patiënt hierop en waarborgt dit interval; het is daarom niet nodig om het op te nemen in de gezondheidsvragenlijst van het COVID-19-vaccinatieprogramma.
4.5 Geen contra-indicaties
Reacties na een vorige COVID-19-vaccinatie die geen contra-indicatie vormen:
- Bijwerkingen van het vaccin die optreden vanaf 1 dag na vaccinatie vallen onder de reactogeniciteit van het vaccin (zie bijsluiters) en hebben geen allergische oorzaak. Bijwerkingen zijn geen contra-indicatie voor een tweede vaccinatie, tenzij ze vallen onder de specifieke, ernstige bijwerkingen. Dan wordt geadviseerd met de specialist te overleggen en kan overwogen worden een ander merk vaccin toe te dienen. Dit geldt voor TTS en capillairleksyndroom na een vectorvaccin en voor myo- en pericarditis na een mRNA-vaccin (zie paragraaf 4.4).
- Forse lokale reacties na de vorige COVID-19-vaccinatie: zwelling >10 cm en meestal maximaal >12 uur na toedienen (Blumenthal 2021).
- Lokale huidreacties ter plaatste van of uitbreidend vanuit de injectieplek van de COVID-19-vaccinatie, ongeacht de tijd na toedienen. Het betreft hier een niet-allergische overgevoeligheid zonder risico op ernstig reageren bij een volgende toediening. Dergelijke reacties komen geregeld voor en worden het vaakst gemeld na toediening van Spikevax (Moderna), waarbij ze pas meerdere dagen na vaccinatie ontstaan (Devon 2021).
- Milde lokale/regionale huidreacties – ongeacht tijd na toediening van vaccin, door een huisarts als (mogelijk) allergisch bestempeld, en waarvoor wel of geen antihistaminica zijn voorgeschreven – zijn geen contra-indicatie voor een volgende vaccinatie.
- Stressgerelateerde (onmiddellijke en ernstige) reacties – zoals droge mond, hartkloppingen, misselijk gevoel – zijn geen contra-indicatie. Deze reacties zijn in de praktijk soms moeilijk te onderscheiden van ernstige en onmiddellijke voor allergie verdachte reacties. De WHO-handleiding Immunization stress related responses (2019) biedt handvatten om ze onderling te onderscheiden (met name Table 4.1; zie onderstaand).
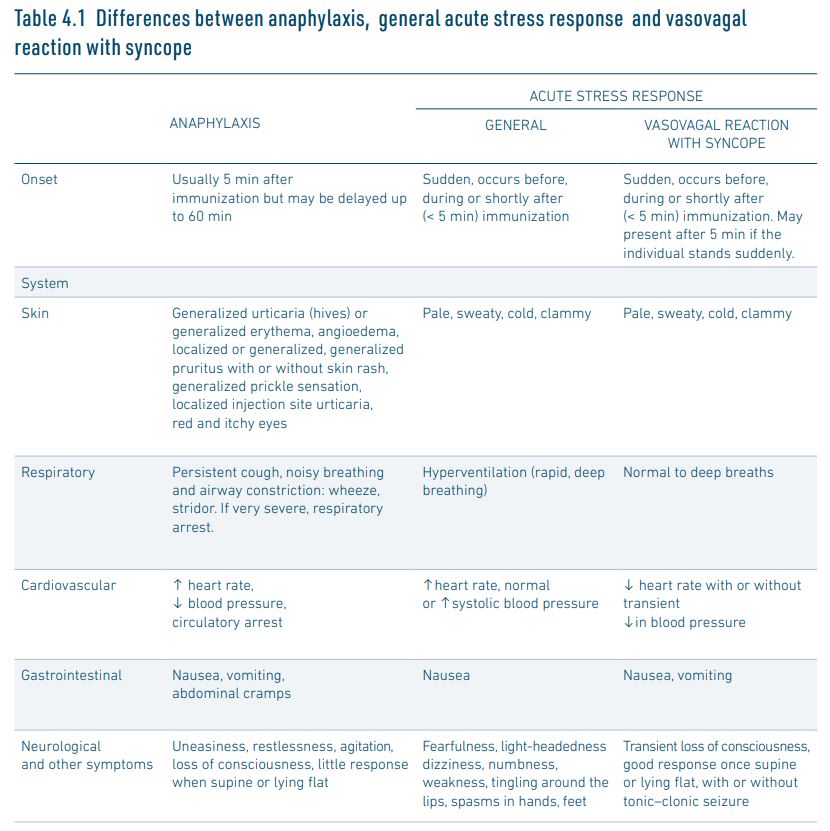
In de volgende situaties is er geen contra-indicatie voor vaccinatie:
- Anafylactische reactie na een ander vaccin dan een COVID-19-vaccin, een insectensteek, een voedingsmiddel (inclusief allergie voor kippenei) of een geneesmiddel is geen contra-indicatie. Meerdere anafylactische reacties in het verleden zijn wel een reden voor een verlengde observatieperiode na de vaccinatie van minimaal 30 minuten (zie paragraaf 4.3).
- Antibioticagebruik
- Asplenie
- Astma, eczeem, allergie (tenzij het een allergie betreft voor een bestanddeel van het vaccin).
- Auto-immuunziekten
- Borstvoeding
- Chronische aandoeningen
- Hartafwijkingen zijn geen contra-indicatie, maar juist een extra indicatie voor vaccinatie vanwege een verhoogd risico op ernstige COVID-19 bij cardiovasculaire aandoeningen. Myo- en pericarditis na een mRNA-vaccinatie zijn geen absolute contra-indicatie (zie paragraaf 4.4).
- Kippeneiwitallergie
- Ondervoeding. Geen enkele voedingstoestand is een contra-indicatie op zich.
- Post-COVID. De wetenschappelijke kennis over het effect van vaccinatie op long-COVID-symptomen is beperkt en daarom is het advies aan long-COVID-patiënten die twijfelen over vaccinatie om te overleggen met de behandelend arts. De behandelend arts kan helpen bij de individuele afweging voor het halen van een COVID-19-vaccinatie.
- Stabiele neurologische aandoeningen of convulsies in de familie.
- Stofwisselingsstoornissen
- Trombose zonder trombocytopenie:
- Trombose in de voorgeschiedenis: alle COVID-19-vaccins kunnen worden toegediend.
- Trombose binnen 6 weken na een vectorvaccin (Vaxzevria van AstraZeneca of Jcovden van Janssen): pas als TTS is uitgesloten met gerichte diagnostiek, kan een volgende COVID-19-vaccinatie worden toegediend. NB. Als TTS is vastgesteld kan in overleg met specialist een mRNA-vaccin overwogen worden. Tot nu toe is er geen verhoogde incidentie van TTS gezien na mRNA-vaccins.
- Trombocytopenie zonder trombose:
- Trombocytopenie in de voorgeschiedenis: zie paragraaf 4.2 over stollingsstoornissen of (en onder welke voorwaarden) gevaccineerd kan worden. Voor alle merken COVID-19-vaccin geldt hetzelfde beleid.
- Trombocytopenie binnen 6 weken na COVID-19-vaccinatie: pas als TTS is uitgesloten met gerichte diagnostiek, kan een volgende COVID-19-vaccinatie worden toegediend, met inachtneming van de voorwaarden in de tabel over stollingsstoornissen in paragraaf 4.2. NB. Als TTS is vastgesteld kan in overleg met de specialist een mRNA-vaccin overwogen worden. Tot nu toe is er geen verhoogde incidentie van TTS gezien na mRNA-vaccins.
- Zwangerschap: personen die zwanger zijn, kunnen tijdens de zwangerschap veilig met een mRNA-vaccin (Comirnaty van Pfizer/BioNTech) worden gevaccineerd. Zie hoofdstuk 3 voor meer informatie.
- Bij onderstaande drie aandoeningen kan vaccinatie soms een opvlamming geven van de aandoening. Deze aandoeningen zijn geen contra-indicatie voor vaccinatie. De reactie wordt geremd door de onderhoudsmedicatie die patiënten gebruiken. Daarom is het belangrijk dat de patiënten de profylactische medicijnen (veelal antihistaminica) doorgebruiken en niet stoppen voor de vaccinatie. Het gaat om:
- chronische spontane urticaria en chronische induceerbare urticaria;
- idiopathisch angio-oedeem, medicatie-gerelateerd (ACE-remmer) gerelateerd angio-oedeem en hereditair angio-oedeem;
- mastocytose en mestcelactivatiesyndroom.
5. Vaccineffectiviteit
In dit hoofdstuk komt de vaccineffectiviteit tegen een SARS-CoV-2 infectie, ernstige ziekte, transmissie en post-COVID aanbod. Let op: deze informatie is aan verandering onderhevig. Voor een overzicht, zie International Vaccine Access Center.
5.1 Bescherming tegen infectie
In verschillende studies nam de effectiviteit tegen SARS-CoV-2-infectie en symptomatische COVID-19 in de 6 maanden na vaccinatie met Comirnaty (Pfizer/BioNTech), Jcovden (Janssen), Spikevax (Moderna) of Vaxzevria (AstraZeneca) met ongeveer 20-30 procentpunt af (Feikin 2022).
De Nederlandse Vaccinstudie Corona (VASCO) onderzoekt de langetermijneffectiviteit van de coronavaccins onder de Nederlandse bevolking op basis van vragenlijsten en bloedtesten via een vingerprik. In VASCO is de vaccineffectiviteit van het XBB.1.5 vaccin geschat tegen zelf-gerapporteerde SARS-CoV-2-infectie(s) in de periode oktober 2023 tot januari 2024 bij mensen die eerder de primaire vaccinatiereeks (basisserie) en ten minste één boostervaccinatie ontvingen. In deelnemers van 60 jaar en ouder was de vaccineffectiviteit tegen infectie 51% (Huiberts 2024). De VE verschilde niet tussen deelnemers die eerder wel of niet een infectie door hadden gemaakt. Wel hadden deelnemers die minder dan één jaar geleden een infectie door hadden gemaakt (en niet gevaccineerd waren met het XBB.1.5 vaccin) minder kans op een nieuwe infectie dan deelnemers die geen of langer geleden een infectie hadden doorgemaakt (bescherming van 71-89% ten opzichte van deelnemers zonder eerdere infectie). In deelnemers van 18-59 jaar die zorgverlener waren of tot een medische risicogroep behoorden (en daardoor in aanmerking kwamen voor vaccinatie met het XBB.1.5 vaccin) was de vaccineffectiviteit 37%. Ook in deze groep beschermde een eerdere infectie minder dan één jaar geleden relatief goed tegen een nieuwe infectie (58-88%).
5.2 Bescherming tegen ernstige ziekte
In verschillende studies bleef de effectiviteit tegen ernstige ziekte (ziekenhuisopname of overlijden), in tegenstelling tot tegen infectie, hoog en nam slechts in beperkte mate af in de 6 maanden na vaccinatie (Feikin 2022). Het RIVM monitort de relatieve vaccineffectiviteit tegen ziekenhuis- en IC-opnames als gevolg van COVID-19. Rapporten zijn te vinden op deze RIVM-webpagina.
5.3 Bescherming tegen transmissie
Vaccinatie kan de besmettelijkheid verlagen (in geval van infectie), hoewel dit effect waarschijnlijk gering is en bovendien tijdelijk (zie ook het 2e OMT-V-advies). De Gezondheidsraad benoemt in zijn advies d.d. 28 juni 2023 dat ondanks de mindere werking van neutraliserende antistoffen van vaccinatie tegen omikron(sub)variant(en) er – zeker bij hybride immuniteit – ook een effect op de overdracht (transmissie) van het virus te verwachten is.
5.4 Bescherming tegen post-COVID
Een deel van de personen houdt persisterende gezondheidsklachten na het doormaken van een SARS-CoV-2-infectie. Dit wordt gedefinieerd als post-COVID maar ook frequent long-COVID genoemd. Zie voor informatie over de bescherming van vaccinatie tegen post-COVID het achtergronddocument opgesteld vanuit het CIb voor de Gezondheidsraad (COVID-19-vaccinatie. Achtergrondinformatie voor de Gezondheidsraad | RIVM). Vaccinatie geeft een lagere kans op het optreden van post-COVID klachten, maar de kans op post-COVID blijft ook na vaccinatie bestaan. Verder lijkt vaccinatie de klachten en het ziektebeloop bij reeds bestaande post-COVID vaak niet duidelijk positief of negatief te beïnvloeden.
Recent onderzoek laat zien dat het risico op post-COVID in tijden van de omikronvariant lager is vergeleken met het pre-omikrontijdperk (Antonelli 2022, de Bruijn 2023, Hernández-Aceituno 2023).
6. Specifieke informatie per vaccin
6.1 Beschikbare vaccins
Op dit moment is Comirnaty XBB.1.5 (vaccin van Pfizer/BioNTech) in Nederland beschikbaar in het COVID-19-vaccinatieprogramma. Dit vaccin is door het EMA en het CBG goedgekeurd.
In paragraaf 2.1 staat een overzicht van de beschikbare COVID-19-vaccins per leeftijdsgroep.
In eerdere vaccinatierondes zijn ook de vaccins Vaxzevria (AstraZeneca), Spikevax (Moderna) en Jcovden (Janssen). Vaxzevria, Spikevax en Jcovden zijn respectievelijk per 1 november 2021, per 17 april 2023 en per 31 juli 2023 niet langer beschikbaar in het COVID-19-vaccinatieprogramma.
Zie voor het klaarmaken van de vaccins de poster Coronavaccinatie spuit- en naaldcombinaties. Met de QR-code op de poster komt men direct bij de webpagina met links naar de verschillende werkinstructies klaarmaken vaccin. Het is van belang om de instructies goed te volgen en de voorgeschreven spuiten en naalden te gebruiken. NB Op de poster Coronavaccinatie spuit- en naaldcombinaties staat Nuvaxovid XBB.1.5 nog genoemd. Nuvaxovid XBB.1.5 is vanaf 1 juli 2024 niet meer beschikbaar in het COVID-19-vaccinatieprogramma.
6.2 Comirnaty Omicron XBB.1.5 (Pfizer/BioNTech)
Comirnaty, het vaccin van Pfizer/BioNTech, is een COVID-19-mRNA-vaccin. Het bevat raxtozinameran (mRNA van SARS-CoV-2) ingebed in lipidenanodeeltjes. Het vaccin bevat geen levend viraal materiaal. Het mRNA codeert voor het spike-eiwit van het virus (SmPC).
Toedieningsleeftijd en dosering
Voor verschillende leeftijdsgroepen zijn verschillende doseringen beschikbaar.
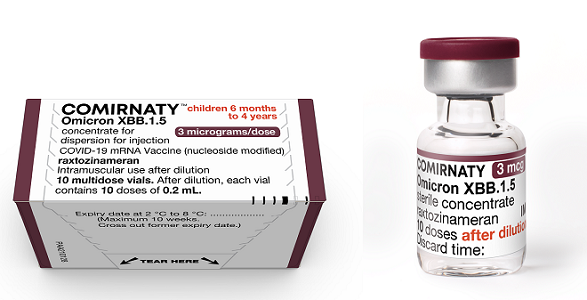
- Voor kinderen van 6 maanden tot en met 4 jaar: Eén dosis van 0,2 ml bevat 3 microgram raxtozinameran; deze multidoses flacon heeft een bruine dop.
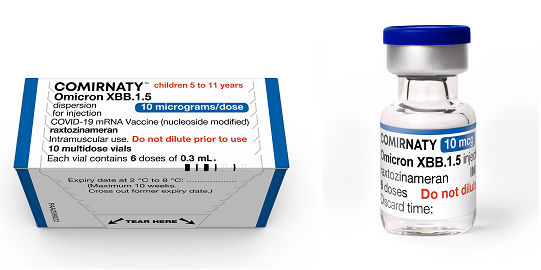
- Voor kinderen van 5 tot en met 11 jaar: Eén dosis van 0,3 ml bevat 10 microgram raxtozinameran; deze multidoses flacon heeft een blauwe dop.
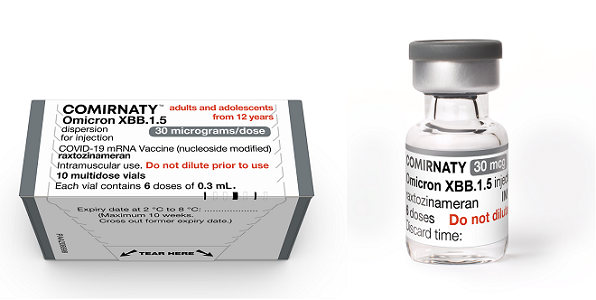
- Voor personen vanaf 12 jaar: Eén dosis van 0,3 ml bevat 30 microgram raxtozinameran; deze multidoses flacon heeft een grijze dop.
Voor kinderen is de dosering afhankelijk van de leeftijd, en onafhankelijk van het gewicht (zie ook de SmPC).
Vaccinatieschema
Zie paragraaf 2.1 en paragraaf 2.2.
Contra-indicaties
Zie paragraaf 4.1, paragraaf 4.3 en hoofdstuk 10.
Voor de relatieve contra-indicaties, zoals o.m. myocarditis en pericarditis na vaccinatie, zie paragraaf 4.4.
Bijwerkingen
De meeste bijwerkingen zijn binnen 1-2 dagen verdwenen. Als pijn of koorts toch heftig is, kan hiervoor paracetamol worden ingenomen. Zie de bijsluiter.
Meer informatie over bijwerkingen en het melden ervan staat in hoofdstuk 10.
Verpakking oplosvloeistof voor Comirnaty-vaccins
Het RIVM heeft oplosvloeistof van 2 verschillende merken ingekocht: Centrafarm (bijsluiter RVG 50825) en Fresenius Kabi (bijsluiter RVG 57789 of Portugese registratie). De oplosvloeistof bevat per ml 9 mg natriumchloride, is verpakt in ampullen van 5 of 10 ml, en wordt los bijgeleverd.
Gereedmaken van vaccin en toediening
Comirnaty Omicron XBB.1.5 wordt intramusculair (i.m.) toegediend in de bovenarm (m. deltoïdeus). Als er niet in de bovenarm gevaccineerd kan worden, bijvoorbeeld bij jonge kinderen, wordt de vaccinatie in het bovenbeen toegediend (m. vastus lateralis). Onder de 1 jaar wordt het vaccin toegediend in het dijbeen. Zie hoofdstuk 7 voor informatie over de toediening.
Voor het gereedmaken van beschikbare vaccins zijn specifieke instructies beschikbaar:
- Klaarmaken Comirnaty XBB.1.5 (Pfizer/BioNTech) met SJJ – spuit en –naald voor 6 maanden t/m 4 jaar.
- Klaarmaken Comirnaty XBB.1.5 (Pfizer/BioNTech) met Sol-M spuit en BD Eclipse naald voor 5 t/m 11 jaar.
- Klaarmaken Comirnaty XBB.1.5 (Pfizer/BioNTech) met Sol-M spuit en BD Eclipse naald voor 12 jaar en ouder.
Verpakking Comirnaty 3 µg voor 6 maanden t/m 4 jaar (bruine dop)
Het Comirnaty-concentraat wordt geleverd in een multidoses glazen vaccinflacon van 2 ml groot voor het gereedmaken van ten minste 10 doses vaccin. Er zitten 10 vaccinflacons in 1 verpakking. De dop van de vaccinflacon is bruin. Eén vaccinflacon bevat 0,4 ml bevroren vaccin. De bevroren vloeistof is wit/gebroken wit van kleur. Het vaccin wordt ontdooid geleverd aan de uitvoerende organisatie.
Het vaccin moet worden opgelost (zie werkinstructie).
Verpakking Comirnaty 10 µg voor 5 t/m 11 jaar (blauwe dop)
Het kant-en-klaar vaccin Comirnaty Omicron XBB.1.5 wordt geleverd in een multidoses glazen vaccinflacon van 2,25 ml groot voor het gereedmaken van ten minste 6 doses vaccin van 0,3 ml. Er zitten 10 vaccinflacons in 1 verpakking. De dop van de vaccinflacon is blauw. Eén vaccinflacon bevat 2,25 ml bevroren vaccin. De bevroren vloeistof is wit/gebroken wit van kleur. Het vaccin wordt ontdooid geleverd aan de uitvoerende organisatie.
Aan de vaccinflacon moet geen oplosvloeistof worden toegevoegd.
Verpakking Comirnaty 30 µg voor 12 jaar en ouder (grijze dop)
Het kant-en-klaar vaccin Comirnaty Omicron XBB.1.5 wordt geleverd in een multidoses glazen vaccinflacon van 2,25 ml groot voor het gereedmaken van ten minste 6 doses vaccin van 0,3 ml. Er zitten 10 vaccinflacons in 1 verpakking. De dop en de kleuring op het label op de flacon zijn grijs. Een vaccinflacon bevat 2,25 ml bevroren vaccin. De dispersie is wit tot gebroken wit van kleur. Het vaccin wordt ontdooid geleverd aan de uitvoerende organisatie.
Aan de vaccinflacon moet geen oplosvloeistof worden toegevoegd.
Temperatuur, houdbaarheid en expiratiedatum
Zie de tabellen 6.2a en 6.2b met informatie voor vaccins voor kinderen van 6 maanden t/m 4 jaar (bruine dop), voor kinderen van 5 t/m 11 jaar (blauwe dop) en personen van 12 jaar en ouder (grijze dop). De informatie is gebaseerd op de SmPC en informatie van de fabrikant, en kan door voortschrijdend inzicht aangepast worden.
| Houdbaarheid Comirnaty XBB.1.5 |
<2°C | 2-8°C | 8-30°C |
|---|---|---|---|
|
Vaccinflacon onaangebroken |
Cold chain-incident: zie ** | Tot de “te gebruiken datum en tijd” – maximaal 10 weken na verwijdering uit de vriezer (staat vermeld op de verpakking) | 24 uur Let op: binnen deze 24 uur mag de flacon maximaal 8 uur na aanprikken of in opgetrokken spuit worden gebruikt. |
|
Opgelost vaccin in vaccinflacon |
Cold chain-incident: zie ** | 8 uur na moment toevoegen oplosvloeistof*** |
8 uur na moment toevoegen oplosvloeistof*** |
|
Vaccin opgetrokken in spuit |
Cold chain-incident: zie ** | Zo spoedig mogelijk gebruiken (uiterlijk binnen 8 uur na moment toevoegen oplosvloeistof***) | Zo spoedig mogelijk gebruiken (uiterlijk binnen 8 uur na moment toevoegen oplosvloeistof***) |
| Transport* Comirnaty XBB.1.5 |
<2°C | 2-8°C | 8-30°C |
|---|---|---|---|
|
Auto, fiets of lopend Alleen toegestaan voor onaangebroken vaccinflacons |
Cold chain-incident: zie ** | Geen beperking, afgezien van de “te gebruiken datum en tijd” – maximaal 10 weken na verwijdering uit de vriezer (staat vermeld op de verpakking) | Cold chain-incident: zie ** |
|
Auto, fiets of lopend Opgelost vaccin in vaccinflacon (ook na onttrekking 1 of meerdere doses) (vervoeren zonder optreknaald) of vaccin opgetrokken in spuit |
Transport per auto of fiets niet mogelijk | Zo kort mogelijk, maximaal 6 uur transport. LET OP: het vaccin uiterlijk binnen 8 uur na toevoegen oplosvloeistof toedienen*** |
Zo kort mogelijk, maximaal 6 uur transport. LET OP: het vaccin uiterlijk binnen 8 uur na toevoegen oplosvloeistof toedienen*** |
* Altijd goed inpakken (rechtop) en beschermen tegen overmatig schudden. Instructies “goed vaccinbeheer” in acht nemen (zie document Goed vaccinbeheer).
** Bij een mogelijke afwijking van de temperatuur en bij andere incidenten waarbij het vaccin betrokken is geweest (bijvoorbeeld te lang gewacht met toedienen), moet de uitvoerende organisatie direct telefonisch contact op nemen met RIVM-DVP/LCC via telefoonnummer 088-689 8900. Zie paragraaf 8.2.
*** De houdbaarheid van een aangeprikte flacon is conform de GMP-z vanuit microbiologisch oogpunt 8 uur en dus niet overeenkomstig de 12 uur die in de SmPC vermeld staat.
Uit de koelkast gehaald onaangebroken vaccin mag alleen teruggeplaatst worden in de koelkast als op de flacon te herleiden is hoe lang het nog te gebruiken is bij kamertemperatuur (24 uur minus de duur reeds buiten de koelkast). De maximale houdbaarheid bij 2-8°C blijft ongewijzigd.
Het vaccin is bij de logistiek dienstverlener bij -90°C tot -60°C opgeslagen en wordt kort voor levering ontdooid. Op dat moment gaat de periode van 10 weken (70 dagen) lopen. Als het vaccin is geleverd aan de uitvoerende organisatie, is per verpakking aangegeven vóór welk tijdstip de vaccins gebruikt moeten worden, indien bewaard bij 2-8°C.
Na verdunning moet het vaccin in de toedieningsspuit zo snel mogelijk worden toegediend. In uitzonderingssituaties kan, na verdunnen, het vaccin maximaal 8 uur in de toedieningsspuit worden bewaard bij 2°C tot 30°C. De fysische en chemische stabiliteit van het verdunde vaccin in (plastic) doseerspuiten is vergelijkbaar met de stabiliteit in de (glazen) flacon gedurende 8 uur bij 2°C tot 30°C. Eenmaal verdund mag het vaccin binnen deze 8 uur voor maximaal 6 uur op transport (al dan niet opgetrokken in een spuit).
7. Vaccinatietechniek
In dit hoofdstuk staan algemene aandachtspunten en toedieningstechnieken beschreven die bij alle vaccins gelden.
7.1 Aandachtspunten bij het vaccineren
Handhygiëne bij het vaccineren
Handen zijn een belangrijke schakel in de overdracht van micro-organismen. Handen moeten visueel schoon zijn, vrij van sieraden en horloges, de nagels kortgeknipt en geen gebruik van kunstnagels. De polsen moeten vrij zijn van bedekkende kleding. Met handhygiëne wordt bedoeld: de handen wassen met water en zeep of desinfecteren met handalcohol.
Het is niet nodig om voor elke afzonderlijke vaccinatie handhygiëne toe te passen, maar wel op de volgende momenten (Burgmeijer & Hoppenbrouwers 2011, de Groot 2014):
- voor aanvang van de vaccinatiespreekuren;
- na pauzemomenten;
- na hoesten, niezen en neus snuiten;
- na toiletbezoek;
- voor en na het eten en drinken;
- na contact met lichaamsvloeistoffen of uitscheidingsproducten;
- bij zichtbaar vuil (zie ook de Hygiënerichtlijn voor de jeugdgezondheidszorg).
Mondneusmaskers
Voor gebruik mondneusmakers voor personeel, zie de Uitgangspunten PBM bij verzorging, verpleging of medische behandelingen buiten het ziekenhuis. Het staat bezoekers van vaccinatielocaties vrij om een mondneusmasker te gebruiken.
Administratie
Administratie is een essentieel onderdeel van de vaccinatie. Alleen bij een zorgvuldige registratie kunnen in het geval van een incident adequate maatregelen genomen worden. Het verdient de voorkeur om vóór het toedienen van de vaccinatie de registratie af te handelen. Zo voorkomt men dat er onterecht gevaccineerd wordt. Voor (centrale) registratie, zie paragraaf 11.4.
Temperatuur en houdbaarheid
Bewaarcondities en houdbaarheid verschillen per product en staan in hoofdstuk 6 beschreven.
Expiratiedatum
De expiratiedatum geeft het laatste tijdstip, dag of maand aan dat het vaccin mag worden gegeven. Indien het vaccin per ongeluk toch na dit tijdstip is toegediend, wordt een nieuwe vaccinatie aangeboden omdat de werkzaamheid niet meer te garanderen is. Dit wordt in het dossier genoteerd. Als de deelnemer geen nieuwe vaccinatie wenst, wordt dit ook in het dossier genoteerd. Indien gewenst kan over bovenstaande ook worden overlegd met het RIVM: 088-689 8900.
Bijsluiters
De bijsluiters zijn gepubliceerd door het CBG. De SmPC is gepubliceerd door het EMA. Zie hoofdstuk 6 voor de diverse linken naar de teksten.
Vaccinflacons
Het flip-off-kapje beschermt de rubberen afsluitdop. Deze afsluitdop voorkomt contaminatie en zorgt voor het behoud van de steriliteit. Zolang er niet in het flesje is geprikt, is de inhoud steriel. Omdat op het oog niet te zien is of er in het flesje is geprikt, moet diegene die het flip-off-kapje heeft verwijderd er persoonlijk voor zorgdragen dat het flesje bij de eerstvolgende gelegenheid wordt gebruikt. Nadat een flacon is aangeprikt, kan de steriliteit van dit product niet lang worden gegarandeerd en moet de flacon zo spoedig mogelijk en uiterlijk binnen een aantal uur gebruikt worden. Vaccinflacons van Comirnaty (Pfizer/BioNTech) die zijn aangeprikt en al dan niet met oplosvloeistof zijn gemengd, moeten binnen 6 uur worden gebruikt.
Spuiten en naalden
RIVM-DVP/LCC levert zowel injectiespuiten (1 ml en 3 ml) als naalden voor klaarmaken van het vaccin (blunt needle) en toediening (veiligenaaldsystemen of reguliere naalden). Zie bijlage 3 Beschikbare spuiten en naalden.
Voor het doorprikken van het rubberdopje van de vaccinflacon is een injectienaald 18G geleverd (1,2 x 40 mm). Er kan wel eens een ponsje van de rubberen dop in de vloeistof gezien worden. Dat heeft geen invloed op de kwaliteit van het vaccin.
In het Arbeidsomstandigheden (Arbo)-besluit is het gebruik van veiligenaaldsystemen opgenomen. De veiligenaaldsystemen zijn geschikt voor toediening van COVID-19-vaccins. Vanwege het lage toedieningsvolume voor Comirnaty XBB.1.5 6 maanden t/m 4 jaar (bruine dop) zal het RIVM reguliere naalden verstrekken. Vaccineren met reguliere naalden dient in de procedures en werkwijze van uitvoeringsorganisaties opgenomen te zijn.
De naald die geleverd wordt, is 25 mm lang. Dit zijn standaardnaalden voor intramusculaire vaccinatie en de meeste kinderen, jongeren en volwassenen kunnen hiermee gevaccineerd worden. Intramusculair vaccineren is een voorwaarde om het vaccin effectief te laten zijn. Subcutane injecties moeten worden vermeden. Bij de juiste vaccinatietechniek (zie paragraaf 7.2) lukt het meestal om i.m. te vaccineren met een 25 mm-naald.
Bij ernstige obesitas, in het geval van een te dikke subcutane vetlaag, kan het nodig zijn om een langere naald te gebruiken. Indien er bij klinische beoordeling twijfel is of er sprake is van een te dikke subcutane vetlaag kan dit op de volgende manier gecontroleerd worden: pak de huidplooi tussen duim en wijsvinger en beoordeel de dikte: als de naald korter is dan de helft van de huidplooi, dan moet je een langere naald nemen. Daarnaast kan op basis van gewicht of BMI bij de volgende waarden overwogen worden om met een langere naald (38 mm) te vaccineren:
- Gewicht: bij vrouwen met een gewicht >90 kg; bij mannen met een gewicht >118 kg;
of - BMI >40.
Bij het selecteren van een spuit-/naaldcombinatie is het van belang om te bepalen of het toegediende volume overeenkomt met de voorgeschreven dosering. Om technische redenen kan daar een verschil in bestaan. Een afwijking van ±10% tussen het toegediende volume en de dosering wordt als acceptabele marge beschouwd.
Een van de oorzaken is het achterblijven van een kleine hoeveelheid vaccin in de spuit/naaldcombinatie na toediening (dood volume). Daarnaast is er in het geval van kleinere doseringen (minder dan de helft van een toedieningsspuit) sprake van relatief grotere afwijkingen van de maatverdeling van de spuit. Dit is voor de COVID-19-vaccins het geval bij de doseringen van 0,3 ml (Comirnaty) die met een 1,0 ml-spuit worden toegediend. Voor deze vaccins zijn spuit/naaldcombinaties in de uitvoeringsrichtlijn opgenomen waarvoor beoordeeld is dat de gewenste dosering wordt toegediend. Het gebruik van andere combinaties kan tot gevolg hebben dat er onjuist wordt gedoseerd. Voor varianten van de toedieningsnaald die beschikbaar zijn gesteld (BD Eclipse 23G x 1”) is op basis van gegevens van de fabrikant een beoordeling gedaan. Hieruit volgde dat met de naalden van onderstaande typen voldoende vaccin wordt toegediend in combinatie met de in het programma beschikbaar gestelde toedieningsspuit.
- BD Eclipse REF 305895: 21G x 40 mm;
- BD SafetyGlide REF 305917: 21G x 40 mm (let op: ander afschermingsmechanisme dan de Eclipse-naald);
- BD SafetyGlide REF 304387: 23G x 40 mm (let op: ander afschermingsmechanisme dan de Eclipse-naald).
Wanneer er gebruik wordt gemaakt van een andere lange naald, kan de dosering worden geborgd door gebruik te maken van een toedieningsspuit met een kleiner volume. Door een grotere vulling van de spuit neemt de afwijking af. Bij een vulling van 50% of meer (0,5 ml in het geval van een 1,0 ml-toedieningsspuit) mag worden uitgegaan van een juiste dosering, ongeacht de gebruikte naald.
Desinfectie
Het is niet nodig om huid te desinfecteren (Hutin 2003).
De rubberen dop op de vaccinflacon is steriel of in een steriele omgeving geproduceerd. Dit is bij de fabrikanten nagevraagd. Voor de rubberen dop hanteren we het volgende beleid:
- Voor eenmalig doorprikken als meteen alle doses klaargemaakt worden, hoeft de dop niet gedesinfecteerd te worden.
- Als het rubberdopje vaker doorgeprikt wordt, dan moet de dop vanaf de 2e keer iedere keer gedesinfecteerd worden.
Klaarmaken van vaccins
Het klaarmaken van het vaccin is niet meer beschreven in deze richtlijn. In de losse instructies is te lezen hoe ieder vaccin klaargemaakt moet worden. Of daarbij doortrekken van het vaccin plaatsvindt conform de instructies van lokale apothekers is aan de uitvoerende organisatie zelf om te bepalen. Er is momenteel geen schaarste van vaccins.
Bevoegde en bekwame ziekenhuisapothekers en -medewerkers mogen, met hun techniek en ervaring, doortrekken van de ene vaccinflacon naar de volgende vaccinflacon. Zij mogen vervolgens GGD-medewerkers, huisartsen of andere professionals volgens landelijk protocol van de NVZA trainen in het werken met deze techniek. Een apotheker verklaart medewerkers individueel bekwaam als “vaccinvoorbereider plus”. Vanaf dit moment mag de bekwaam verklaarde medewerker zelfstandig, zonder aanwezigheid van de apotheker, de techniek toepassen. De GGD houdt een register bij van bekwame “vaccinvoorbereiders plus”, zowel ten behoeve van de eigen organisatie als ten behoeve van de IGJ. De lokale ziekenhuisapotheek kan gevraagd worden een training te geven. Op de website van de NVZA staan de benodigde documenten.
Ontluchten van de injectiespuit
De injectiespuit moet voor de injectie worden ontlucht tot de naaldopzet. Verder ontluchten kan gepaard gaan met vaccinverlies. Zie de instructies voor het klaarmaken van de vaccins (onder Downloads bij deze richtlijn).
Aspireren
Controle op het aanprikken van een bloedvat voorafgaand aan het inspuiten van een vaccin is niet noodzakelijk. Ook bij COVID-19-vaccins is er geen aanleiding om dit te doen.
Toediening van vrijwel volledige dosis
Toediening van een (vrijwel) volledige dosis (>90%) van het vaccin is nodig. Als dat niet is toegediend, moet de vaccinatie direct worden herhaald. Dit mag in hetzelfde ledemaat. Een eventueel dubbele dosis is niet schadelijk en geeft ook niet meer bijwerkingen.
Afvalverwerking
Na toediening van het vaccin kan de naald in de naaldencontainer worden gedaan. Gebruikte spuiten kunnen zowel in de naaldencontainer als in een Wiva-vat. Dit kan per vaccinatielocatie verschillen. De spuiten moeten wel onder dezelfde condities afgevoerd worden als vaccinflacons, omdat daarin ook immunologische resten zitten. De lege vaccinflacons gaan in een Wiva-vat. Omdat er met multidoses vaccinflacons wordt gewerkt, is enige spillage aan het einde van een vaccinatiesessie niet te voorkomen, maar dit moet wel tot een minimum beperkt worden. Vaccin dat overblijft, moet na de vaccinatiesessie weggegooid worden in een Wiva-vat. Dit Wiva-vat moet voor en na de vaccinatiesessies in een afgesloten ruimte worden bewaard totdat het wordt opgehaald. Zie paragraaf 8.7 voor meer informatie.
7.2 Plaats voor injectie en toedieningstechnieken
Plaats voor injectie
Aan kinderen van 6 maanden tot 1 jaar oud, wordt de vaccinatie intramusculair gegeven in het bovenbeen.
Vanaf de leeftijd van 1 jaar wordt het vaccin intramusculair (i.m.) toegediend in de bovenarm (m. deltoïdeus). Als er niet in de bovenarm gevaccineerd kan worden, is het anterolaterale deel van het bovenbeen een alternatief (m. vastus lateralis). Indien er gelijktijdig met de COVID-19-vaccinatie een of meerdere andere vaccins worden toegediend, kunnen deze ofwel in verschillende ledematen, of met een minimale afstand van 2,5 cm in dezelfde ledemaat worden toegediend.
Juiste toediening van de vaccinatie in de bovenarm
De veilige zone voor de intramusculaire injectie van een vaccin in de schouder is weergegeven als een groene driehoek. De bovengrens van het veilige gebied ligt 2 cm (twee vingers) onder het acromion en de ondergrens ligt ter hoogte van de oksel. Te distaal of te lateraal toedienen van de vaccinatie geeft een verhoogd risico op beschadiging van respectievelijk de N. radialis of de N. axillaris. Door te proximaal te injecteren bestaat de kans dat de injectievloeistof in de bursa subacromialis of het schoudergewricht terechtkomt (van der Kraats 2022).
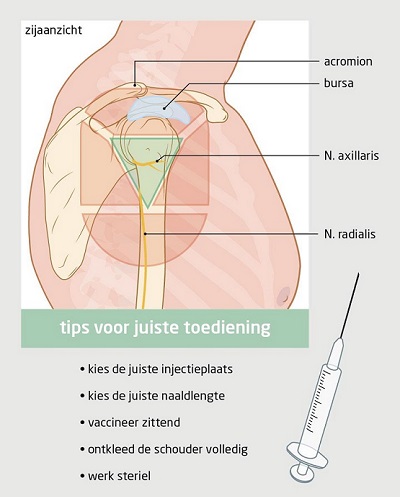
Juiste toediening van de vaccinatie in het bovenbeen (voor kinderen van 6 maanden tot 1 jaar oud)
Bij zuigelingen van 6 maanden tot 1 jaar oud is de aanbevolen plaats van injectie het anterolaterale deel van het bovenbeen (zie ook SmPC). Onderstaande afbeeldingen verduidelijken de juiste plaats voor injectie in het bovenbeen.
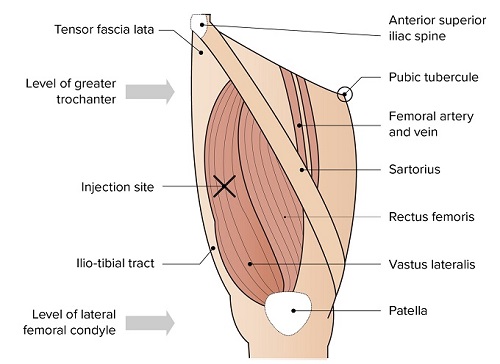
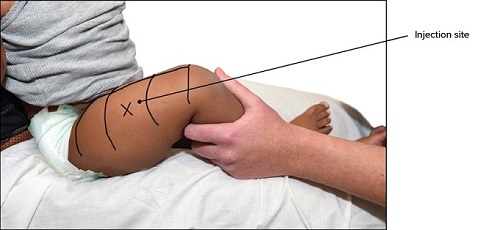
Uit: The Australian Immunisation Handbook, © 2022 Commonwealth of Australia as represented by the Department of Health (geraadpleegd op 10 januari 2023).
In de bijsluiters van de vaccins en in hoofdstuk 6 staan ook de aanbevolen injectieplaatsen per vaccin vermeld.
De techniek van de intramusculaire injectie
Het COVID-19-vaccin wordt normaliter intramusculair toegediend. Voer hierbij achtereenvolgens de volgende handelingen uit:
- Ontbloot de injectieplaats en laat knellende kleding losmaken of uittrekken.
- Fixeer de injectieplaats tussen duim en wijsvinger en trek de huid daarbij strak. Men kan er voor kiezen om tevens de huid iets ten opzichte van het onderhuidse bindweefsel te verschuiven (Z-track techniek).
- Doorsteek de huid snel en loodrecht.
- Injecteer het vaccin rustig en volledig.
- Trek de lege spuit terug met een snelle beweging.
- Plaats het beschermkapje niet meer terug op de naald.
- Bescherm de naald conform de gebruiksaanwijzing van het (veilige)naaldsysteem.
- Ontkoppel direct naald en spuit met behulp van de naaldencontainer of gooi spuit en naald als geheel in de naaldencontainer (afhankelijk van de afspraken binnen de organisatie).
- Vaccinflacon en spuit kunnen na gebruik in het Wiva-vat of alternatief (zie paragraaf 8.7).
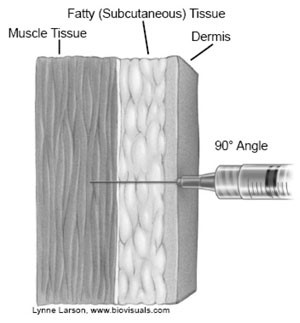
NB. Bij mensen met meer subcutaan vet lukt het meestal om met de juiste vaccinatietechniek ook i.m. te vaccineren met een 25 mm lange naald. Dan is het belangrijk om de huid strak te trekken en vervolgens voldoende door te duwen bij het prikken om de spier goed te bereiken. Bij ernstige obesitas, in het geval van een te dikke subcutane vetlaag, kan het nodig zijn om een langere naald te gebruiken. Indien er bij klinische beoordeling twijfel is of er sprake is van een te dikke subcutane vetlaag kan dit op de volgende manier gecontroleerd worden: pak de huidplooi tussen duim en wijsvinger en beoordeel de dikte: als de naald korter is dan de helft van de huidplooi, dan moet je een langere naald nemen. Daarnaast kan op basis van gewicht of BMI bij de volgende waarden overwogen worden om met een langere naald (38 mm) te vaccineren:
- Gewicht: bij vrouwen met een gewicht >90 kg; bij mannen met een gewicht >118 kg;
of - BMI >40.
Zie ook paragraaf 7.1, met een beschrijving van de aanpak bij het selecteren van een geschikte lange naald.
7.3 Aandacht voor pijnvermindering bij vaccineren
Verschillende eenvoudige interventies reduceren de pijn tijdens het vaccineren. De volgende interventies zijn in de meeste situaties toe te passen.
- Interventies betreffende de vaccinatieprocedure: laat de vaccinatieprocedure zo kort mogelijk duren.
- Psychologische interventie: vanaf de tienerleeftijd is afleiding meestal niet effectief, bij jonge kinderen wel.
- Farmacologische interventie: de huid mag lokaal verdoofd worden met lidocaïne/prilocaïne-crème, op initiatief van betreffende persoon zelf. Uit onderzoek is gebleken dat lidocaïne/prilocaïne-crème het opwekken van antistoffen (immuunrespons) van vaccins niet nadelig beïnvloedt. Voor een goede werking van het pijnstillend effect moet de crème 1 uur voor de vaccinatie op de injectieplek aangebracht worden. De crème verdooft alleen de huid en niet het onderliggende weefsel.
Afgeraden interventies
- Opwarmen van het vaccin tot kamertemperatuur geeft geen pijnvermindering en kan de effectiviteit van het vaccin negatief beïnvloeden.
- Toedienen van orale analgetica (paracetamol) voorafgaand aan de vaccinatie geeft geen pijnvermindering van de vaccinatie zelf. (Later bij pijn ná vaccinatie kan het wel effectief zijn; zie paragraaf 10.3).
Meer informatie over pijnvermindering bij vaccineren staat beschreven in de position paper van de WHO.
7.4 Fouten bij gereedmaken of toedienen van vaccin
Gereedmaken vaccin
Foutieve menging of te grote hoeveelheid vaccin
Bij het toedienen van alleen oplosvloeistof wordt de vaccinatie als niet toegediend beschouwd. Er moet alsnog een correcte vaccinatie worden toegediend. Dit kan meteen.
Als er teveel oplosvloeistof is toegevoegd en het actieve deel van het vaccin te veel verdund is, moet de vaccinatie opnieuw met de correcte menging, zodra de fout ontdekt is.
Als er geen oplosvloeistof wordt toegevoegd en er wordt onverdund 0,2 ml vaccin (afhankelijk van de leeftijd en bijbehorende dosering) toegediend, dan betreft het een overdosis. Dat is ook aan de orde als er wel is verdund, maar er is een dubbele dosis of de hele multidoses toegediend. Of als er per abuis de helft van de vereiste hoeveelheid oplosvloeistof is toegevoegd. In die gevallen kan de lokale reactie, zoals een pijnlijke arm, heftiger zijn dan normaal. Het is verder niet schadelijk, wel aanleiding tot extra zorg voor de gevaccineerde. Er dient met deze persoon een gesprek plaats te vinden waarin het volgende aan de orde komt:
- uitleg dat het in principe geen kwaad kan, maar dat het wel een zere arm zal opleveren;
- goede uitleg over gebruik van paracetamol, om de pijn in de arm te verminderen;
- wie van de uitvoerende organisatie gebeld moet worden bij onverwachte klachten;
- dat bij ernstige klachten altijd de huisarts gebeld moet worden;
- dat het gemeld moet worden bij Lareb (zie hoofdstuk 10).
Toedienen van vaccinatie
Bij de toediening loopt er een druppeltje terug
Een dosis van het vaccin betreft 0,2 ml, 0,3 ml of 0,5 ml vaccin. In de praktijk komt het voor dat er per ongeluk iets minder wordt toegediend, omdat na de toediening van vaccin wat uit het injectiegaatje loopt. Bij ieder vaccin is er wat marge en wordt er in zo’n situatie nog steeds een effectieve dosis toegediend. Er hoeft in zo’n situatie dus geen extra dosis te worden toegediend.
Toediening van te kleine hoeveelheid vaccin
Indien minder dan 90% van de aanbevolen dosis is toegediend, omdat er tijdens het vaccineren iets mis gaat, bijvoorbeeld omdat de naald niet goed op de spuit zit, dient er meteen na de onvolledige dosis nog een volledige dosis te worden toegediend.
Dosis mogelijk of gedeeltelijk subcutaan toegediend
Bij de juiste vaccinatietechniek lukt het meestal om i.m. te vaccineren met een 25 mm-naald, ook bij mensen met meer subcutaan vet (zie ook paragraaf 7.2). Als bij een vaccinatie mogelijk (deels) subcutaan is gevaccineerd, hoeft er geen extra vaccinatie te worden toegediend. Men gaat er van uit dat de vaccinatie toch (deels) heeft gewerkt (Friedensohn 2021).
Per ongeluk Comirnaty XBB.1.5 (Pfizer/BioNTech) volwassen dosering toegediend aan een kind jonger dan 12 jaar
Er is meer antigene stof toegediend dan nodig was. De vaccinatie kan daardoor meer bijwerkingen geven. Voor de werkzaamheid maakt het niet uit.
7.5 Intervallen met andere vaccins
Bij toediening van een COVID-19-vaccin hoeft geen specifiek interval gehanteerd te worden met andere vaccinaties, bijvoorbeeld vaccinatie in het kader van het Rijksvaccinatieprogramma, de griep- of pneumokokkenvaccinatie of reizigersvaccinaties. Ook het gelijktijdig toedienen van een ander vaccin kan veilig en heeft geen duidelijk invloed op de immunogeniciteit of reactogeniciteit van de vaccins
Verschillende studies hebben laten zien dat gelijktijdige toediening van COVID-19-vaccins en griepvaccins veilig kan. Er worden niet of nauwelijks meer bijwerkingen gezien. Bijwerkingen zijn mild en tijdelijk. Ook blijkt uit studies dat er een goede antistof respons tegen zowel COVID-19 als griep wordt opgewekt bij gelijktijdige toediening of toediening binnen korte tijd. De WHO/SAGE aanbevelingen omtrent COVID-19-vaccins, geven aan dat de COVID-19-vaccinatie met elk ander vaccin tegelijk mag worden toegediend (Lazarus 2021, BMJ 2021, Izikson 2022, Toback 2021, Hause 2022a, WHO 2022b, WHO 2022c, Dulfer 2023, Gonen 2023).
Een uitzondering is de toediening van een mRNA-COVID-19-vaccin aan mannen tot 40 jaar en een Imvanex®-vaccinatie tegen de Mpox. Mannen in deze leeftijdscategorie hebben een hoger risico op (peri)myocarditis na een mRNA-COVID-19-vaccin (zie paragraaf 4.4). Bij de vorige generatie pokkenvaccins (tweedegeneratie pokkenvaccin ACAM2000) is in het verleden een verhoogd risico op (peri)myocarditis gezien. Het is onbekend of Imvanex® ook een verhoogd risico geeft op (peri)myocarditis. Veiligheidshalve wordt daarom een interval van >4 weken geadviseerd tussen een mRNA-COVID-19-vaccin aan mannen tot 40 jaar en een Imvanex®-vaccin (zie ook de LCI-uitvoeringsrichtlijn Mpox-vaccinatie). Echter, bij een hoog risico op ernstige complicaties van COVID-19 of een hoog risico op Mpox, moet vaccinatie met een van beide vaccins niet worden uitgesteld (conform advies CDC). In de gezondheidsverklaring van de Mpox-vaccinatie wordt met dit interval rekening gehouden; het is daarom niet nodig om hiermee bij de uitvoering van het COVID-19-vaccinatieprogramma rekening te houden.
8. Vaccinbeheer
Vaccinvervoer en temperatuur bij vaccinopslag vragen extra aandacht, omdat de vaccins zeer kwetsbaar zijn. Bij verkeerd vaccinbeheer kan de werkzaamheid sterk afnemen.
In het document Goed vaccinbeheer is meer informatie te vinden. Het document geeft toelichting over o.a. verantwoordelijkheden van uitvoerende organisaties, gebruik van vaccins en instructies voor vaccintransport en vaccinopslag op locatie.
8.1 Opslag en levering vaccin
Voor de opslag van de vaccins in Nederland is een farmaceutisch logistiek dienstverlener ingezet die veel kennis en ervaring heeft in (fijn)distributie van vaccins. Bij deze partij is opslagcapaciteit gereserveerd voor COVID-19-vaccins, waarbij rekening gehouden is met de uiteenlopende temperatuurzones waarbij de vaccins opgeslagen moeten worden (ultra low, vries-, koel- en kamertemperatuur). Deze logistiek dienstverlener draagt ook zorg voor het leveren van vaccins en toebehoren naar de vaccinatielocaties.
8.2 Opslag vaccins en cold chain-incidenten bij de uitvoerende organisatie
Na ontdooien kan Comirnaty (Pfizer/BioNTech) maximaal 10 weken in de koelkast bewaard worden bij een temperatuur van 2-8°C. Op de verpakking staat vermeld vóór welke datum het vaccin gebruikt moet worden.
Zie voor vervoer en transport van vaccins de betreffende tabellen in hoofdstuk 6.
Cold chain-incidenten
Cold chain-incidenten met de koelkasten kunnen voor vaccinverlies zorgen. Bij een mogelijke afwijking van de temperatuur (zowel te hoge als te lage temperatuur) en bij andere incidenten waarbij het vaccin betrokken is geweest, moet de uitvoerende organisatie direct telefonisch contact op nemen met RIVM-DVP/LCC via telefoonnummer 088-689 8900. Vaccins moeten gekoeld opzij gezet worden en mogen niet gebruikt worden tot besluit van het RIVM. Nadat het RIVM heeft besloten dat de vaccins inderdaad vernietigd moeten worden, wordt het vaccin dat verloren is gegaan door de uitvoerende organisatie zelf vernietigd.
8.3 Vaccinverlies tijdens de uitvoering van de vaccinatie
Als het vaccin ten onrechte is toegediend, wordt het normaal geregistreerd bij de betreffende persoon in het medisch dossier en via een CSV-bestand aan het RIVM doorgegeven of zodra dat mogelijk is via digitale uitwisseling.
Bij vaccinatie zal enig vaccinverlies niet te vermijden zijn. Tijdens de vaccinatiesessie wordt vaccinverlies doorgegeven aan de vaccinverantwoordelijke. Dit betreft bijvoorbeeld breuk van de vaccinflacon of aan het einde van de vaccinatiesessie de multidoses vaccinflacons die niet volledig gebruikt zijn. Daarnaast wordt het vaccinverlies indirect bepaald op basis van de geleverde vaccins, de toegediende vaccinaties en de productklachten.
Vaccinflacons die gevallen zijn van werkhoogte naar de grond mogen niet meer gebruikt worden en moeten als vaccinverlies worden afgehandeld.
8.4 Productklachten
Met productklachten worden klachten over het vaccin of toebehoren bedoeld (bijvoorbeeld glasbreuk). Bij productklachten over vaccins zijn er een aantal acties die uitgevoerd dienen te worden. Deze zijn te vinden in het document Goed vaccinbeheer.
8.5 Retour nemen van vaccin
Vaccins die zijn uitgeleverd, worden niet retour genomen door RIVM-DVP/LCC.
8.6 Recall
In geval van een recall (terugroepen) van vaccins informeert RIVM-DVP/LCC zo snel mogelijk de uitvoerende organisaties en communiceert zij de vervolgacties. In veel gevallen zal de uitvoerende organisatie verzocht worden om de betrokken vaccins apart te zetten, niet te gebruiken en te voorzien van een label om misverstanden te voorkomen. Zo nodig haalt RIVM-DVP/LCC de betreffende vaccins terug voor vernietiging, onderzoek of om ze retour te sturen naar de leverancier. De uitvoerende organisatie verleent daaraan alle medewerking.
8.7 Afvalverwerking
Na toediening van het vaccin kan de naald in de naaldencontainer worden gedaan. De lege vaccinflacons gaan in een Wiva-vat. De spuiten kunnen zowel in de naaldencontainer als in een Wiva-vat. Dit kan per vaccinlocatie verschillen. Een vol Wiva-vat moet worden afgesloten. Het Wiva-vat moet in een afgesloten ruimte bewaard worden in verband met het risico op diefstal. In de situatie dat er geen Wiva-vat gebruikt wordt voor afvoer van spuiten en/of vaccinflacons en daarvoor naaldencontainers worden gebruikt, gelden de volgende aandachtspunten:
- De naaldencontainers moeten geschikt zijn om vaccinflacons en spuiten in te doen.
- De naaldencontainer is na afsluiten niet meer te heropenen.
- De afgesloten naaldencontainers worden in een afgesloten ruimte bewaard tot het moment dat ze worden opgehaald voor transport naar de afvalverwerker.
- De naaldencontainers worden als medisch afval afgevoerd.
De vaccinflacons mogen ook in UN gekeurde (blauwe, gele of grijze) vaten. Deze vaten worden in de ziekenhuizen bij de teststraten gebruikt. Daarnaast is het zo dat, wanneer een stof geclassificeerd wordt als besmettelijk medisch (infectueus) afval, dan in overleg met de afvalinzamelaar de meest logische en makkelijke verpakking hier bepaald kan worden. De vaten en naaldencontainers moeten als medisch afval worden opgehaald en vernietigd door een erkend bedrijf.
Als na het opmaken van een vaccinbatch nog stickers van deze batch over zijn, dan moeten ze vernietigd worden. Dit kan door de stickers op dezelfde wijze af te voeren als de vaccinflacons.
Voor het veilig en adequaat afvoeren van geëxpireerde restanten COVID-19-vaccins: zie het document Instructie overgebleven COVID-19-vaccins.
9. Vaccineren van bijzondere groepen
9.1 Personen afkomstig uit het buitenland
Het is aannemelijk dat ook personen afkomstig uit het buitenland immuniteit tegen SARS-CoV-2 hebben opgebouwd, ofwel door vaccinatie, ofwel door infectie, dan wel door een combinatie van beide. Zie hoofdstuk 2 voor het vaccinatiebeleid, het vaccinatiebeleid is onafhankelijk van het type vaccin dat in het buitenland ontvangen is.
9.2 In studieverband gevaccineerd
Het is mogelijk dat personen in Nederland deelnemen of hebben deelgenomen aan een COVID-19-vaccinatiestudie met bijvoorbeeld (nog) ongeregistreerde COVID-19-vaccins of afwijkende doses of toedieningsroutes van geregistreerde vaccins. Het kan in dat geval zowel gevaccineerde deelnemers als deelnemers uit een eventuele placebogroep betreffen. De studiedeelnemers worden door de hoofdonderzoeker geïnformeerd over het verdere beleid, of aanvullende vaccinatie met een mRNA-vaccin nodig is en wat de gewenste timing van de vaccinatie is. In de informatie is ook opgenomen via welke route de deelnemer contact kan opnemen met de GGD voor aanvullende mRNA-vaccinatie(s).
De registratie van de mRNA-vaccinatie(s) gegeven door de GGD vindt plaats via de GGD.
Daarnaast zal de hoofdonderzoeker de in het kader van de studie gegeven COVID-19-vaccinatie(s) via een aparte procedure in CIMS registreren, zodat in CIMS alle COVID-19-vaccinaties die iemand gehad heeft geregistreerd staan. Dit alles is niet alleen van belang voor het bekend zijn van de vaccinatiestatus in CIMS, maar ook in geval van bijzondere bijwerkingen bij de studievaccins en eventuele aanvullende mRNA-vaccinaties bij de GGD.
9.3 Extra vaccinaties voor individuele uitzonderingssituaties zonder medische noodzaak
De algemene indicaties voor COVID-19-vaccinatie die in Nederland zijn gesteld, zijn terug te vinden in hoofdstuk 2. Indien iemand om een andere dan een hier genoemde medische indicatie of afwijkend (wat betreft gebruikt vaccin) van het vaccinatieprogramma gevaccineerd wil worden, is dit niet medisch noodzakelijk. Het wordt daarom ook niet geadviseerd in het landelijke vaccinatieprogramma. Dit kan bijvoorbeeld voorkomen wanneer in het buitenland andere typen/aantallen vaccinaties worden gevraagd/als medisch geïndiceerd worden gezien dan in Nederland. Deze indicaties zijn niet opgenomen in deze uitvoeringsrichtlijn; zie paragraaf 1.5.
Afwegingen die de arts maakt voorafgaand aan vaccinatie zonder medische noodzaak:
- Zijn er absolute of relatieve contra-indicaties bij deze persoon? Indien er geen relatieve en/of absolute contra-indicaties zijn voor COVID-19-vaccinatie (zie hoofdstuk 4), dan is er ook geen contra-indicatie voor een extra vaccinatie voor dit individuele uitzonderingsgeval.
- Wat is het bijwerkingenprofiel van dit vaccin? Is er een beter alternatief? Het bijwerkingsprofiel van een extra vaccinatie in een individueel geval is niet bekend. De bijwerkingen van een extra vaccinatie komen waarschijnlijk overeen met die van eerder toegediende vaccinaties. Het is niet duidelijk of een korter interval dan geadviseerd invloed heeft op de bijwerkingen. Bij het maken van een uitzondering en de keuze voor het type vaccin is het belangrijk om het bijwerkingsprofiel van de verschillende type vaccins in overweging te nemen, omdat er per vaccintype verschillende zeldzame ernstige bijwerkingen zijn gemeld. Zie hoofdstuk 6
- Wat is het te verwachten effect op de immuniteit? Is dit het juiste moment om het vaccin toe te dienen met het oog op optimaal effect? Vanwege de effectiviteit is het, ook bij extra vaccinaties voor individuele uitzonderingsgevallen, gewenst om met een interval van bij voorkeur 6 maanden, ten minste 12 weken, na de laatste dosis of na bevestigde infectie te vaccineren.
- Is het vaccin geregistreerd voor deze toepassing bij deze leeftijdsgroep? Indien het niet geregistreerd is voor de leeftijd van de betreffende persoon, betreft het off-label gebruik.
De arts dient te allen tijde de bovengenoemde afwegingen te bespreken met de cliënt wanneer hij of zij besluit te vaccineren zonder medische indicatie (zie hoofdstuk 2). In het gesprek dienen de volgende punten aan de orde te komen:
- dat het medisch gezien niet noodzakelijk is om deze vaccinatie te geven;
- welke bijwerkingen de vaccinatie kan geven;
- wat het te verwachten effect is van een eventuele afwijkende timing;
- dat er geen zekerheid is dat de vaccinatie geaccepteerd wordt voor toegang in het buitenland.
De patiënt dient hierop informed consent te geven. De arts legt dit schriftelijk vast.
Alle toegediende vaccins worden geregistreerd door de uitvoerende organisatie en als er toestemming is gegeven ook in CIMS. De gevolgen voor de geldigheid van DCC of CTB of eisen die in het buitenland gesteld worden, vallen buiten deze richtlijn.
10. Bijwerkingen en postvaccinale verschijnselen
Het Bijwerkingencentrum Lareb heeft, in opdracht van het CBG, een belangrijke rol in het verzamelen, vastleggen en analyseren van meldingen van vermoede bijwerkingen van de COVID-19-vaccinatie.
10.1 Definities
Bijwerking: een ongewenste medische gebeurtenis waarvan vermoed wordt dat er een relatie bestaat met het vaccin.
Postvaccinale verschijnselen of AEFI (adverse event following immunisation): een gebeurtenis na vaccinatie, waarvan de relatie met de vaccinatie nog niet bepaald is.
Melding (bij Lareb): melding van een of meer ongewenste medische gebeurtenissen ofwel vermoede bijwerkingen na een vaccinatiemoment (www.lareb.nl).
10.2 Mogelijke bijwerkingen
Reacties die snel na de vaccinatie optreden
Tijdens de vaccinatie moet men bedacht zijn op flauwvallen van deelnemers, zoals dat altijd bij vaccineren het geval is. Door hier vooraf naar te vragen kan er tijdens en na het vaccineren op geanticipeerd worden.
Anafylactische reacties zijn uitermate zeldzaam, maar niet uit te sluiten. Observatie na vaccinatie gedurende minimaal 15 minuten blijft belangrijk. In een nota van december 2021 en in een nota van juli 2023 van het RIVM staat de onderbouwing van de 15 minuten observatie na een COVID-19-vaccinatie uiteengezet.
In het kader van de COVID-19-vaccinatie moet de uitvoerende organisatie daarom snel 112 kunnen bellen en beschikken over een protocol voor ernstige acute bijwerkingen na vaccinatie. Zie als voorbeeld het protocol van de LCR in bijlage 4 en de ‘werkinstructie medische lijn op de Covidvaccinatie locatie’ van GGD GHOR. De richtlijnen van de eigen organisatie met betrekking tot ernstige of onmiddellijke reacties na vaccinatie kunnen ook gevolgd worden.
Een noodkit met stappenplan en medicatie (onder andere adrenaline of EpiPen) moet aanwezig zijn tijdens het vaccineren. De ambulancedienst hoeft niet van tevoren ingelicht te worden over de geplande vaccinatiesessie. Zij zijn op de hoogte van het feit dat er in heel Nederland dagelijks gevaccineerd wordt.
Algemene reacties die optreden na de vaccinatie
Wanneer COVID-19-vaccinaties worden ingepland voor bepaalde beroepsgroepen, moet de reactogeniciteit worden meegenomen in de timing, zodat de continuïteit van zorg of andere arbeid gewaarborgd blijft. Bij een aanzienlijke deel van de mensen treden bijwerkingen op als koorts, hoofdpijn en moeheid na vaccinatie met COVID-19-vaccins. Maar ook spierpijn, pijnlijke gewrichten, rillingen, misselijkheid en braken kunnen optreden na vaccinatie met Comirnaty (Pfizer/BioNTech). Deze acute reacties op vaccinatie zijn onschuldig en het gevolg van het aanjagen van het afweersysteem na vaccinatie. De klachten gaan spontaan weer over binnen 1-2 dagen. Maar ze zijn wel hinderlijk en kunnen leiden tot het tijdelijk niet inzetbaar zijn voor werk in de eerste 24-48 uur na vaccinatie. De klachten zijn meer uitgesproken bij jongeren dan bij ouderen en nemen toe na de tweede vaccinatie bij een mRNA-vaccin in aantal en in ernst (mild en matig) (Chapin-Bardales 2021). Voor de boostervaccinatie met een mRNA-vaccin is de reactogeniciteit vergelijkbaar met die na de mRNA-vaccinaties in de primaire serie (Atmar 2021, Munro 2021).
De meest voorkomende bijwerkingen kunnen per vaccin verschillen en staan in hoofdstuk 6 bij het betreffende vaccin beschreven. Zie voor een volledig overzicht de bijsluitertekst van het betreffende vaccin.
Myocarditis en pericarditis
Myocarditis en pericarditis zijn zeldzame bijwerkingen van de coronavaccins van Pfizer/BioNTech (Comirnaty), Moderna (Spikevax) en Novavax (Nuvaxovid) (zie ook de website van Lareb, het statement van de WHO en de EMA-‘safety-update’ van augustus 2022). Spikevax (Moderna) geeft in een aantal databases een hoger risico dan Comirnaty (Pfizer/BioNTech) (Karlstad 2022, Buchan 2022), maar wordt sinds 17 april 2023 niet meer gebruikt in het COVID-19-vaccinatieprogramma. Zie paragraaf 4.4 voor de advisering rondom vervolgvaccinatie na post-vaccinatie myocarditis en pericarditis.
Het risico op post-vaccinatie myocarditis en pericarditis wordt vooral gezien bij mannen van 12-40 jaar (Straus 2022, Oster 2022, Patone 2022, Karlstad 2022, Buchan 2022) met een piek tussen 16-24 jaar. Myocarditis en pericarditis treden het vaakst op binnen 7 dagen na de tweede mRNA dosis (Fatima 2022, CDC 2023), hoewel ook gevallen zijn gerapporteerd na de eerste dosis of boostervaccinatie (CDC 2023). Het risico op myocarditis en pericarditis is hoger wanneer een korter interval dan 30 dagen tussen de eerste en tweede mRNA-vaccinatie wordt aangehouden (Buchan 2022).
Het risico op myocarditis en pericarditis is laag bij een vervolgvaccinatie na een voltooide basisserie. Dit wordt bevestigd door een Israëlische studie en rapportages van VAERS (Yechezkel 2023). Uit VAERS, een programma van de Verenigde Staten voor de monitoring van vaccinveiligheid, blijkt dat het risico op myocarditis en pericarditis lager is na een boostervaccinatie vergeleken met na de basisserie (Chen 2022). De incidentie van myocarditis en pericarditis na een boostervaccinatie was in deze registratie ongeveer 2,84 per miljoen gevaccineerden, vergeleken met 10,61 per miljoen in de basisserie.
Mogelijkerwijs blijft bij een nieuwe herhaalvaccinatie vooral bij jonge mannen een verhoogd risico op myocarditis bestaan al is dat risico lager dan na de tweede vaccindosis. Er is nog te weinig data beschikbaar over het risico na een vierde of vijfde dosis.
Al kunnen myocarditis en pericarditis bij patiënten van 12 jaar en ouder in de 28 dagen na vaccinatie dus een bijwerking zijn van een mRNA-vaccin, de aantallen zijn echter wel lager dan die van myocarditis/pericarditis na doorgemaakte COVID-19 (Singer 2021). Het klinisch beeld van een myocarditis/pericarditis na mRNA-vaccinatie is milder dan tijdens het doormaken van de infectie met SARS-CoV-2. Patiënten herstellen doorgaans snel en zonder restverschijnselen na een post-vaccinatie-pericarditis/myocarditis (Truong 2021, Shimabukuro 2022).
Het risico op myocarditis en pericarditis is veel lager bij kinderen van 5 t/m 11 jaar dan bij adolescenten. Vaccine Safety Datalink (VSD), een database in de Verenigde Staten, monitort vaccinveiligheid. VSD rapporteerde een incidentie van 81,4 per miljoen voor mannen tussen de 18-29 jaar na de tweede dosis en 47,6 na de eerste boostervaccinatie, in vergelijking tot een incidentie van 15,7 per miljoen na de tweede dosis voor jongens van 5-11 jaar (Shimabukuro 2022). Bij kinderen van 5 t/m 11 jaar in de VS blijkt uit gegevens van de eerste 4 maanden van het vaccinatieprogramma dat er na de eerste 8,7 miljoen vaccinaties met Comirnaty in deze leeftijdscategorie 15 meldingen waren van symptomen van myocarditis met een mild klinisch beloop.
Bij kinderen van 6 maanden t/m 4 jaar oud is er nog geen verhoogd risico op myocarditis en pericarditis na COVID-19-vaccinatie waargenomen (Hause 2022b).
Effect op de menstruatiecyclus
Bijwerkingencentrum Lareb heeft tot eind maart 2022 ruim 24.000 meldingen ontvangen van menstruatiestoornissen na coronavaccinatie (Lareb 2022). Er zijn ongeveer 17 miljoen vaccins gegeven aan vrouwen. Vrouwen hebben aan Lareb aangegeven of een heftigere menstruatie te ervaren, of een verlate of onregelmatige menstruatie of tussentijds bloedverlies. Een Amerikaans cohort onderzoek dat data voorafgaand aan de vaccinatie ter beschikking had, laat doorgaans een verandering van minder dan 1 dag in de menstruele cyclus zien na vaccinatie en geen verandering in de lengte van de menstruatieperiode (Edelman 2022). In een Noors onderzoek vond men een toename van bloedverlies en menstruatiepijn. Een recent onderzoek dat de menstruatiecyclus voor en na vaccinatie monitort liet echter weer zien dat er geen belangrijke verschillen zijn in parameters als cyclus lengte, hoeveelheid bloedverlies, en tijd van ovulatie (Bouchard 2022). In het algemeen verschillen de cyclus veranderingen weinig van de normale, fysiologische variaties die kunnen optreden in het menstruatiepatroon, en lijken ze niet gelinkt te zijn aan het moment van vaccinatie gedurende de cyclus en soort vaccin, en herstellen ze vaak spontaan binnen 2 maanden (Trogstad 2022, Laganà 2022).
Overgevoeligheidsreactie bij cosmetische fillers
Na COVID-19-vaccinaties zijn sporadisch overgevoeligheidsreacties ontstaan bij mensen die een behandeling met fillers kregen of hadden ondergaan. Dit werd in januari 2022 door Lareb gemeld. De meldingen (32) zijn onderzocht door het Meldpunt en Expertisecentrum Bijwerkingen Implantaten. De meldingen betroffen zowel lokale reacties bij het plaatsen van een filler ná een coronavaccinatie als ook in de omgekeerde volgorde. Overgevoeligheidsreacties werden zowel bij de eerste vaccinatie als bij de tweede en de boostervaccinatie gezien. Ook de SARS-CoV-2-infectie zelf in combinatie met een geplaatste filler kan een overgevoeligheidsreactie veroorzaken. Het interval tussen beide gebeurtenissen bleek in dit overzicht sterk wisselend te zijn; van enkele minuten tot jaren. Ook bij andere vaccinaties zoals tegen influenza en gordelroos zijn overgevoeligheidsreacties beschreven bij patiënten die fillers hadden of kregen. Het is niet exact bekend hoe deze reacties tot stand komen, maar in diverse publicaties wordt gesuggereerd dat het door vaccinatie geactiveerde immuunsysteem reageert op de lichaamsvreemde stof in de fillers (Bachour 2022).
10.3 Het verminderen van bijwerkingen
Welke bijwerkingen kunnen optreden staat in de bijsluiter van het betreffende vaccin. Voor het voorkomen of verminderen van ongewenste verschijnselen na vaccinatie kan paracetamol worden ingenomen volgens de aanwijzingen in de bijsluiter. De meest voorkomende bijwerkingen staan in hoofdstuk 6 bij het betreffende vaccin beschreven.
De huisarts (bij vaccinatie door GGD of huisarts) of de instellingsarts (bij vaccinatie in een instelling) moet gewaarschuwd worden bij heftige, niet te duiden klachten of klachten die na paracetamolgebruik niet overgaan. Mogelijk is er sprake van een (andere) ziekte.
10.4 Melden van postvaccinale verschijnselen bij Lareb
In de Geneesmiddelenwet artikel 78 lid 3 is het volgende opgenomen: “Beroepsbeoefenaren melden onmiddellijk elke vermoedelijke ernstige bijwerking.”
Er is sprake van een ernstige bijwerking als die bijwerking leidt tot ziekenhuisopname, blijvende invaliditeit, een aangeboren afwijking, een levensbedreigende situatie of overlijden. Voor overlijden na vaccinatie betekent dit dat een zorgverlener zelf moet inschatten of er vermoedelijk een relatie bestaat tussen de vaccinatie en het overlijden. Dit kan direct zijn, maar ook indirect. Bijvoorbeeld als er koorts of diarree ontstond als bijwerking en dat vervolgens leidde tot ernstige verslechtering van de toestand van de patiënt. Melden is niet verplicht als er overduidelijk sprake is van een andere oorzaak dan vaccinatie. Is de relatie nog heel onduidelijk, dan kan het laagdrempelig gemeld worden. Lareb beoordeelt bij ieder gemeld overlijden zorgvuldig hoe sterk de mogelijke relatie tussen het overlijden en de vaccinatie is.
Meld een bijwerking aan Bijwerkingencentrum Lareb, onder vermelding van het chargenummer van het betreffende vaccin, bij (ook als u niet zeker bent van het causale verband):
- ernstige gebeurtenissen (zoals ziekenhuisopnames, blijvende invaliditeit of overlijden) ongeacht het vermeende causale verband;
- onverwachte of bijzondere bijwerkingen;
- twijfel over vervolgvaccinaties;
- onrust of negatieve publiciteit;
- alles wat u verder van belang vindt.
Professionals kunnen rechtstreeks contact opnemen met Lareb voor overleg over het melden van postvaccinale verschijnselen/bijwerkingen. Als zij een melding aan Bijwerkingencentrum Lareb willen doen, moeten zij de toestemming van de betreffende persoon hebben om relevante (medische) informatie aan Bijwerkingencentrum Lareb door te kunnen geven. Noteer dit in het dossier. Vermeld bij het doen van een melding het chargenummer van het betreffende vaccin.
Voor het melden van een vermoede bijwerking na een COVID-19-vaccinatie heeft Lareb een speciaal COVID-19-meldformulier. Zowel zorgverleners als gevaccineerde personen kunnen een bijwerking melden.
Bijwerkingencentrum Lareb
Telefoon: 073-646 9700 (9:00-17:00 uur) (alleen voor zorgprofessionals)
E-mail: info@lareb.nl
Website: www.lareb.nl
11. Communicatie, verwijzing en registratie
11.1 Folders en publieksvoorlichting
Specifieke beleidsinformatie over de COVID-19-vaccinatie is te vinden op de website Rijksoverheid.nl. Uitgebreide publieksinformatie is te vinden op Mijnvraagovercorona.nl. Er zijn diverse vertalingen van het voorlichtingsmateriaal en overige informatie beschikbaar. Op de RIVM-website is medisch inhoudelijke informatie te vinden. Informatie in het Engels staat op de Engelstalige RIVM-website.
Voor het publiek is een speciaal telefoonnummer van de Rijksoverheid beschikbaar: 1400
11.2 Verwijzing voor vaccinatie en geïnformeerde toestemming
In 2024 is COVID-19-vaccinatie (de coronaprik) doorlopend beschikbaar voor volwassen en kinderen uit medische hoogrisicogroepen als dat geadviseerd wordt door een behandelend arts en voor personen die op individuele basis door een behandelend arts worden verwezen voor vaccinatie.
De behandelend arts stelt de indicatie voor een extra vaccinatie (buiten een najaarsronde), een korter interval of hervaccinatie (primaire vaccinatieserie) en verwijst de betreffende persoon hiervoor naar de GGD.
Geïnformeerde toestemming
Aan alle deelnemers aan het vaccinatieprogramma wordt toestemming gevraagd voor het verwerken van de persoonsgegevens, waaronder doorlevering vanuit de uitvoerders aan het RIVM.
Bij personen die niet zelf wilsbekwaam zijn, moet vooraf toestemming zijn gevraagd van een wettelijk vertegenwoordiger. Dit mag mondeling doorgegeven worden, mits dit aantoonbaar is (onder andere opgenomen in het cliëntdossier) en de wettelijk vertegenwoordiger goed geïnformeerd is.
11.3 Legitimatie vooraf aan de vaccinatie
Personen dienen door een behandelend arts te worden verwezen om voor een COVID-19-vaccinatie in aanmerking te komen. Op de GGD-locatie dient de persoon een (eventuele) verwijsbrief samen met een legitimatiebewijs te tonen. Het ontbreken van een legitimatiebewijs hoeft geen belemmering te vormen voor de vaccinatie. In dat geval moet de uitvoerende medewerker ervan overtuigd zijn wie de betreffende deelnemer is.
11.4 Registratie van vaccinaties
Registratie door de uitvoerende organisatie
Iedere zorgmedewerker legt zijn/haar medische verrichting conform de WGBO vast in het eigen medische dossier van de cliënt, in principe op de dag van vaccinatie. De vaccinatie in een vaccinatieronde in het najaar wordt geregistreerd met een kenmerk dat de vaccinatie onderscheidt van eerdere vaccinaties.
- De GGD registreert in een eigen systeem.
- Huisartsen gebruiken hun eigen Huisarts Informatiesysteem (HIS).
- Bedrijfsartsen gebruiken verschillende systemen voor hun digitale cliëntendossiers en leveren aan RIVM via de webapplicatie BRBA (zie handleiding).
- Specialisten ouderengeneeskunde en artsen verstandelijk gehandicapten gebruiken hun eigen medisch dossier (EPD’s/EVS’n/ECD’s).
- Ziekenhuizen die zorgpersoneel vaccineren, gebruiken het registratiesysteem ZKVI.
Centraal vaccinatieregister
Voor onder meer de infectieziektebestrijding, evaluatie van het programma, onverwachte bijwerkingen of een recall is het belangrijk dat alle vaccinaties geregistreerd worden in CIMS. RIVM-DVP heeft de taak gegevens over de toegediende vaccinaties vast te leggen in CIMS. Inwoners van Nederland staan bij de gemeente geregistreerd in de Basis Registratie Personen (BRP). Deze gegevens staan ook in CIMS. Asielzoekers zonder BSN worden geregistreerd met hun V-nummer of COA-zorgnummer.
De uitvoerende organisaties geven de vaccinatiegegevens, samen met een aantal persoonsgegevens die nodig zijn om de vaccinatie aan de juiste persoon in CIMS te koppelen, door aan het RIVM. Voorkeur heeft de aanlevering van gegevens via het Landelijk Schakel Punt. Indien dit niet mogelijk is, heeft aanlevering door middel van CSV-bestanden middels Zorgmail de voorkeur. Gegevens kunnen ook via een Secure File Transfer Protocol-connectie (SFTP-connectie) aangeleverd worden. Vaccinaties van mensen zonder BSN kunnen via CSV-bestanden worden doorgegeven.
11.5 Vaccinatiebewijs
De vaccinatiegegevens zijn te vinden op mijn.rivm.nl, wanneer er toestemming is gegeven voor het delen/doorleveren van de gegevens met/aan het RIVM. Hier staat de relevante informatie over vaccinatiedatum, productnaam en batchnummer van het vaccin. Voor de leeftijdsgroep 6 maanden t/m 17 jaar en voor uitzonderingsgevallen, bijvoorbeeld mensen zonder DigiD, kan op verzoek een papieren registratie van de vaccinatiegegevens worden meegegeven door de uitvoerende instantie. De deelnemer kan ook zelf het eigen gele vaccinatieboekje meenemen. De GGD plaatst op verzoek een aanvullende aantekening in de vorm van een stempel of handtekening als registratie in het gele boekje (zie nieuwsbericht GGD GHOR). Er zijn op dit moment geen internationale afspraken over het gele boekje als coronavaccinatiebewijs. Wel kan het voor eigen administratie handig zijn de vaccinatiegegevens bij elkaar te bewaren. Het ministerie van VWS heeft besloten de uitgifte van internationale digitale bewijzen via de CoronaCheck-app per 1 juli 2023 te beëindigen.
Bronnen
Referenties
- Antonelli M et al. 2022. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet 399 (1043): 2263-2264. https://doi.org/10.1016/S0140-6736(22)00941-2.
- Atmar RL et al 2021. Heterologous SARS-CoV-2 booster vaccinations – preliminary report. MedRxiv 2021 Oct 15. Preprint. https://doi.org/10.1101/2021.10.10.21264827.
- Bachour Y et al. 2022. Late inflammatory reactions in patients with soft tissue fillers after SARS-CoV-2 infection and vaccination: a systematic review of the literature. J Cosmet Dermatol 21 (4): 1361-1368. https://doi.org/10.1111/jocd.14840.
- Bentov Y et al. 2021. Ovarian follicular function is not altered by SARS-CoV-2 infection or BNT162b2 mRNA COVID-19 vaccination. Hum Reprod 36 (9): 2506-2513. https://doi.org/10.1093/humrep/deab182.
- Bertrand K et al. 2021. Maternal and child outcomes reported by breastfeeding women following messenger RNA COVID-19 vaccination. Breastfeed Med. 16 (9): 697-701. https://doi.org/10.1089/bfm.2021.0169.
- Birol Ilter P et al. 2022. Maternal and perinatal outcomes of SARS-CoV-2 infection in unvaccinated pregnancies during Delta and Omicron waves. Ultrasound in obstetrics & gynecology. 2022 July. https://doi.org/10.1002/uog.24916.
- Blumenthal KG et al. 2021. Delayed large local reactions to mRNA-1273 vaccine against SARS-CoV-2. N Engl J Med 2021; Mar 3. https://doi.org//10.1056/NEJMc2102131.
- BMJ 2021. Vaccinating against covid and flu at the same time is safe, study shows. BMJ 2021; 375: n2411. https://doi.org/10.1136/bmj.n2411.
- Bouchard T P et al. 2022. Menstrual Cycle Parameters Are Not Significantly Different After COVID-19 Vaccination. Journal of women’s health. 2022 August 17. https://doi.org/10.1089/jwh.2022.0097.
- de Bruijn S et al. 2023. Lower prevalence of Post-Covid-19 condition following Omicron SARS-CoV-2 infection. MedRxiv. 2023 April 5. Preprint.
- Buchan SA et al. 2022. Epidemiology of myocarditis and pericarditis following mRNA Vaccines in Ontario,Canada. JAMA. 2022 June 24. https://doi.org/10.1001/jamanetworkopen.2022.18505.
- Burgmeijer R & Hoppenbrouwers K 2011. Handboek vaccinaties theorie en uitvoeringspraktijk. 2e ed. Assen: Koninklijke van Gorcum.
- CDC 2023. Clinical considerations: myocarditis and pericarditis after receipt of COVID-19 vaccines among adolescents and young adults. Reviewed March 2023. https://www.cdc.gov/vaccines/covid-19/clinical-considerations/myocarditis.html.
- Ceban F et al. 2023. COVID-19 vaccination for the prevention and treatment of long COVID: a systematic review and meta-analysis. Brain Behav Immun 2023 Jul; 111: 211-229. doi: 10.1016/j.bbi.2023.03.022. Epub 2023 Mar 27.
- Chapin-Bardales J et al. 2021. Reactogenicity following receipt of mRNA-based COVID-19 vaccines. JAMA 2021 April 5. https://doi.org/10.1001/jama.2021.5374.
- Chen C et al. 2022. Booster dose of COVID-19 mRNA vaccine does not increase risks of myocarditis and pericarditis compared with primary vaccination: new insights from the vaccine adverse event reporting system. Front Immunol 2022 Sep 12; 13: 938322. doi: 10.3389/fimmu.2022.938322.
- Covelli I et al. 2023. Short-term breastfeeding and breastmilk supply changes associated with presence of systemic symptoms following COVID-19 vaccination among lactating individuals. Am J Obstet Gynecol 228 (2): S776–7. https://doi.org/10.1016/j.ajog.2022.11.122.
- DeSilva M. et al. 2022. Evaluation of Acute Adverse Events after Covid-19 Vaccination during Pregnancy. The New England journal of medicine. 2022 July 14. https://doi.org/10.1056/NEJMc2205276.
- Devon E et al. 2021. Cutaneous reactions reported after Moderna and Pfizer COVID-19 vaccination: A registry-based study of 414 cases. J Am Acad Dermatol 2021 Apr 7; 85 (1): 46-55. https://doi.org/10.1016/j.jaad.2021.03.092.
- Dulfer 2023. Timing and sequence of vaccination against COVID-19 and influenza (TACTIC): a single-blind, placebo-controlled randomized clinical trial - The Lancet Regional Health – Europe
- Edelman A et al. 2022. Association between menstrual cycle length and coronavirus disease 2019 (COVID-19). Obstetrics & Gynecology. 2022 April. https://doi.org/10.1097/AOG.0000000000004695.
- Fatima M et al. 2022. Development of myocarditis and pericarditis after COVID-19 vaccination in adult population: a systematic review. Ann Med Surg (Lond) 2022 Apr; 76: 103486. Published online 2022 Mar 11. doi: 10.1016/j.amsu.2022.103486.
- Feikin DR et al. 2022. Duration of effectiveness of vaccines against SARS-CoV-2 infection and COVID-19 disease: results of a systematic review and meta-regression. Lancet 399 (10328): 924-944. https://doi.org/10.1016/S0140-6736(22)00152-0.
- Friedensohn L et al. 2021. Sub-cutaneous Pfizer/BioNTech COVID-19 vaccine administration results in seroconversion among young adults. Vaccine 39 (42): 6210-6212. https://doi.org/10.1016/j.vaccine.2021.07.096.
- Goldshtein I et al. 2022. Association of BNT162b2 COVID-19 Vaccination During Pregnancy With Neonatal and Early Infant Outcomes. JAMA pediatrics. 2022 Feb 10. https://doi.org/10.1001/jamapediatrics.2022.0001.
- Gonen T et al. 2023: Immunogenicity and Reactogenicity of Coadministration of COVID-19 and Influenza Vaccines | Infectious Diseases | JAMA Network Open | JAMA Network
- GOV.UK 2023. Myocarditis and pericarditis after COVID-19 vaccination: clinical management guidance for healthcare professionals. Updated January 2023
- de Groot R et al. 2014. Handhygiëne in de jeugdgezondheidszorg, ook bij het vaccineren? Infectieziekten Bulletin 25 (3).
- Hameed I et al. 2023. Is it safe and effective to administer COVID-19 vaccines during pregnancy? A systematic review and meta-analysis. Am J Infect Control 51 (5): 582-593. https://doi.org/10.1016/j.ajic.2022.08.014.
- Hause AM et al. 2022a. Reactogenicity of Simultaneous COVID-19 mRNA Booster and Influenza Vaccination in the US. JAMA network open. 2022 Jul 1. https://doi.org/10.1001/jamanetworkopen.2022.22241
- Hause AM et al. 2022b. COVID-19 mRNA vaccine safety among children aged 6 months–5 years — United States, June 18, 2022–August 21, 2022. MMWR Morb Mortal Wkly Rep September 2, 2022; 71 (35): 1115–1120. http://dx.doi.org/10.15585/mmwr.mm7135a3.
- Hernández-Aceituno A et al. 2023. COVID-19 long-term sequelae: Omicron versus Alpha en Delta variants. Infectious Diseases Now 2023 August. https://doi.org/10.1016/j.idnow.2023.104688.
- Huiberts AJ 2023. Effectiveness of bivalent mRNA booster vaccination against SARS-CoV-2 Omicron infection, the Netherlands, September to December 2022. Eurosurveillance. 2023 Feb 16. https://doi.org/10.2807/1560-7917.ES.2023.28.7.2300087.
- Iba T & Levy JH. Thrombosis and thrombocytopenia in COVID-19 and after COVID-19 vaccination. Trends in Cardiovascular Medicine 32 (5): 249-256. https://doi.org/10.1016/j.tcm.2022.02.008.
- Izikson R et al. 2022. Safety and immunogenicity of a high-dose quadrivalent influenza vaccine administered concomitantly with a third dose of the mRNA-1273 SARS-CoV-2 vaccine in adults aged ≥65 years: a phase 2, randomised, open-label study. The Lancet. Respiratory medicine. 2022 Feb 1. https://doi.org/10.1016/S2213-2600(21)00557-9.
- Karlstad O et al. 2022. Sars-Cov-2 vaccination and Myocarditis in a Nordic Cohort Study of 23 Million Residents. 2022 April 20. https://doi.org/10.1001/jamacardio.2022.0583.
- van der Kraats et al. 2022. Ernstige schouderproblematiek na covid-19-vaccinatie. Nederlandse Tijdschrift voor Geneeskunde. 2022 May 12. Ernstige schouderproblematiek na covid-19-vaccinatie | Nederlands Tijdschrift voor Geneeskunde (ntvg.nl)
- Laganà A et al. 2022 Evaluation of menstrual irregularities after COVID-19 vaccination: Results of the MECOVAC survey. Open Medicine. 2022 March 9. https://doi.org/10.1515/med-2022-0452
- Lareb 2022. Meer onderzoek menstruatiestoornissen na coronavaccinatie. Nieuwsbericht Bijwerkingencentrum Lareb 23-05-2022. https://www.lareb.nl/news/meer-onderzoek-menstruatiestoornissen-na-coronavaccinatie.
- Lazarus R et al. 2021. The safety and immunogencity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT162b2) with seasonal influenze vaccines in adults: a phase IV, multicenter randomized controlled trial with blinding (ComFluCOV). Lancet 398 (10318): 2277-2287. https://doi.org/10.1016/S0140-6736(21)02329-1.
- Lipkind HS et al. 2022. Receipt of COVID-19 vaccine during pregnancy and preterm or small-for-gestational-age at birth: eight integrated health care organizations, United States, December 15, 2020–July 22, 2021. MMWR Morb Mortal Wkly Rep 2022 Jan 4. ePub. http://dx.doi.org/10.15585/mmwr.mm7101e1.
- Low JL et al. 2021a. Codominant IgG and IgA expression with minimal vaccine mRNA in milk of BNT162b2 vaccinees. NPJ Vaccines 2021 Aug 19; 6(1): 105. https://doi.org/10.1038/s41541-021-00370-z.
- Low JM et al. 2021b. Breastfeeding mother and child clinical outcomes after COVID-19 vaccination. Journal of human lactation 2021 October 19. https://doi.org/10.1177/08903344211056522.
- Magnus MC et al. 2022. Association of SARS-CoV-2 vaccination during pregnancy with pregnancy outcomes. JAMA 327 (15): 1469-1477. https://doi.org/10.1001/jama.2022.3271.
- McLaurin-Jiang S et al. 2021. Maternal and Child Symptoms Following COVID-19 Vaccination Among Breastfeeding Mothers. Breastfeeding medicine. 2021 Sep 16. https://doi.org/10.1089/bfm.2021.0079.
- Munro A et al. 2021. Safety and immunogenicity of seven COVID-19 vaccines as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2 in the UK (COV-BOOST): a blinded, multicentre, randomised, controlled, phase 2 trial. Lancet 2021 Dec 2. https://doi.org/10.1016/S0140-6736(21)02717-3.
- Oster ME at al. 2022. Myocarditis cases reported after mRNA-based COVID-19 vaccination in the US from December 2020 to Augist 2021. JAMA 2022; 327 (4): 331-340. https://doi.org/10.1001/jama.2021.24110.
- Patone M et al. 2022. Risks of myocarditis, pericarditis, and cardiac arrhythmias associated with COVID-19 vaccination or SARS-CoV-2-infection. Nat Med. 2021 December 14. https://doi.org/10.1038/s41591-021-01630-0.
- Perl S et al. 2021. SARSsCoV-2-specific antibodies in breast milk after COVID-19 vaccination of breastfeeding women. JAMA 2021 Apr; 325 (19): 2013-2014. https://doi.org/10.1001/jama.2021.5782.
- Prasad M et al. 2021. No crossreactivity of anti-SARS-CoV-2 spike protein antibodies with Syncytin-1. Cellular & molecular immunology 2021 October 13. https://doi.org/10.1038/s41423-021-00773-x.
- Prasad S et al. 2022. Systematic review and meta-analysis of the effectiveness and perinatal outcomes of COVID-19 vaccination in pregnancy. Nat Commun 13 (1): 2414. https://doi.org/10.1038/s41467-022-30052-w.
- Ruderman RS et al. 2022. Association of COVID-19 Vaccination During Early Pregnancy With Risk of Congenital Fetal Anomalies. JAMA pediatrics. 2022 April 4. https://doi.org/10.1001/jamapediatrics.2022.0164.
- Sadarangani M et al. 2022. Safety of COVID-19 vaccines in pregnancy: a Canadian National Vaccine Safety (CANVAS) network cohort study. The Lancet Infectious Diseases. 2022 August 11. https://doi.org/10.1016/S1473-3099(22)00426-1
- Saint-Gerons DM et al. 2023. Myopericarditis associated with the Novavax COVID-19 vaccine (NVX-CoV2373): a retrospective analysis of individual case safety reports from VigiBase. Drugs – Real World Outcomes. 2023 Feb 14. https://doi.org/10.1007/s40801-023-00355-5.
- Sangli S et al. 2021. Thrombosis With Thrombocytopenia After the Messenger RNA–1273 Vaccine. Annals of internal medicine. 2021 June 29. https://doi.org/10.7326/L21-0244.
- See I et al. 2022. Case series of thrombosis with thrombocytopenia syndrome after COVID-19 vaccination-United States, December 2020 to August 2021. Ann Intern Med 175 (4): 513-522. https://doi.org/10.7326/M21-4502.
- Shimabukuro TT et al. 2022. Update on Myocarditis following mRNA Covid 19 vaccination. June 2022. Update on myocarditis following mRNA COVID-19 vaccination (cdc.gov).
- Singer ME et al. 2022. Risk of myocarditis from COVID-19 infection in people under age 20: a population-based analysis. MedRxiv 2022 Mar 21. Preprint. https://doi.org/10.1101/2021.07.23.21260998.
- Straus et al. 2022. Analysis of Myocarditis Among 252 Million mRNA-1273 Recipients Worldwide. Clinical Infectious Diseases. 2022 June 6. https://doi.org/10.1093/cid/ciac446.
- Toback S et al. 2022. Safety, immunogenicity, and efficacy of a COVID-19 vaccine (NVX-CoV2373) co-administered with seasonal influenza vaccines: an exploratory substudy of a randomised, observer-blinded, placebo-controlled, phase 3 trial. The Lancet. Respiratory medicine. 2021 Nov 17. https://doi.org/10.1016/S2213-2600(21)00409-4.
- Trogstad L. 2022. Increased occurrence of menstrual disturbances in 18-to 30-year-old women after COVID-19 vaccination. SSRN. 2022 Jan 14. http://dx.doi.org/10.2139/ssrn.3998180.
- Truong DT et al. 2021. Clinically suspected myocarditis temporally related to COVID-19 vaccination in adolescents and young adults. Circulation 2021 Dec 6. Online ahead of print. https://doi.org/10.1161/CIRCULATIONAHA.121.056583.
- Villar J et al. 2023. Pregnancy outcomes and vaccine effectiveness during the period of omicron as the variant of concern, INTERCOVID-2022: a multinational, observational study. Lancet Jan 2023. https://doi.org/10.1016/S0140-6736(22)02467-9.
- Watanabe A et al. 2022. Peripartum outcomes associated with COVID-19 vaccination during pregnancy: a systematic review and meta-analysis. JAMA Pediatr 176 (11): 1098–1106. https://doi.org/10.1001/jamapediatrics.2022.3456.
- Watanabe A et al. 2023 Protective effect of COVID-19 vaccination against long COVID syndrome: a systematic review and meta-analysis. Vaccine 2023 March 10; 41 (11): 1783-1790. https://doi.org/10.1016/j.vaccine.2023.02.008.
- Welsh KJ et al. 2021. Thrombocytopenia including immune thrombocytopenia after receipt of mRNA COVID-19 vaccines reported to the Vaccine Adverse Event Reporting System (VAERS). Vaccine 39 (25): 3329-3332. https://doi.org/10.1016/j.vaccine.2021.04.054.
- WHO 2022a. Weekly epidemiological update on COVID-19. Edition 105. 2022 August 17. https://www.who.int/publications/m/item/weekly-epidemiological-update-on-covid-19---17-august-2022.
- WHO 2022b. Interim recommendations for use of the Pfizer–BioNTech COVID-19 vaccine, BNT162b2, under Emergency Use Listing. 2022 August 18. https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE_recommendation-BNT162b2-2021.1.
- WHO 2022c. Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19. 2022 August 18. https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE-recommendation-mRNA-1273-2021.3.
- Yechezkel M et al. 2023. Safety of the fourth COVID-19 BNT162b2 mRNA (second booster) vaccine: a prospective and retrospective cohort study. Lancet 11 (2): 139-150. https://doi.org/10.1016/S2213-2600(22)00407-6.
Richtlijnen, standaarden en e-learning
- LCI-richtlijn COVID-19.
- RVP-richtlijn Uitvoering RVP.
- The Greenbook Chapter 14a – COVID-19 – SARS-CoV-2.
Websites
- CBG. Vaccins tegen het coronavirus.
- CHOP. Questions and answers about COVID-19 vaccines.
- Comirnaty. Global information about Comirnaty.
- FDA. Comirnaty and Pfizer-BioNTech COVID-19 Vaccine.
- Gezondheidsraad. Strategieën voor COVID-19-vaccinatie.
- KNMG. Veelgestelde juridische vragen en antwoorden over COVID-19-vaccinatie.
- KNVM. COVID-19.
- London School of Hygiene and Tropical Medicine. Vaccine Centre COVID-19 response.
- NIV. Oorzaak bijwerking Astra Zeneca vaccin en behandeling daarvan.
- NVZA. NVZA en COVID-19.
- RIVM. COVID-19.
- RIVM. Coronaprik.
Bijlagen
Bijlage 1. Contactgegevens voor professionals
Voor professionals met uitvoeringsvragen over de COVID-19-vaccinatie is bij het RIVM een speciaal telefoonnummer ingesteld: 088-689 8900. Het nummer voor uitvoeringsvragen is dagelijks bereikbaar. Met behulp van een keuzemenu worden de vragen over de betreffende afdelingen verdeeld:
- Beloptie 1 (08.30-17.00) voor logistieke vragen, cold chain-incidenten en productmeldingen: vragen over het bestellen van vaccins, vaccinlevering, vaccinbeheer, productklachten en vaccinincidenten. Productmeldingen kunnen worden gedaan door een e-mail voorzien van foto’s te sturen naar support.lcc@rivm.nl. Voor urgente situaties bij uitzonderlijke vaccinincidenten is een noodnummer beschikbaar. Het noodnummer is bereikbaar tussen 17:00-20:00 uur. Mocht u daar gebruik van moeten maken, luister dan het gehele bericht onder beloptie 1 voor professionals af.
- Beloptie 2 (08.30-17.00 op werkdagen) voor medisch-inhoudelijke vragen: voor alle medisch-inhoudelijke vragen waarop het antwoord niet te vinden is in deze uitvoeringsrichtlijn COVID-19-vaccinatie of op de webpagina Corona voor professionals op de RIVM-website. Uiteraard is de LCI voor calamiteiten 24/7 bereikbaar voor de dienstdoende arts IZB van de GGD voor overleg.
- Beloptie 3 (08.30-17.00 op werkdagen) voor registratievragen: voor het opvragen van vaccinatiegegevens, voor zover in CIMS geregistreerd.
Het telefoonnummer +3188-689 8900 is ook beschikbaar voor professionals uit het Caribisch deel van het Koninkrijk.
Zorgprofessionals die vragen hebben over hun eigen gezondheidssituatie kunnen contact opnemen met de uitvoerende organisatie (bijvoorbeeld GGD of ziekenhuis).
Bijlage 2. Taakverdeling bij het vaccineren
Binnen de uitvoerende organisatie is een arts verantwoordelijk voor de uitvoering van de COVID-19-vaccinaties. De arts kan het toedienen van de vaccinaties delegeren aan de verpleegkundige. De opdrachtverlening en bevoegdheid moeten geregeld zijn in de eigen uitvoerende organisatie. Zie voor meer informatie over welke zorgverleners (zelfstandig) bevoegd zijn om te vaccineren het nieuwsbericht op de BIG-website, voor een overzicht van alle voorbehouden handelingen en welke beroepsgroep deze uit mag voeren de webpagina van de Rijksoverheid en het NVAB-standpunt Taakdelegatie.
De verpleegkundige heeft een functionele zelfstandige bevoegdheid en mag de voorbehouden handeling ‘vaccineren’ zelfstandig uitvoeren, mits aan een aantal voorwaarden is voldaan:
- De verpleegkundige houdt zich strikt aan de landelijke uitvoeringsrichtlijn COVID-19.
- De verpleegkundige vaccineert volgens het COVID-19-vaccinatieschema van het betreffende vaccin, daarbij de kaders hanterend.
- Voor iedere vaccinatie wordt d.m.v. een aantal vragen (intake/gezondheidsvragenlijst) nagegaan of de vaccinatie kan worden toegediend.
- De arts moet door de verpleegkundige worden geraadpleegd in bijzondere situaties en bij vragen waarover de uitvoeringsrichtlijn COVID-19 vaccinatie geen eenduidige oplossing biedt.
- De verpleegkundige is deskundig en bekwaam (art. 35 Wet BIG) en in het BIG-register ingeschreven.
- Autorisatie door de arts voor de uitvoering van COVID-19-vaccinatie door de verpleegkundige is goed geborgd binnen de organisatie.
De intake/gezondheidsvragenlijst bevat in ieder geval de volgende onderwerpen:
- absolute contra-indicaties:
allergie voor een van de bestanddelen van het vaccin of zeer ernstige allergische reactie na een eerdere toediening van hetzelfde vaccin; - tijdelijke of relatieve contra-indicaties:
koorts >38°C, geplande operatie onder narcose op korte termijn; - zwangerschap;
- indicatie voor extra voorzorgsmaatregelen:
verhoogde bloedingsneiging of gebruik antistolling, prikangst of neiging tot flauwvallen, vragen van persoon zelf of diens verzorger/begeleider. Een anafylactische reactie na een ander vaccin, medicijn of voedingsmiddel is geen contra-indicatie voor een COVID-19-vaccinatie, maar wel een reden om als voorzorgsmaatregel een wat langere observatieperiode van 30 minuten na de vaccinatie in acht te nemen (bron: CDC MMWR report).
De verpleegkundige overlegt met de arts bij alle situaties waarin zich nieuwe (medische) vragen of zorgen voordoen die mogelijk van invloed zijn op het vaccineren. Dit is bijvoorbeeld bij heftige bijwerkingen na de vorige vaccinatie, nieuwe aandoeningen of nieuwe vragen die de verpleegkundige niet zelf kan beantwoorden.
Als de verpleegkundige een arts heeft geraadpleegd, wordt de naam van deze arts zo nodig vastgelegd in het patiëntdossier met het advies dat gegeven is.
Doktersassistenten en andere professionals met een mbo-opleiding (met uitzondering van verpleegkundigen) of eenjarige hbo-opleiding zoals praktijkondersteuners bedrijfsarts (POB) hebben volgens de Wet BIG geen functioneel zelfstandige bevoegdheid voor het uitvoeren van voorbehouden handelingen, zoals het geven van vaccinaties. Zij mogen indien zij daartoe bekwaam zijn, wel vaccinaties uitvoeren in opdracht en aanwezigheid van een arts. De uitvoerende organisatie zal instaan voor de aanwezigheid van een arts indien door niet zelfstandig bevoegden gevaccineerd wordt.
De uitvoerende organisatie is eindverantwoordelijk voor het inrichten van het vaccinatieproces binnen de eigen organisatie en voor het laatste stuk in de keten van het vaccinbeheer (zie hoofdstuk 8). Iedere uitvoerende organisatie beschikt over een vaccinverantwoordelijke. De praktische uitwerking van deze richtlijn is aan de uitvoerende partijen zelf, kan per beroepsgroep enigszins verschillen en valt buiten deze richtlijn.
Het RIVM ondersteunt zo nodig bij vragen over de vaccinatie. Het toedienen van COVID-19-vaccinaties buiten de kaders van de Richtlijn Uitvoering COVID-19-vaccinatie is alleen toegestaan na overleg met het RIVM. Het RIVM is bereikbaar via 088-689 8900.
Er wordt een registratiekantoor opgezet (op RIVM-DVP-regiokantoren) dat vragen beantwoordt over vaccinaties van specifieke burgers (er moet dan in CIMS-dossier gekeken worden).
Met vragen over vaccins en vaccinincidenten en vaccinbeheer kunnen professionals terecht bij RIVM-DVP/LCC via telefoonnummer 088-689 8900.
Bijlage 3. Beschikbare spuiten en naalden
Onderstaande producten worden door het RIVM geleverd.
Niet alle spuiten en naalden kunnen met elkaar gecombineerd worden of zijn geschikt voor elk vaccin. De bevoorrading houdt hier in principe rekening mee. In de instructies voor het klaarmaken van het vaccin staat vermeld welke naalden en spuiten gebruikt moeten worden.
Optreknaalden
De beschikbare optreknaalden hebben allemaal een rode of roze kleur. Onderstaande optreknaalden worden uitgeleverd:
- SOL-M blunt fill needle 18Gx1 ½” (40 mm), ref 110022
- BERPU blunt needle, 18GX1½", (LOT 210401 / LOT 210502)
Optrekspuiten
Toedieningsspuiten
SOL-M LDS of ULDS 1 ml, ref P180001PP
Zero residual 0,3 ml (SJJ), ref ZRS03B
Toedieningsnaalden
-
Veilige naaldsystemen

BD Eclipse needle 23G x 1” (25mm), ref 305892
-
Low dead space toedieningsnaalden
Zero Residual 23G x 1”(25mm) (SJJ), ref ZRN2301
Bijlage 4. Voorbeeld van een protocol voor ernstige acute bijwerkingen na vaccinatie
LCR-protocol Bijwerkingen, syncope en anafylactische reacties na vaccinatie en venapunctie
LCR februari 2021
1. Inleiding
Naast gewenste effecten kunnen na vaccinatie ook ongewenste verschijnselen optreden. Een deel kan toegeschreven worden aan het toegediende vaccin, dit worden bijwerkingen genoemd. Een ander deel treedt toevallig tegelijkertijd op en dit worden coïncidentele verschijnselen genoemd.1 Van een bijwerking is pas sprake als na evaluatie van de klachten en symptomen een causaal verband met het toegediende vaccin niet uitgesloten kan worden. Niet-ernstige ongewenste verschijnselen na vaccinatie of venapunctie komen relatief vaak voor. Ernstige ongewenste verschijnselen zijn relatief zeldzaam. Ongewenste verschijnselen na vaccinatie of venapunctie zijn arbitrair in drie groepen te verdelen.
1.1 Niet-ernstige ongewenste verschijnselen na vaccinaties
De volgende niet-ernstige ongewenste verschijnselen na vaccinaties komen relatief vaak voor1,2
- lokale bijwerkingen: pijn, roodheid en zwelling rondom de injectieplaats.
- andere bijwerkingen: koorts gedurende 24 tot 48 uur na injectie en bij levend verzwakte vaccins 5 tot 12 dagen na injectie, hoofdpijn, moeheid en flauwvallen/syncope (zie paragraaf 3 van deze bijlage).
1.2 Ernstige ongewenste verschijnselen na vaccinaties
De volgende ernstige ongewenste verschijnselen na vaccinaties komen zelden voor1
- lokale bijwerking: abces (zelden).
- systemische bijwerking: anafylaxie (zeer zelden; zie paragraaf 4 van deze bijlage).
- overige ernstige ongewenste verschijnselen: zie protocol en SPC-tekst van gebruikt vaccin.
1.3 Niet-ernstige ongewenste verschijnselen na venapunctie
De volgende niet-ernstige ongewenste verschijnselen van venapunctie komen relatief vaak voor
- lokale bijwerkingen: hematoom rondom de insteekopening van de naald, roodheid rondom de insteekopening van de naald.
- systemische bijwerkingen: flauwvallen/syncope (zie paragraaf 3 van deze bijlage).
2. Onwel na vaccinatie: hoe te handelen?
2.1 Hoe te handelen bij ongewenste verschijnselen na vaccinatie
Wat ter plekke de beste handelswijze is in geval van ernstige ongewenste verschijnselen na vaccinatie hangt onder andere af van de setting waarin gevaccineerd wordt, wie (arts of verpleegkundige) verantwoordelijk is voor het afhandelen van de ongewenste verschijnselen en van de protocollen van de plaatselijke ambulancedienst of het ziekenhuis waarin eventuele vervolgopvang plaatsvindt. Men dient in overleg met betrokken partijen een eigen protocol op te stellen. Deze protocollen en alle overige noodprocedures moeten door alle partijen doorgenomen worden en jaarlijks geoefend worden. De werkgever is hiervoor verantwoordelijk.
2.2 Verantwoordelijkheid en bevoegdheid
De beoordeling van de ernst van een ongewenst verschijnsel of calamiteit is voorbehouden aan een arts, maar kan onder bepaalde voorwaarden aan een verpleegkundige worden overgelaten. Zie de ‘Kwaliteitscriteria advisering en immunisatie van reizigers voor vaccinatiebureaus’ op de website van het LCR.
Omdat het risico van anafylaxie uitermate klein is, is het onder bepaalde voorwaarden aanvaardbaar de komst van een ambulance af te wachten. Het stellen van een diagnose en het inzetten van een behandeling is voorbehouden aan een (bekwaam) arts en mag nooit door verpleegkundigen overgenomen worden omdat deze hier niet toe bevoegd zijn. Verpleegkundigen zijn wel bevoegd om BLS te starten.
2.3 Triage
In die gevallen waar een verpleegkundige verantwoordelijk is voor het afhandelen van ongewenste verschijnselen na vaccinatie op het vaccinatiebureau, moet voorafgaand aan het spreekuur of consult triage plaatsvinden, zodat reizigers met een verhoogd risico in aanwezigheid van een arts gevaccineerd kunnen worden.
De volgende groepen mogen alleen gevaccineerd worden op een spreekuur waar een arts aanwezig is die bekwaam is in de beoordeling van en eerste behandeling bij calamiteiten:
- Personen met een verhoogd risico op ongewenste verschijnselen na vaccinatie (zie specifieke vaccinatieprotocollen).
- Personen bij wie een anafylactische reactie ernstiger kan verlopen, bijv. personen die bètablokkers gebruiken of personen die lijden aan astma bronchiale. Er is weinig klinisch bewijs voor een ernstiger beloop maar bètablokkers kunnen mogelijk het effect van adrenaline antagoneren.3-5
2.4 Aandachtspunten bij het handelen
In geval van afwezige of falende ademhaling en/of circulatie moet met spoed de ambulance ingeschakeld worden en moet gestart worden met reanimatie.
Bij het inschakelen van de ambulance moet systematisch informatie gegeven worden over de toestand van de vitale functies (ABCDE, zie toelichting), relevante medische voorgeschiedenis, relatie met vaccinatie en de waarschijnlijkheidsdiagnose.
Voor een adequate handelswijze bij reanimatie wordt verwezen naar het lokale protocol dan wel de protocollen van de plaatselijke ambulancedienst of het ziekenhuis waarin eventuele vervolgopvang plaatsvindt. Tevens is informatie te vinden in de Richtlijnen reanimatie van de Nederlandse Reanimatie Raad.6
3. Syncope (flauwvallen)
3.1 Flauwvallen (vasovagale collaps)
Collaberen tijdens of vlak na vaccinatie of venapunctie zal meestal een vasovagale reactie zijn. Een vasovagale collaps kan voor de betrokkene zelf onverwacht optreden. Het herstel kan soms lang (≥1 uur) duren.
3.2 Symptomen flauwvallen
- bleke en klamme huid
- koude extremiteiten
- langzame pols (<80/min)
- hypotensie
- duizeligheid
- slapte
- hypotonie
- gapen
- wegdraaiende ogen
- zwarte vlekken voor de ogen
- misselijkheid en braakneigingen
- spiertrekkingen
- incontinentie
- bewustzijnsdaling
3.3 Maatregelen bij flauwvallen
- Leg de zittende patiënt plat neer.
- Laat de patiënt niet te snel opstaan omdat dan opnieuw collaps kan optreden, waarbij de patiënt zich kan bezeren.
- Controleer vitale functies, bewustzijn en kenmerken van matige/ernstige reactie en handel naar gelang bevindingen.
- Overweeg de patiënt naar de Spoed Eisende Hulp te verwijzen indien bij collaps hoofdletsel is ontstaan, met name indien sprake is van gebruik van antistollingsmedicatie.
4. Anafylactische reactie na vaccinatie
4.1 Anafylactische reactie
Bij een anafylactische reactie na vaccinatie wordt de patiënt veelal angstig en soms geagiteerd. In ernstige gevallen zijn er tekenen van shock.7
4.2 Symptomen van anafylaxie7
Symptomen van anafylaxie kunnen zijn:
- stridor
- bronchospasme
- shock (rode, klamme en warme huid, met name aan de extremiteiten, rillerig, snelle en weke pols, lage tensie)
- angio-oedeem
- zwelling neusslijmvlies
- jeukend of tintelend gevoel in de mond, met name verhemelte en tong; later hele lichaam
- urticaria
- jeuk/erytheem
- mictie- en/of defaecatiedrang
- misselijkheid/buikpijn/braken
4.3 Maatregelen bij ernstige bijwerkingen
- Patiënt neerleggen
- Vitale functies controleren volgens ABCDE-schema, zie toelichting. Handelen naar eigen bevinden en bevoegdheid
- Ambulance (tel: 112) of reanimatieteam laten bellen en informeren over vitale functies, relevante medische voorgeschiedenis en waarschijnlijkheidsdiagnose
- Regelmatig pols en tensie meten, houd de gegevens bij op een lijst
- Bij systemische reacties zo nodig medicatie toedienen (alleen door een bekwaam arts)7-10
4.4 Handelen bij anafylaxie
De beoordeling en beslissing om medicijnen toe te dienen mag alleen door een arts genomen worden.7-10 Er dient een duidelijk lokaal calamiteitenprotocol opgesteld te zijn, gebaseerd op de aard en setting van de vaccinatielocatie. Een suggestie voor een protocol vindt u in de referenties.8 De inhoud van dit protocol dient bekend te zijn bij de medewerkers van het vaccinatiebureau. De werkgever is hiervoor verantwoordelijk.
5. Bijwerkingen melden
5.1 Opsporen en melden bijwerkingen
Tijdens elke intake moet nadrukkelijk naar eerder opgetreden bijwerkingen geïnformeerd worden. Deze vraag is opgenomen in het intakeformulier. Zie LCR-protocol ‘Inhoud reizigersconsult’.
Bijwerkingen moeten gemeld worden bij Bijwerkingencentrum Lareb: www.lareb.nl.
5.2 Overleg en advies over bijwerkingen
Voor overleg en advies over bijwerkingen van vaccinaties en geneesmiddelen kan contact worden opgenomen met de helpdesk van Bijwerkingencentrum Lareb. De helpdesk is op werkdagen bereikbaar van 9.00 tot 17.00 uur (tel: 073-646 9700). Ook is het centrum te bereiken per e-mail: info@lareb.nl.
Toelichtingen
Toelichting ABCDE-schema:
| A | Airway | vrij of niet? Indien niet: hoofd- kantel-kinliftmethode |
|---|---|---|
| B | Breathing | stridor, diepte van de ademhaling, gebruik van hulpademhalingsspieren |
| C | Circulation | huidskleur, tensie, pols- frequentie (regelmatig, vulling) |
| D | Disability | alert, reageert op aanspreken of pijn, reageert niet |
| E | Exposure | huidreacties, slijmvliesreacties |
Referenties bijlage 4
- Burgmeijer R, Hoppenbrouwers K. Handboek vaccinaties theorie en uitvoeringspraktijk deel A. 2e ed. Assen: Koninklijke van Gorcum, 2011. Hoofdstuk 7; p155.
- Rümke HC. Postvaccinatie verschijnselen: prikplaatsreacties en reactogeniciteit. Tijdschrift voor Jeugdgezondheidszorg 2016:48(6):50-56.
- Jacobs RL, Rake GW, Fournier DC et al. Potentiated anaphylaxis in patients with drug-induced beta-adrenergic blockade. J Allergy Clin Immunol 1981; 68: 125-7.
- Tejedor-Alonso MA, Farias-Aquino E, Pérez-Fernández E et al. Relationship Between Anaphylaxis and Use of Beta-Blockers and Angiotensin-Converting Enzyme Inhibitors: A Systematic Review and Meta-Analysis of Observational Studies. J Allergy Clin Immunol Pract. 2019 Mar;7(3):879-897.
- Clark S, Wei W, Rudders SA, Camargo CA Jr. Risk factors for severe anaphylaxis in patients receiving anaphylaxis treatment in US emergency departments and hospitals. J Allergy Clin Immunol. 2014 Nov;134(5):1125-30.
- Nederlandse reanimatieraad. Richtlijnen Reanimatie in Nederland. Via https://www.reanimatieraad.nl/
- Muraro A, Roberts G, Worm M et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014 Aug;69(8):1026-45.
- Het acute boekje. Nederlandse Internisten Vereniging. Via https://www.hetacuteboekje.nl/
- Ambulancezorg Nederland. Landelijk Protocol Ambulancezorg versie 8.1, herdruk oktober 2019. Via https://www.ambulancezorg.nl/.
- Shaker MS, Wallace DV, Golden DBK et al. Anaphylaxis—a 2020 practice parameter update,systematic review, and Grading of Recommendations, Assessment, Developmentand Evaluation (GRADE) analysis. J Allergy Clin Immunol. 2020 Apr;145(4):1082-1123.
Versiebeheer
- 1 juli 2024: Versie 6.2. De houdbaarheid van de voorraad Nuvaxovid XBB.1.5 (het COVID-19 eiwitvaccin van Novavax) is per 30 juni 2024 verlopen. Nuvaxovid XBB.1.5 is vanaf 1 juli 2024 niet meer beschikbaar in het COVID-19-vaccinatieprogramma. De richtlijn is hierop aangepast.
- 4 april 2024: Versie 6.1. De vaccinatiestrategie is aangepast n.a.v. het advies van de Gezondheidsraad (27 maart 2024). In 2024 is COVID-19-vaccinatie (de coronaprik), buiten een najaarsronde, alleen geïndiceerd voor volwassenen en kinderen uit medische hoogrisicogroepen (als dat geadviseerd wordt door een behandelend arts) en voor personen die op individuele basis door een behandelend arts zijn verwezen voor vaccinatie. COVID-19-vaccinatie wordt niet standaard aan alle zwangeren geadviseerd. Zwangerschap op zich is geen reden voor vaccinatie. In Hoofdstuk 5 is informatie over de bescherming door vaccinatie tegen infectie en post-COVID geactualiseerd.
- 14 maart 2024: Nieuwe versie van de Instructie overgebleven COVID-19-vaccins (onder Downloads).
- 2 januari 2024: Versie 6.0. De vaccinatiestrategie is aangepast n.a.v. het advies van de Gezondheidsraad (juni 2023) en het besluit van de (demissionair) minister van VWS. In 2024 is COVID-19-vaccinatie (de coronaprik), buiten een mogelijke najaarsronde, alleen geïndiceerd voor zwangeren, voor volwassenen en kinderen uit medische hoogrisicogroepen (op advies van een behandelend arts) en voor personen die op individuele basis door een behandelend arts zijn verwezen voor vaccinatie. Informatie over vaccineren tijdens de zwangerschap (voorheen in Hoofdstuk 3) is nu opgenomen in paragraaf 2.4. Hoofdstuk 3 in deze richtlijn (versie 6.0) bevat een overzicht van de medische risicogroep en de medische hoogrisicogroep. In Hoofdstuk 11 is ‘uitnodiging’ veranderd naar ‘verwijzing’, aangezien er geen sprake meer is van een uitnodigingsproces.
De vorige versies (1, 2, 3, 4 en 5) van deze uitvoeringsrichtlijn zijn gearchiveerd. De oude versies blijven via het sitearchief beschikbaar, maar zijn niet meer actueel.