blok
De factsheet geeft de actuele kennis en toepassingsgebieden weer van vaccinaties voor een uniforme werkwijze van zorgprofessionals die betrokken zijn bij advisering omtrent vaccinaties. De factsheet is gebaseerd op recente kennis, inzichten en kwaliteitsdocumenten. Deze factsheet geeft informatie over de geregistreerde vaccins, de toepassingen, eigenschappen, contra-indicaties, vaccinatieschema’s en werkingsduur. Voor meer informatie zie Ontwikkeling factsheets.
Vaststelling en publicatie: 10 juli 2025
Naast de vaste procedure met meelezers vanuit het RIVM (Rijksinstituut voor Volksgezondheid en Milieu ) en NVIB-werkgroep WAV hebben het NHG (Nederlands Huisartsen Genootschap ), Verenso en NVAVG een bijdrage geleverd. De contra-indicaties zoals die gelden voor PCV20 binnen het programmatische aanbod van het NPPV zijn afgestemd met het NHG, Verenso en het NVAVG.
Nieuw en anders in deze factsheet ten opzichte van de oude factsheet:
- Inhoudelijke informatie over de bestaande programma’s toegevoegd (eerder behandelde de factsheet alleen de vaccinatie buiten de programma’s).
- Alle informatie over vaccinatie uit de LCI (Landelijke Coördinatie Infectieziektebestrijding )-richtlijn nu hier geplaatst.
- Nieuwe vaccins toegevoegd en verwerkt in de schema’s.
- Nieuwe medische risicogroepen toegevoegd.
Pneumokokkenvaccinatie biedt bescherming tegen bacteriële infecties veroorzaakt door pneumokokken, zoals invasieve pneumokokkenziekte (IPD). Voor informatie over deze ziekten, zie de LCI-richtlijn Pneumokkenziekte.
Indicaties
Hieronder worden indicaties genoemd die volgen uit een programmatisch aanbod en/of overige indicaties volgend uit bestaande kwaliteitsstandaarden.
Programmatisch aanbod
| Toepassing | Opmerking |
|---|---|
| Programmatisch aanbod - RVP* | Kinderen krijgen de pneumokokkenvaccinatie met PCV15 binnen het RVP op 3, 5 en 12 maanden. Zie voor meer informatie: |
Programmatisch aanbod voor personen van 60 jaar en ouder - NPPV**
| Indicaties voor een vaccinatie met PCV20 binnen het Nationaal Programma Pneumokokkenvaccinatie (NPPV) vanaf 2025 zijn:
Zie voor meer informatie Nationaal Programma Pneumokokkenvaccinatie Volwassenen (NPPV). Vaccinatie tegen pneumokokken binnen het NPPV gebeurt op basis van uitnodiging op leeftijd. Vaccineren op medische indicatie voor bepaalde medische risicogroepen valt niet onder het NPPV. |
Overige indicaties
| Toepassing | Opmerking |
|---|---|
| Medische indicaties1 | De behandelend arts (medisch specialist) indiceert de vaccinatie bij patiënten behorend tot een medische risicogroep. Het betreft groepen met een verhoogd risico op (een ernstig beloop van) een pneumokokkenpneumonie of invasieve pneumokokkeninfectie. De medische risicogroepen zijn:
|
| Beroepsgebonden indicaties | Zie Beroepsinfectieziekte Pneumokokken op KIZA |
| Postexpositieprofylaxe en/of uitbraken | Bij een uitbraak in een instelling met meerdere ziektegevallen kan antibioticaprofylaxe overwogen worden. Overweeg als het gaat om een uitbraak met een serotype dat in één van de vaccins vertegenwoordigd is, ook vaccinatie van personen met een verhoogde kans op een invasieve pneumokokkeninfectie. Zie LCI-richtlijn Pneumokokkenziekte. |
Keuze van het vaccin voor de medische risicogroepen
Bepaalde medische risicogroepen komen op dit moment (juni 2025) in aanmerking voor een vergoeding van een sequentieel pneumokokkenvaccinatieschema. Dit schema bestaat uit éénmalige vaccinatie met het 13-valent of 15-valent pneumokokkenconjugaatvaccin (PCV13 of PCV15) na minimaal 2 maanden gevolgd door het 23-valent pneumokokkenpolysacharidevaccin (PPV23). Zie ook het doseringsschema.
De meeste bestaande richtlijnen voor medische risicogroepen hebben PCV13 nog in hun aanbevelingen staan en hebben PCV15, PCV20 en PCV21 nog niet meegenomen. Na primaire vaccinatie met PCV13 óf PCV15 is voor een bredere dekking een toevoeging van PPV23 nodig. In dat geval werd revaccinatie met PPV23 elke 5 jaar aangeraden voor medische risicogroepen.
Medisch inhoudelijk heeft het echter de voorkeur om medische risicogroepen te vaccineren met het hoogstvalente conjugaatvaccin (in plaats van PCV13/15 + vijfjaarlijks PPV23) (zie vaccinatieadviezen bij Asplenie, Hematologische aandoeningen en Cochleaire Implantaten). Op dit moment (juli 2025) zijn PCV20 of PCV21 de hoogstvalente conjugaatvaccins. Wanneer éénmalig PCV20 óf PCV21 is toegediend aan een persoon die behoort tot de medische risicogroep, is nadien vaccinatie met PCV23 niet meer nodig (zie ook CDC, ACIP en LCI-richtlijn Pneumokokkenziekte). Dat komt omdat PPV23 weinig extra dekking biedt t.o.v. PCV20 of PCV21 en omdat de conjugaatvaccins langduriger bescherming geven. Zie voor meer informatie over de dekking van de vaccins tegen IPD ook het RIVM-rapport The National Immunisation Programme in the Netherlands in 2022-2023.
Vaccinatie met PCV20 of PCV21 wordt op dit moment (juni 2025) extramuraal (nog) niet vergoed voor medische risicogroepen. Het Zorginstituut Nederland heeft de minister van Volksgezondheid, Welzijn en Sport (VWS) geadviseerd om het PCV20-vaccin vanuit het basispakket van de zorgverzekering te vergoeden voor mensen uit medische risicogroepen. Zie Advies 10 juni 2025 Zorginstituut Nederland. De minister zal de uiteindelijke beslissing nemen.
vergoedingen
Vergoedingen vaccinaties
Als er een medische indicatie is voor een vaccin, betekent dat niet dat het daarmee automatisch voor vergoeding in aanmerking komt.
Zie medicijnkosten.nl voor informatie over de kosten en de extramurale vergoeding van vaccins. Vaccinaties voor medische risicogroepen op indicatie van een behandelend arts kunnen vergoed worden via de Zorgverzekeringswet.
Informatie over de vergoeding binnen de medisch-specialistische zorg en de mogelijkheden voor intramurale vergoeding is te vinden op de pagina Vaccinaties binnen de medisch-specialistische zorg (Nederlandse Zorgautoriteit).
Voor algemene vragen over de (intramurale en extramurale) vergoeding van vaccinaties binnen de Zorgverzekeringswet kan men terecht bij Zorginstituut Nederland via vragenaanzin@zinl.nl. Voor voor specifieke vragen kan men terecht bij de individuele zorgverzekeraar.
Op eigen verzoek
Als een persoon buiten de genoemde indicaties valt en - na overleg met huisarts of vaccinatiebureau - het vaccin toch wil krijgen, dan kan dat op eigen kosten via de huisarts, GGD (Gemeentelijke gezondheidsdienst ) of ander vaccinatiebureau.
Bij een individuele afweging voor pneumokokkenvaccinatie moet per persoon worden bekeken wat de voor- en nadelen zijn. Enerzijds moet bekeken worden hoe groot de kans is om (invasieve) pneumokokkenziekte op te lopen en wat de gevolgen hiervan kunnen zijn. Anderzijds moet stilgestaan worden bij de mate van bescherming die de verschillende pneumokokkenvaccins opleveren, de kosten, en de mogelijke bijwerkingen van vaccinatie voor deze persoon. Overwegingen die hierbij een rol kunnen spelen:
- Leeftijd. De kans om IPD te krijgen neemt toe met een hogere leeftijd, met name vanaf 65 jaar.
- Gezondheidstoestand. De aanwezigheid van comorbiditeit(en) als hart- en longziekten, diabetes en andere aandoeningen verhogen de kans op invasieve pneumokokkenziekte (matig verhoogd risico, i.t.t. immuunsuppressie met sterk verhoogd risico). Zie Thorax BMJ 2015 ‘Which individuals are at increased risk of pneumococcal disease and why?’ en het RIVM-rapport Pneumococcal vaccination in older adults.
- De ernst van een IPD en de kans op overlijden. Ook van de personen die een invasieve pneumokokkenziekte overleven, blijft een deel ernstige klachten (restverschijnselen) houden. Zie LCI-richtlijn Pneumokokkenziekte.
- Breedte van de dekking en serotypen waartegen de vaccins bescherming bieden. Zie Geregistreerde vaccins. PCV21 heeft de meest optimale samenstelling qua dekking voor ernstige pneumokokkenziekte bij volwassenen.
- Vaccineffectiviteit. Conjugaatvaccins zouden bij mensen van 60 jaar en ouder effectiever zijn dan polysacharidevaccins in het tegengaan van IPD en niet-invasieve pneumokokkenlongontsteking (Gezondheidsraad 2023). Zie Effectiviteit.
- Werkingsmechanisme en beschermingsduur. Na vaccinatie met een conjugaatvaccin wordt er immunologisch geheugen opgebouwd, waardoor er langdurige bescherming is en revaccinatie met eenzelfde conjugaatvaccin bij volwassenen vooralsnog niet nodig is. Bij PPV23 wordt er geen immunologisch geheugen opgebouwd en is na 5 jaar revaccinatie geadviseerd.
- Contra-indicaties en mogelijke bijwerkingen van vaccinatie.
- De kosten van de vaccins zijn te vinden op www.medicijnkosten.nl.
Geregistreerde vaccins
In onderstaande tabel staan de pneumokokkenvaccins die in Nederland geregistreerd zijn.
| Merknaam + link bijsluiter | Serotypen | Leeftijd en bijzonderheden |
|---|---|---|
| PCV | ||
| Synflorix (PCV10) Bijsluiter en SmPC-tekst | 1, 4, 5, 6B, 7F, 9V 14, 18C, 19F 23F | 6 weken tot 5 jaar |
| Prevenar 13 (PCV13) Bijsluiter en SmPC-tekst | 1, 3, 4, 5, 6A, 6B, 7F, 9V 14, 18C, 19A, 19F 23F | Vanaf 6 weken |
| Vaxneuvance (PCV15) Bijsluiter en SmPC-tekst | 1, 3, 4, 5, 6A, 6B, 7F, 9V 14, 18C, 19A, 19F 22F, 23F en 33F | Vanaf 6 weken Wordt sinds het derde kwartaal van 2024 gebruikt in het RVP |
| Prevenar 20 (PCV20) Bijsluiter en SmPC-tekst | 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A 11A, 12F, 14, 15B, 18C, 19A, 19F 22F, 23F en 33F | Vanaf 6 weken Wordt vanaf 2025 gebruikt in het NPPV |
| Capvaxive (PCV21) Bijsluiter en SmPC-tekst | 3, 6A, 7F, 8, 9N, 10A 11A, 12F, 15A, 15B, 16F, 17F, 19A, 20A, 22F, 23A, 23B, 24F en 31, 33F, 35B | Vanaf 18 jaar Samenstelling verschilt van de andere conjugaatvaccins |
| PPV | ||
| Pneumovax 23 (PPV23) Bijsluiter en SmPC-tekst | 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F 20, 22F, 23F en 33F | Vanaf 2 jaar |
Voor een volledig overzicht van bestanddelen, zie SmPC-tekst. Voor actueel een overzicht van de vaccins zie Geneesmiddeleninformatiebank. Houd er rekening mee dat wanneer een vaccin geregistreerd is, dit niet automatisch betekent dat het ook verkrijgbaar is in Nederland.
Eigenschappen vaccins
Er zijn momenteel twee soorten pneumokokkenvaccins beschikbaar: het pneumokokkenpolysacharidevaccin (PPV) en de pneumokokkenconjugaatvaccins (PCV). Beide soorten vaccins zijn gebaseerd op het kapselpolysacharide van pneumokokken als antigeen. In de conjugaatvaccins is deze gekoppeld aan een carrier eiwit. Het zijn niet levende vaccins.
Polysacharidevaccins
Dit vaccin bevat stukjes van het polysacharidekapsel van de bacterie als antigeen om een immuunrespons op te wekken. Bij de immuunrespons zijn geen T-cellen betrokken, enkel B-cellen uit een bestaande B-cel-pool die antistoffen gaan maken. Er wordt geen nieuw immunologisch geheugen opgebouwd en daarmee is ook de beschermingsduur beperkt. Daarom is revaccinatie met PPV23 nodig.
Polysacharide-antigenen zijn slecht immunogeen bij kinderen jonger dan 2 jaar, omdat het immuunsysteem onder die leeftijd nog niet voldoende gerijpt is. Pas vanaf de leeftijd van 5 jaar is de immuunrespons op polysacharidevaccins voldoende voor de verschillende serotypen. Deze is pas optimaal bij vanaf de puberteit bij jonge, gezonde volwassenen.
Er zijn aanwijzingen voor een verminderde antistofrespons na herhaalde revaccinatie met PPV23, zogeheten hyporesponsiviteit, vooral indien er een kort interval is tussen de twee vaccinaties. Zie voor meer informatie over hyporesponsiviteit beschermingsduur en revaccinatie.
Conjugaatvaccins
Bij deze vaccins worden de polysacharideantigenen gekoppeld aan een dragereiwit (conjugatie) om een T-cel-afhankelijke afweerrespons op te wekken. Hierbij wordt ook een immunologisch geheugen opgebouwd. De conjugaatvaccins geven langdurige bescherming. Meer data over de duur van de effectiviteit zal nog volgen met de tijd. Conjugaatvaccins zijn vanaf zeer jonge leeftijd immunogeen.
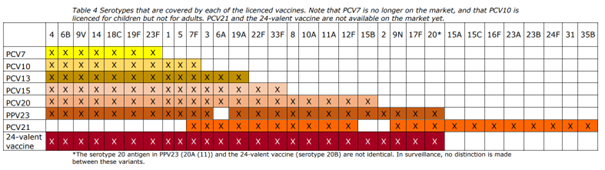
Figuur: Overzicht conjugaatvaccins en de serotypes die zij coveren
Bron RIVM-rapport Pneumococcal vaccination in older adults
Doseringsschema
| Vaccin(type) | Leeftijdsgroep | Primaire serie en evt. revaccinatie |
|---|---|---|
| Polysacharidevaccin | ||
| Pneumovax 23 (PPV23) | Vanaf de leeftijd van 2 jaar | Enkele dosis subcutaan of intramusculair. Elke 5 jaar revaccinatie. N.B.: voor kinderen 2 – 10 jaar geldt een ander interval tot revaccinatie, zie SmPC tekst. |
| Conjugaatvaccins | ||
| Synflorix (PCV10) | Kinderen van 6 weken tot 5 jaar | Primaire serie bestaande uit meerdere intramusculaire doses, zie SmPC. |
| Prevenar 13 (PCV13) | Kinderen van 6 weken tot 2 jaar | Primaire serie bestaande uit meerdere intramusculaire doses, zie SmPC |
| Vanaf de leeftijd van 2 jaar | Eenmalig dosis intramusculair | |
| Vaxneuvance (PCV15) | Kinderen van 6 weken tot 2 jaar | Primaire serie bestaande uit meerdere intramusculaire doses, zie RVP uitvoeringsrichtlijn. |
| Vanaf de leeftijd van 2 jaar | Eenmalig dosis intramusculair | |
| Prevenar 20 (PCV20) | Kinderen van 6 weken tot 2 jaar | Primaire serie bestaande uit meerdere intramusculaire doses, zie SmPC |
| Vanaf de leeftijd van 2 jaar | Eenmalig dosis intramusculair | |
| Capvaxive (PCV21) | Vanaf de leeftijd van 18 jaar | Eenmalig dosis intramusculair |
Interval met eerdere pneumokokkenvaccinaties
- Er geldt een minimuminterval van 8 weken tussen eerdere toediening van PCV13 of PCV15 en het toedienen van PPV23 (Asplenie richtlijn).
- Er geldt een minimuminterval van 1 jaar tussen eerdere PPV23 en het toedienen van een pneumokokkenconjugaatvaccin (ACIP).
- Er geldt een minimuminterval van 8 weken tussen het toedienen van 2 pneumokokkenconjugaatvaccins (Canadian Immunization Guide).
Tabel A Intervallen NPPV geeft een overzicht van de geadviseerde intervallen tussen eerder ontvangen pneumokokkenvaccinatie(s) en het toedienen van PCV20 voor personen van 60 jaar en ouder binnen het NPPV. Dit is vooral pragmatisch gekozen voor de uitvoering in de praktijk van het NPPV. Zie ook NHG-praktijkhandleiding pneumokokkenvaccinatie en Werkinstructie PCV20 zorgorganisaties NPPV.
Tabel B Intervallen medische risicogroepen geeft een overzicht van de geadviseerde vaccinatie(schema’s) en intervallen voor de vaccinatie van medische risicogroepen. Hiervoor bestaan er twee opties:
- Eenmalige vaccinatie met PCV20 óf PCV21. Dit heeft de voorkeur boven het vaccinatieschema PCV13/15 + vijfjaarlijks PPV23 (zie ‘Keuze van het vaccin voor de medische risicogroepen’).
- Vaccinatieschema met conjugaatvaccin PCV13 of PCV15 en vijfjaarlijks het polysacharidevaccin PPV23. Deze optie wordt momenteel (juni 2025) vergoed voor diverse medische risicogroepen. In dit geval is het advies te starten met het conjugaatvaccin en na een minimuminterval van 2 maanden het polysacharidevaccin toe te dienen. Als het polysacharidevaccin eerder is toegediend dan PCV, wordt een interval van minimaal 1 jaar tussen het polysacharidevaccin en een conjugaatvaccin geadviseerd. Zie voor meer informatie de paragraaf over hyporesponsiviteit. Houd voor kinderen rekening met de toedieningsleeftijd en herhalingsschema voor PPV23, zie Doseringsschema.
Ook voor personen die behoren tot een medische risicogroep en het schema PCV13/PCV15 + 5-jaarlijks PPV23 volgden geldt dat, afhankelijk van de immuunstatus van de patiënt, met éénmalige toediening van PCV20 óf PCV21 kan worden volstaan en er nadien geen PPV23 meer hoeft te worden toegediend (ACIP). Echter, bij ernstige immuunsuppressie kan de arts op indicatie wel een herhaling van een conjugaatvaccin adviseren.
| Optie 2: Vaccinatieschema PCV13/15 + PPV23 Conjugaatvaccin (PCV13 óf PCV15) gevolgd door 5-jaarlijks polysacharidevaccin (PPV23) voor medische risicogroepen. | |
|---|---|
| Vaccinatiemoment | Vaccinatie |
| 0 maanden | Eénmalig toedienen van PCV13 óf PCV15 |
| 2 maanden | Toedienen PPV23 (er geldt een minimuminterval van 2 maanden ná PCV13/15) |
| 5 jaarlijks | Elke 5 jaar de vaccinatie met PPV23 herhalen |
Contra-indicaties
Absolute contra-indicaties
- Een bevestigde ernstige allergie voor één van de bestanddelen (o.a. het difterietoxoïd bij conjugaatvaccins), zie de betreffende SmPC teskt.
- Aangetoonde ernstige en/of onmiddellijke allergische reactie na een eerdere toediening van hetzelfde vaccin (of in geval van een conjugaatvaccin een ander vaccin dat ook het difterietoxoïd bevat).
Relatieve contra-indicaties
- Toediening dient te worden uitgesteld bij personen die lijden aan een koortsende ziekte (38,5 graden of hoger).
- Een te kort interval: Houd het juiste interval aan tussen eerder ontvangen pneumokokkenvaccinatie(s), zie tabel A of tabel B hierboven.
Hieronder zijn de absolute en relatieve contra-indicaties opgenomen zoals die gelden voor PCV20 binnen het programmatische aanbod van het NPPV. Deze absolute en relatieve contra-indicaties voor PCV20 binnen het NPPV zijn in overleg met NHG, Verenso, NVAVG en RIVM (Rijksinstituut voor Volksgezondheid en Milieu ) tot stand gekomen. Zie ook Werkinstructie PCV20 zorgorganisaties NPPV en NHG-praktijkhandleiding pneumokokkenvaccinatie.
Absolute contra-indicaties voor PCV20 binnen het NPPV:
- Een eerdere, ernstige allergische reactie op een vaccin met dezelfde werkzame stoffen/hulpstoffen/adjuvans als PCV20 is een absolute contra-indicatie. Bekende allergenen in PCV20 zijn polysorbaat 80 en het difterietoxoïd (CRM197). Difterietoxoïd wordt in meerdere vaccins als conjugaat gebruikt (zie voor vaccins dat het difterietoxoïd bevatten tabel 2 in de NHG praktijkhandleiding).
- Een persoon met een bekende ernstige allergische reactie op een bestanddeel van PCV20. Bekende allergenen in PCV20 zijn het difterietoxoïd en Polysorbaat 80. Zie ook de SmPC-tekst.
Relatieve contra-indicaties voor PCV20 binnen het NPPV:
- Een te kort interval: Houd het juiste interval aan tussen eerder ontvangen pneumokokkenvaccinatie(s) en PCV20 binnen het NPPV, zie tabel A hierboven.
- Stollingsstoornissen: PCV20 dient intramusculair te worden toegediend. Zie voor de adviezen bij stollingsstoornissen en het gebruik van antistollingsmedicatie de Praktijkhandleiding Pneumokokkenvaccinatie en de Werkinstructie Instellingen. Subcutane toediening kan bij PCV20 wel worden overwogen indien het potentiële voordeel duidelijk opweegt tegen de risico’s, zie SmPC-tekst.
- Acute ziekte en/of koorts: De vaccinatie dient te worden uitgesteld bij personen die aan een acute, ernstige ziekte en/of koorts lijden totdat de persoon koortsvrij is. De aanwezigheid van een milde infectie zoals een verkoudheid, is echter geen reden om vaccinatie uit te stellen.
- Anesthesie: Een geplande medische ingreep onder volledige anesthesie kan een reden zijn om de vaccinatie uit te stellen. Vaak wordt een interval van minimaal 48 uur tussen geïnactiveerd vaccin en anesthesie gehanteerd.
- Actieve of recente behandeling met chemotherapie: Pneumokokkeninfecties zijn, anders dan influenza-infecties, minder seizoensgebonden en een pneumokokkenvaccinatie kan daarom gedurende het hele jaar worden toegediend. De timing van de vaccinatie kan, indien mogelijk, worden afgestemd op de inname van medicatie (chemotherapie) ten behoeve van de vaccinatierespons. Vanwege het nadelig effect op de vaccinatierespons wordt PCV20 bij voorkeur ten minste 2 weken vóór start van de chemotherapie gegeven of uitgesteld tot minimaal 3 maanden na afronding van de behandeling. PCV20 kan tijdens een behandeling met chemotherapie wel veilig worden toegediend. Overleg met de behandelend specialist wat het beste moment is voor de pneumokokkenvaccinatie.
- Recente beenmergtransplantatie: Voor patiënten die recentelijk een beenmergtransplantatie hebben ondergaan, is het aan de medisch specialist om te bepalen wat het juiste moment is om te vaccineren tegen pneumokokken.
Interferenties
Bij toediening van een pneumokokkenvaccin hoeft geen specifiek interval gehanteerd te worden met het seizoensgebonden influenzavaccin of het COVID-19-vaccin (Gezondheidsraad 2023, LCI-uitvoeringsrichtlijn COVID-19-vaccinatie).
Bij gebrek aan onderzoek naar onverenigbaarheden, mogen de vaccins niet met andere vaccins of andere geneesmiddelen gemengd worden. Verschillende vaccins dienen altijd op verschillende vaccinatieplaatsen te worden toegediend.
Er zijn aanwijzingen dat gelijktijdige toediening van een pneumokokkenconjugaatvaccin en een hepatitis A-vaccin de immuunrespons op het hepatitis A-vaccin kan verminderen (Riekkinen 2023, Schnyder 2025).
Veiligheid en bijwerkingen
Vaccinatie tegen pneumokokken is veilig bevonden (Bonten 2015, Greenberg 2014, Jackson 2013a, Jackson 2013b, Schwartz 2011). Zoals bij alle vaccinaties kunnen milde bijwerkingen worden verwacht. Binnen 48 uur na vaccinatie wordt vaak een lokale reactie (erytheem, pijn, zwelling) gezien. Algemene reacties (koorts, spierpijn) komen bij het polysacharidevaccin minder vaak voor dan bij het conjugaatvaccin (Namkoong 2015, Jackson 2013). Ernstige allergische reacties komen zeer zelden voor.
Zie voor het volledige overzicht van de bijwerkingen de bijsluiters van de vaccins en Lareb.nl.
content bijwerkingen
Zie voor het volledige overzicht van de bijwerkingen de bijsluiters van de vaccins. Zie ook bijwerkingencentrum Lareb.
Zorgprofessionals en niet-zorgprofessionals kunnen contact opnemen met Lareb voor het melden van postvaccinale verschijnselen/bijwerkingen. Dit kan via een meldformulier op de website van Lareb: www.lareb.nl.
Lareb geeft geen medisch advies. Bij gezondheidsklachten of vragen wordt geadviseerd contact op te nemen met de arts of apotheker.
Effectiviteit
De effectiviteit van vaccinaties wordt bepaald op populatieniveau waarbij gekeken wordt naar het voorkomen van ziekte bij een groep gevaccineerde personen versus een groep ongevaccineerde personen. De effectiviteit is nooit 100 procent en in individuele gevallen kan het zijn dat er geen beschermende immuunrespons optreedt (is primair vaccinfalen = het niet ontwikkelen van beschermende antistoffen na vaccinatie).
Introductie van pneumokokkenvaccinatie met PCV7 en later PCV10 voor kinderen binnen het Rijksvaccinatieprogramma, heeft ervoor gezorgd dat er, naast minder ziekte, ook minder dragerschap en verspreiding van vaccintype pneumokokken voorkomt. Ook bij ouderen heeft dit een afname van ziektegevallen door vaccintype pneumokokken veroorzaakt. Echter, serotypen die niet in het vaccin voorkomen, nemen weer wat toe. Dit zorgt er ook voor dat de dekking van PCV10 en PCV13 bij ouderen de laatste jaren is afgenomen. De dekking van PPV23 neemt juist toe met de tijd.
Polysacharidevaccin
De vaccineffectiviteit voor preventie van invasieve ziekten door vaccinserotypen wordt geschat op 40-75 procent (Wang 2018, Fedson 1999, Fine 1994, Mangtani 2003, Melegaro 2004). De Gezondheidsraad hanteert een conservatieve schatting van 37 procent effectiviteit op IPD.
De vaccineffectiviteit neemt af naarmate iemand ouder wordt, waarschijnlijk als gevolg van veranderingen in het antilichaamrepertoire en/of een vermindering in IgM (immunoglobuline M )-antilichaamproductie geassocieerd met verouderingsafhankelijke veranderingen in B- en T-cel-subpopulaties (Wang 2018, Ruben 1985). Een Engels onderzoek in 2018 liet zien dat de impact van PPV23 bij 65-plussers afneemt met de tijd: van 41% reductie van invasieve pneumokokkenziekte binnen 2 jaar na vaccinatie tot 34% 2-4 jaar na vaccinatie, tot slechts 23% bij diegenen die langer dan 5 jaar geleden gevaccineerd zijn (Djennad 2018).
Immunosuppressieve behandelingen kunnen de immuunrespons op het vaccin verminderen.
Conjugaatvaccin
Conjugaatvaccins zijn bij mensen van 60 jaar en ouder effectief in het tegengaan van invasieve ziekten door vaccinserotypen IPD en niet-invasieve pneumokokkenlongontsteking. Een groot Nederlands gerandomiseerd onderzoek naar de effectiviteit van het conjugaatvaccin PCV13 onder bijna 85.000 immuuncompetente 65-plussers die gevaccineerd zijn met PCV13 in de periode 2008-2011 (CAPiTA-studie) liet een vaccineffectiviteit van 37,5 en 75 procent zien ter bescherming van respectievelijk pneumokokkenpneumonie en invasieve pneumokokkeninfectie tegen de vaccinserotypen (Van Werkhoven 2015, Bonten 2015a, Bonten 2015b, Hak 2008). Tegen elke pneumokokkenpneumonie, ongeacht het serotype, was dit 22,4 procent.
PCV15 en PCV20 zijn geregistreerd op basis van antistoffen in vergelijking met PCV13 en PPV23 (immuno-bridging). Er zijn nog geen klinische effectiviteitsdata beschikbaar. Deze volgen pas enige tijd nadat de vaccins in de nationale vaccinatieprogramma’s zijn opgenomen. De VS is een van de eerste die PCV20 voor kinderen en ouderen heeft geïntroduceerd in 2024.
Ook voor kinderen is er onderzoek gedaan naar de effectiviteit van pneumokokkenconjugaatvaccinatie op de vermindering van invasieve pneumokokkenziekte. De overall vaccineffectiviteit van PCV10 en PCV13 na afronden van een primaire vaccinatieserie bij kinderen van 0-2 jaar oud tegen de vaccinserotypen is respectievelijk 82 (Riaz 2019) en 86 procent (Moore 2016). Het PCV13-vaccin wordt in Europa al een aantal jaar aangeboden aan kinderen in verschillende nationale vaccinatieprogramma’s. Uit een grote Europese studie blijkt een effectiviteit van 84 procent tegen IPD veroorzaakt door de serotypen die PCV13 dekt (Savolescu 2022).
Immunosuppressieve behandelingen kunnen de immuunrespons op vaccins verminderen.
Effect op de circulatie van serotypen
Sinds het toevoegen van een pneumokokkenconjugaat vaccinatie (PCV7) aan het Rijksvaccinatieprogramma voor kinderen in 2006, is er een gestage daling van het aantal pneumokokken vaccintypes die circuleren in de populatie, waardoor ook niet-gevaccineerden worden beschermd tegen de typen die zijn opgenomen in de kindervaccins (herd protection, groeps bescherming).
Door invoering van PCV7 en nadien PCV10 in het RVP is IPD veroorzaakt door de tien serotypen in het conjugaatvaccin met 90 procent afgenomen in zowel gevaccineerde als ongevaccineerde leeftijdsgroepen (RIVM RVP-jaarrapport). Dit komt doordat PCV het dragerschap van PCV-serotypen bij kinderen vrijwel elimineert in de loop der jaren waardoor de transmissie naar andere leeftijdsgroepen, bijvoorbeeld ouderen, verdwijnt. De vaccinserotypen veroorzaken daardoor minder ziekte in de hele populatie. Het wegvallen van PCV-serotypen in dragerschap en verspreiding wordt ingevuld door opkomende niet-vaccinserotypen (replacement). Het gevolg hiervan is dat ziekte door niet-PCV-serotypen toeneemt.
Door de verandering in de circulatie van pneumokokken serotypen (replacement) is eens in de zoveel tijd aanpassing van de vaccinatiestrategie nodig. Sinds het derde kwartaal van 2024 is PCV10 voor kinderen in het RVP vervangen door PCV15 (Vaxneuvance).
Uitgaande van de situatie waarin ouderen indirect beschermd worden door vaccinatie van kinderen, beschermt PCV15 tegen 47 procent van de serotypen die de afgelopen vier jaar IPD veroorzaakten, PCV20 tegen 77, PPV23 tegen 79 en PCV21 tegen 93 procent (Gezondheidsraad 2023).
Beschermingsduur en revaccinatie
Conjugaatvaccins (PCV13, PCV15, PCV20, PCV21) bieden langduriger bescherming dan het polysacharidevaccin (PPV23).
Polysacharidevaccin
De immuunrespons op het polysacharidevaccin is zonder T-cel-activatie, daardoor wordt er geen immunologisch geheugen opgebouwd. Het lijkt dat het pneumokokkenpolysaccharide vaccin maximaal 5 jaar bescherming biedt met de beste bescherming in de eerst 2 jaar en daarna een duidelijke afname.
De duur van de bescherming is over het algemeen korter bij jonge kinderen (beschermingsduur ongeveer 3 jaar) ten opzichte van ouderen (beschermingsduur 2-5 jaar) (Suzuki 2017, Andrews 2012). Bij ouderen wordt 4-7 jaar na vaccinatie een antistoftiter gevonden die ongeveer gelijk is aan de titer voorafgaand aan vaccinatie. Bij immuungecompromitteerde personen is de beschermingsduur niet goed bekend, maar wordt korter geacht vanwege de niet optimale vaccinrespons ten gevolge van de immuunstoornis door aandoening of medicatie.
Om deze reden wordt vaccinatie met PPV23 elke 5 jaar te worden herhaald. Revaccinatie met PPV23 zorgt niet voor een boosterrespons. Revaccinatie na een eerder PPV23 toediening met een breed dekkend conjugaatvaccin als PCV20 of PCV21 heeft mede daarom de voorkeur (zie ook het Gezondheidsraadadvies 2023 en paragraaf Keuze van het vaccin voor de medische risicogroepen.
Hyporesponsiviteit bij PPV23
Er zijn aanwijzingen voor een verminderde antistofrespons na herhaalde vaccinatie met PPV23, zogeheten hyporesponsiviteit, vooral indien er een kort interval is tussen de twee vaccinaties. Hyporesponsiviteit treedt vooral op bij aanwezigheid van een hoge concentratie polysacharide-antigenen na herhaalde revaccinatie en neemt af bij langere intervallen tussen revaccinaties van meer dan 1 jaar (Musher 2010, Musher 2011, Papadatou 2016). Hyporesponsiviteit ontstaat mogelijk doordat de al eerder gevormde memory B-cellen na herhaaldelijke PPV23 revaccinatie in aantal afnemen (en niet worden aangevuld) waardoor er een minder hoge concentratie IgG (immunoglobuline G )-antilichamen geproduceerd wordt (Papadatou 2015, Poolman 2011, Papadatou 2014, O’Brien 2007). De klinische relevantie van hyporesponsiviteit is echter onbekend. Omdat bekend is dat de titers bij volwassenen na vaccinatie en revaccinatie met PPV23 na 5 jaar substantieel gezakt zijn, wordt revaccinatie met PPV23 elke 5 jaar aangeraden (Musher 2010, Musher 2011).
Conjugaatvaccin
Bij conjugaatvaccins wordt er immunologisch geheugen opgebouwd waardoor de beschermingsduur langer is dan bij polysacharidevaccins. De exacte beschermingsduur van conjugaatvaccins is niet bekend, mogelijk is dit bij volwassenen 15 jaar (Gezondheidsraad 2023). Revaccinatie met (eenzelfde) conjugaatvaccin is bij volwassenen (vooralsnog) niet nodig.
Literatuur
- Barug, D., et al., Maternal pertussis vaccination and its effects on the immune response of infants aged up to 12 months in the Netherlands: an open-label, parallel, randomised controlled trial. Lancet Infect Dis, 2019. 19(4): p. 392-401.
- Bonten (a), M.J., et al., Vaccine against Pneumococcal Pneumonia in Adults. N Engl J Med, 2015. 373(1): p. 93.
- Bonten (b), M.J., et al., Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med, 2015. 372(12): p. 1114-25.
- CDC (Centers for Disease Control and Prevention). Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR (Morbidity and Mortality Weekly Report ) Morb Mortal Wkly Rep, 2012. 61(40): p. 816-9.
- CDC. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among children aged 6-18 years with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep, 2013. 62(25): p. 521-4.
- Diaz, J., et al., Effectiveness of the 10-Valent Pneumococcal Conjugate Vaccine (PCV-10) in Children in Chile: A Nested Case-Control Study Using Nationwide Pneumonia Morbidity and Mortality Surveillance Data. PLoS One, 2016. 11(4): p. e0153141.
- Djennad, A., et al., Effectiveness of 23-Valent Polysaccharide Pneumococcal Vaccine and Changes in Invasive Pneumococcal Disease Incidence from 2000 to 2017 in Those Aged 65 and Over in England and Wales. EClinicalMedicine, 2018. 6: p. 42-50.
- Fedson DS. The clinical effectiveness of pneumococcal vaccination: a brief review. Vaccine. 1999;17 Suppl 1:S85-90.
- Fedson, D.S., The clinical effectiveness of pneumococcal vaccination: a brief review. Vaccine, 1999. 17 Suppl 1: p. S85-90.
- Fine MJ, Smith MA, Carson CA, Meffe F, Sankey SS, Weissfeld LA, et al. Efficacy of pneumococcal vaccination in adults. A meta-analysis of randomized controlled trials. Arch Intern Med. 1994;154(23):2666-77.
- Fine, M.J., et al., Efficacy of pneumococcal vaccination in adults. A meta-analysis of randomized controlled trials. Arch Intern Med, 1994. 154(23): p. 2666-77.
- Greenberg RN, Gurtman A, Frenck RW, Strout C, Jansen KU, Trammel J, et al. Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults 60-64 years of age. Vaccine. 2014;32(20):2364-74.
- Greenberg, R.N., et al., Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults 60-64 years of age. Vaccine, 2014. 32(20): p. 2364-74.
- Hak, E., et al., Rationale and design of CAPITA: a RCT of 13-valent conjugated pneumococcal vaccine efficacy among older adults. Neth J Med, 2008. 66(9): p. 378-83.
- Jackson LA, Gurtman A, Rice K, Pauksens K, Greenberg RN, Jones TR, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine. 2013;31(35):3585-93.
- Jackson LA, Gurtman A, van Cleeff M, Jansen KU, Jayawardene D, Devlin C, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults. Vaccine. 2013;31(35):3577-84.
- Jackson LA, Neuzil KM, Yu O, Benson P, Barlow WE, Adams AL, et al. Effectiveness of pneumococcal polysaccharide vaccine in older adults. N Engl J Med. 2003;348(18):1747-55.
- Jackson, L.A., et al., Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine, 2013. 31(35): p. 3585-93.
- Kobayashi, M., et al., Intervals Between PCV13 and PPSV23 Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep, 2015. 64(34): p. 944-7.
- Kristensen M, van Lier A, Eilers R, McDonald SA, Opstelten W, van der Maas N, et al. Burden of four vaccine preventable diseases in older adults. Vaccine. 2016;34(7):942-9.
- Mangen MJ, Rozenbaum MH, Huijts SM, van Werkhoven CH, Postma DF, Atwood M, et al. Cost-effectiveness of adult pneumococcal conjugate vaccination in the Netherlands. Eur Respir J. 2015;46(5):1407-16.
- Mangtani P, Cutts F, Hall AJ. Efficacy of polysaccharide pneumococcal vaccine in adults in more developed countries: the state of the evidence. Lancet Infect Dis. 2003;3(2):71-8.
- Mangtani, P., F. Cutts, and A.J. Hall, Efficacy of polysaccharide pneumococcal vaccine in adults in more developed countries: the state of the evidence. Lancet Infect Dis, 2003. 3(2): p. 71-8.
- Melegaro A, Edmunds WJ. The 23-valent pneumococcal polysaccharide vaccine. Part I. Efficacy of PPV in the elderly: a comparison of meta-analyses. Eur J Epidemiol. 2004;19(4):353-63.
- Melegaro, A. and W.J. Edmunds, The 23-valent pneumococcal polysaccharide vaccine. Part I. Efficacy of PPV in the elderly: a comparison of meta-analyses. Eur J Epidemiol, 2004. 19(4): p. 353-63.
- Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev. 2013;1:CD000422.
- Moore, M.R., et al., Effectiveness of 13-valent pneumococcal conjugate vaccine for prevention of invasive pneumococcal disease in children in the USA: a matched case-control study. Lancet Respir Med, 2016. 4(5): p. 399-406.
- Musher, D.M., et al., Antibody persistence ten years after first and second doses of 23-valent pneumococcal polysaccharide vaccine, and immunogenicity and safety of second and third doses in older adults. Hum Vaccin, 2011. 7(9): p. 919-28.
- Musher, D.M., et al., Safety and antibody response, including antibody persistence for 5 years, after primary vaccination or revaccination with pneumococcal polysaccharide vaccine in middle-aged and older adults. J Infect Dis, 2010. 201(4): p. 516-24.
- Namkoong H, Funatsu Y, Oishi K, Akeda Y, Hiraoka R, Takeshita K, et al. Comparison of the immunogenicity and safety of polysaccharide and protein-conjugated pneumococcal vaccines among the elderly aged 80 years or older in Japan: an open-labeled randomized study. Vaccine. 2015;33(2):327-32.
- O'Brien, K.L., M. Hochman, and D. Goldblatt, Combined schedules of pneumococcal conjugate and polysaccharide vaccines: is hyporesponsiveness an issue? Lancet Infect Dis, 2007. 7(9): p. 597-606.
- O'Neill, S.G. and D.A. Isenberg, Immunizing patients with systemic lupus erythematosus: a review of effectiveness and safety. Lupus, 2006. 15(11): p. 778-83.
- Papadatou, I. and V. Spoulou, Pneumococcal Vaccination in High-Risk Individuals: Are We Doing It Right? Clin Vaccine Immunol, 2016. 23(5): p. 388-95.
- Papadatou, I., et al., Antigen-specific B-cell response to 13-valent pneumococcal conjugate vaccine in asplenic individuals with beta-thalassemia previously immunized with 23-valent pneumococcal polysaccharide vaccine. Clin Infect Dis, 2014. 59(6): p. 862-5.
- Papadatou, I., et al., Long-lasting hyporesponsivenss induced by the 23-valent pneumococcal polysaccharide vaccine (PPV23) in asplenic patients with beta-thalassemia major. Vaccine, 2015. 33(32): p. 3779-83.
- Pichichero, M., et al., Effectiveness of 13-valent pneumococcal conjugate vaccination for protection against acute otitis media caused by Streptococcus pneumoniae in healthy young children: a prospective observational study. Lancet Child Adolesc Health, 2018. 2(8): p. 561-568.
- Poolman, J. and R. Borrow, Hyporesponsiveness and its clinical implications after vaccination with polysaccharide or glycoconjugate vaccines. Expert Rev Vaccines, 2011. 10(3): p. 307-22.
- Rappuoli, R. and E. De Gregorio, A sweet T cell response. Nat Med, 2011. 17(12): p. 1551-2.
- Riaz, A., et al., Effectiveness of 10-valent pneumococcal conjugate vaccine against vaccine-type invasive pneumococcal disease in Pakistan. Int J Infect Dis, 2019. 80: p. 28-33.
- Riekkinen M, Pakkanen SH, Hutse V, et al. Coadministered pneumococcal conjugate vaccine decreases immune response to hepatitis A vaccine: a randomized controlled trial. Clin Microbiol Infect. 2023;29(12):1553-1560. doi:10.1016/j.cmi.2023.08.006
- Ruben, F.L. and M. Uhrin, Specific immunoglobulin-class antibody responses in the elderly before and after 14-valent pneumococcal vaccine. J Infect Dis, 1985. 151(5): p. 845-9.
- Schnyder JL, Garcia Garrido HM, Tanck MW, Irma Maurer, Harskamp AM, Kootstra N, Grobusch MP, Goorhuis A. Hepatitis a vaccine immunogenicity and boostability in adults receiving immunosuppressive therapy and adults living with HIV: a prospective single-centre cohort study, Journal of Travel Medicine 2025;32(2) doi.org/10.1093/jtm/taae125
- Schurink-van 't Klooster T, de Melker H. The National Immunisation Programme in the Netherlands: Surveillance and developments in 2015-2016. Bilthoven: RIVM; 2016. Report No.: 2016-0141.
- Schwarz TF, Flamaing J, Rumke HC, Penzes J, Juergens C, Wenz A, et al. A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged >/=65 years. Vaccine. 2011;29(32):5195-202.
- Schwarz, T.F., et al., A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged >/=65 years. Vaccine, 2011. 29(32): p. 5195-202.
- Simell, B., et al., The fundamental link between pneumococcal carriage and disease. Expert Rev Vaccines, 2012. 11(7): p. 841-55.
- Suzuki, M., et al., Serotype-specific effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumococcal pneumonia in adults aged 65 years or older: a multicentre, prospective, test-negative design study. Lancet Infect Dis, 2017. 17(3): p. 313-321.
- Tan, T.Q., Pediatric invasive pneumococcal disease in the United States in the era of pneumococcal conjugate vaccines. Clin Microbiol Rev, 2012. 25(3): p. 409-19.
- van Aalst, M., et al., Incidence of invasive pneumococcal disease in immunocompromised patients: A systematic review and meta-analysis. Travel Med Infect Dis, 2018. 24: p. 89-100.
- van der Poll, T. and S.M. Opal, Pathogenesis, treatment, and prevention of pneumococcal pneumonia. Lancet, 2009. 374(9700): p. 1543-56.
- van Werkhoven, C.H. and M.J. Bonten, The Community-Acquired Pneumonia immunization Trial in Adults (CAPiTA): what is the future of pneumococcal conjugate vaccination in elderly? Future Microbiol, 2015. 10(9): p. 1405-13.
- Wagenvoort, G.H., et al., Risk and outcomes of invasive pneumococcal disease in adults with underlying conditions in the post-PCV7 era, The Netherlands. Vaccine, 2016. 34(3): p. 334-40.
- Wang, Y., et al., Effectiveness and practical uses of 23-valent pneumococcal polysaccharide vaccine in healthy and special populations. Hum Vaccin Immunother, 2018. 14(4): p. 1003-1012.
- Wyllie AL, Wijmenga-Monsuur AJ, van Houten MA, Bosch AA, Groot JA, van Engelsdorp Gastelaars J, et al. Molecular surveillance of nasopharyngeal carriage of Streptococcus pneumoniae in children vaccinated with conjugated polysaccharide pneumococcal vaccines. Sci Rep. 2016;6:23809.