Samenvatting
Verwekker: Vibrio cholerae (gramnegatieve bacterie). Epidemieën alleen door serotype O1 (biotypen 'klassiek' en 'El Tor') en O139
Incubatieperiode: 12 uur tot 5 dagen, gemiddeld 2-3 dagen
Besmettingsweg: Oraal (besmet water of voedsel, schelp- en schaaldieren) en feco-oraal Zwemmen in besmet water (huidinfecties door V. cholerae non-O1/O139)
Besmettelijke periode: Vanaf 1e symptomen tot enkele dagen na klinisch herstel
Maatregelen: Meldingsplichtige ziekte groep B2. Bronopsporing op indicatie. Arbomaatregelen op indicatie
Symptomen: Varieert van symptomatisch of milde diarree tot acuut braken met hevige waterdunne diarree (‘rijstwater', geurloos). Complicatie: dreigende ernstige dehydratie
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 4 april 2023. Publicatie: 19 mei 2023.
Het hoofdstuk diagnostiek is september 2018 vastgesteld.
De richtlijn is herzien onder leiding van drs. L.B. Vrolijk - Groene Hart Ziekenhuis.
- 18-3-2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en waar van toepassing arbeidsrelevante aanvullingen en veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen
- 19-05-2023: Publicatie herziene versie. Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn:
- Pathogenese: kolonisatie van de dunne darm als tweede belangrijke virulentiefactor toegevoegd. Rol van het microbioom toegevoegd.
- Ziekteverschijnselen: onderscheid gemaakt in endemische en epidemische setting.
- Immuniteit: onderzoek suggereert dat er een rol is van celgemedieerde immuniteit.
- Besmettingsweg: via oppervlakken en objecten toegevoegd.
- Besmettelijke periode: duur van uitscheiding aangepast van ‘enkele dagen na klinisch herstel’ naar ‘enkele dagen tot 2 weken na klinisch herstel’.
- Epidemiologie: bijwerkt t/m 2022.
- Immunisatie: aangevuld met informatie over Shanchol en Euvicol-Plus.
- Behandeling: aangepast in overeenstemming met de SWAB (Stichting Werkgroep Antibioticabeleid)-richtlijn.
Achtergronden
Verwekker
Cholera wordt veroorzaakt door de bacterie Vibrio cholerae. Naast V. cholerae is een aantal andere Vibrio spp. (V. vulnificus, V. parahaemolyticus, V. alginolyticus) geassocieerd met ziekten bij mensen. Deze laatste soorten worden niet besproken in deze richtlijn.
V. cholerae is een chaotisch bewegend, gekromd, gramnegatief staafje met een enkele polaire flagel. De bacterie kan worden getypeerd op basis van de lipopolysacchariden in de celwand. Meer dan 200 serogroepen zijn beschreven, maar slechts twee serogroepen (O1 en O139) veroorzaken epidemieën met de kenmerkende heftige diarree (Sack 2004). De overige serotypen worden in deze richtlijn aangeduid als V. cholerae non-O1/O139.
Stammen van de O1-serogroep kunnen verder worden onderverdeeld in twee biotypen, ‘klassiek’ en ‘El Tor’. Het laatste biotype is vernoemd naar de Egyptische plaats waar dit type in 1905 voor het eerst werd geïsoleerd (Barua 1992). Naast biotypering kunnen O1-stammen verder worden onderverdeeld in de serotypen Ogawa, Inaba en het zeldzame serotype Hikojima op basis van zogenaamde A-, B- en C-polysaccharide-antigenen (Kay 1994). Stammen van de O139-serogroep worden niet gesubtypeerd.
Begin jaren 90 van de vorige eeuw begon in Bangladesh (‘Bengal’) een epidemie door serogroep O139. Deze serogroep stamt af van het El Tor-biotype, waarbij het gen voor O1 werd vervangen voor het gen voor O139 (Johnson 1994). Deze serogroep heeft het vermogen tot productie van choleratoxine waarschijnlijk verworven door transfer van faaggebonden toxinegenen (Sack 2004). Tot dusverre is de epidemie van V. cholerae O139 beperkt gebleven tot het Indische subcontinent. Isolatie van deze serogroep is ongebruikelijk sinds begin jaren 2000 (Kanungo 2022).
Epidemiologie
Verspreiding in de wereld
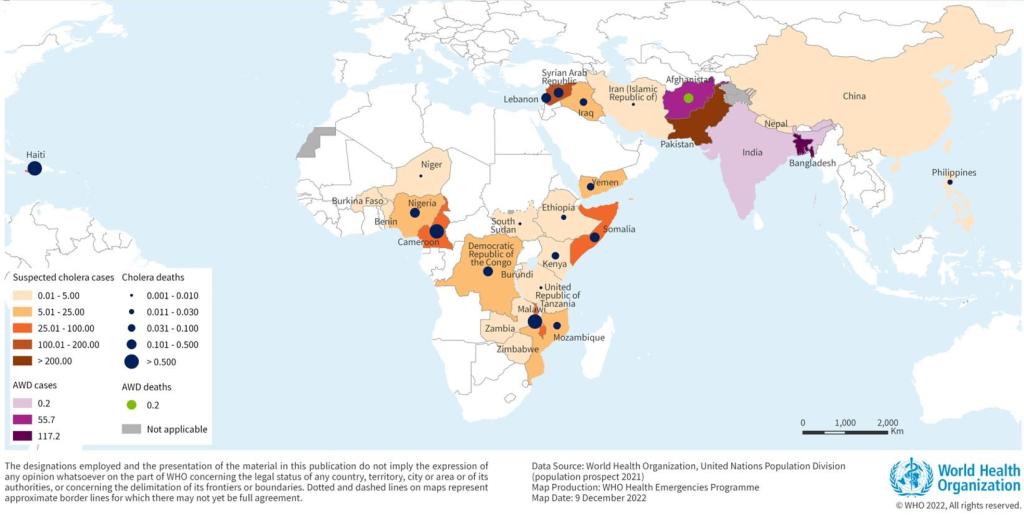
Cholera, gedefinieerd als ziekte die wordt gekenmerkt door waterige diarree, komt voor op bijna alle continenten (WHO 2008). Sinds 2005 wordt een toename van cholera-incidentie gezien. In 2022 rapporteerden 29 landen cholera cases en/of uitbraken (zie figuur 1). Jaarlijks zijn er geschat 1,3-4,0 miljoen cases en 21.000-143.000 doden wereldwijd (WHO 2022b).
Hierbij moet wel worden opgemerkt dat een aantal landen waar zeker cholera voorkomt, zoals Bangladesh, geen gegevens verstrekt aan de WHO (World Health Organization). Daarnaast komt forse onderrapportage voor door slechte surveillancesystemen, angst voor handelsembargo’s of verlies aan inkomsten uit toerisme. De WHO schat dat het aantal gemelde gevallen slechts 5-10 procent van het ware aantal choleragevallen bedraagt.
De meeste uitbraken komen voor in Afrika en in het Oostelijk Middellandse Zeegebied, waar een aaneenschakeling van uitbraken in verschillende landen plaatsvindt. In 2021 vonden de meeste uitbraken plaats in Jemen, Afghanistan, Nepal, Nigeria en de Democratische Republiek Congo (WHO 2022a, WHO 2022c).
Voorkomen in Nederland
Het aantal gemelde gevallen van cholera in Nederland tussen 2006 en 2021 bedraagt 0-5 per jaar. Het aantal patiënten met een infectie door V. cholerae non-O1/O139 is onbekend.
Pathogenese
Na orale inname moeten de vibrio’s overleven tijdens de maagpassage. Vervolgens penetreren de bacteriën de mucuslaag van de dunne darm, hierbij geholpen door hun flagel, en hechten ze middels fimbriae aan het darmepitheel (Sack 2004). Vlak bij het darmoppervlak vindt sterke vermeerdering van het aantal cholerabacteriën plaats, met productie van choleratoxine. In tegenstelling tot sommige andere darmpathogenen (Campylobacter, Salmonella) vindt slechts (heel) incidenteel invasie van de darmmucosa plaats, met name bij patiënten met leverziekten of immuunsuppressie (Sack 2004).
Het choleratoxine bestaat uit een A-subunit en vijf B-subunits. De B-subunits binden via het ganglioside GM1 aan het darmepitheel, waarna de A-subunit wordt opgenomen in de cel. Binnen de cel wordt adenylaatcyclase geactiveerd, waarna door verhoging van cyclisch AMP de secretie van chloor in de cryptcellen toeneemt en de opname van natrium en chloor in de villi wordt geremd. Dit leidt tot grote hoeveelheden waterige diarree met hoge concentraties natrium, chloor, kalium en bicarbonaat, maar slechts weinig eiwit en ontstekingscellen (Waldor 2019). Door het grote volumeverlies treedt hypovolemie op, soms leidend tot shock. Het grote verlies aan kalium en bicarbonaat veroorzaakt een metabole acidose.
Ook kolonisatie van de dunne darm is een belangrijke virulentiefactor. De eigenschappen van V. cholerae die kolonisatie bevorderen, bestaan uit een pilus, waarvan de expressie door choleratoxine wordt gereguleerd, HapA, een hemagglutinine/Zn-metalloprotease die bacteriële penetratie van de intestinale slijmvliezen faciliteert, en de flagel, die de bacterie richting het epitheliale oppervlak beweegt (Clemens 2017).
Diverse studies beschrijven de rol van het microbioom in het beloop van de infectie, waarbij de geslachten Prevotella en Bifidobacterium in verband zijn gebracht met een bescherming tegen cholera en remming van genexpressie van virulentiefactoren (Kanungo 2022).
Incubatieperiode
12 uur tot 5 dagen, gemiddeld 2 tot 3 dagen (Chin 2000).
Ziekteverschijnselen
In een endemische setting heeft een groot gedeelte van de personen die door V. cholerae zijn geïnfecteerd geen symptomen of slechts een milde diarree, niet te onderscheiden van diarree door andere verwekkers. De ernstige casussen zijn geconcentreerd onder jonge kinderen en niet eerder geëxposeerde personen.
In een epidemische setting in een niet eerder geëxposeerde populatie zijn de ernstige casussen verdeeld over kinderen en volwassenen en is er een hoge case fatality rate (Harris 2012). Bij besmetting met het klassieke biotype zijn de verschijnselen ernstiger dan bij het El Tor bioptype. De ziekteverschijnselen van de verschillende biotypes zijn niet van elkaar te onderscheiden (Waldor 2019).
Bij gezonde reizigers verloopt de ziekte meestal mild en is zelflimiterend. Het typische klinische beeld van cholera begint met het acuut optreden van braken en grote hoeveelheden waterdunne diarree. De diarree wordt beschreven als ‘rijstwater’, licht geelgroen met vlokjes, met een vis-achtige geur. Opvallend is de afwezigheid van ernstige buikkrampen. Zeurende buikpijn en drukpijn komen wel voor. Bij volwassenen met ernstige cholera kan het volume van de ontlasting oplopen tot 500-1000 ml/uur, wat leidt tot ernstige dehydratie (Sack 2004, Waldor 2019).
Vanwege het fulminante beloop kunnen ook gezonde volwassenen in korte tijd bezwijken aan een cholera-infectie. Bij andere verwekkers van gastro-enteritis overlijden vrijwel uitsluitend jonge kinderen, ouderen en personen met een gestoorde afweer. Het overlijden van voorheen gezonde volwassenen door diarree is klinisch zeer verdacht voor cholera. Koorts komt voor bij een klein aantal patiënten.
Kenmerken van dehydratie zijn een zwakke of afwezige (snelle) pols, zeer lage bloeddruk, verminderde huidturgor, droge slijmvliezen, diepliggende ogen.
Bij toenemende dehydratie worden patiënten vaak apathisch en eventueel volgt bewustzijnsverlies. Bij zeer ernstige vormen met metabole acidose hebben patiënten een zeer diepe, snelle ademhaling (kussmaulademhaling). Hypoglycaemie komt met name voor bij kinderen, die een kleine glycogeenvoorraad hebben. De klinische situatie van cholerapatiënten kan reeds enkele uren na het begin van de symptomen verslechteren en patiënten kunnen binnen een dag overlijden (Waldor 2019).
Bij kinderen verloopt de ziekte meestal zoals bij volwassenen, hoewel hypoglykemie, koorts, insulten en bewustzijnsdalingen vaker voorkomen. Een ernstige complicatie van cholera is acuut nierfalen als gevolg van de langdurige hypotensie.
De sterfte aan cholera wordt wereldwijd geschat op ongeveer 2% (WHO 2022a), maar hangt sterk af van de toegang tot gezondheidszorg en beschikbaarheid van ondersteunende behandeling. Onder de meest kwetsbare populaties kan de sterfte oplopen tot 40% (Hill 2006, WHO 2008).
Bij infecties met V. cholerae non-O1/O139 is er meestal sprake van een gastro-enteritis of een huidinfectie, vaak aan het oor (Kechker 2017).
Natuurlijke immuniteit
Na infectie met V. cholerae is er zowel een systemische als mucosale immuunrespons (Svennerholm 1994). In bloed van patiënten zijn zowel antistoffen tegen de bacterie als tegen het toxine aan te tonen. Aangezien zowel de bacterie als het toxine niet verder het lichaam binnendringen dan het darmepitheel, wordt verondersteld dat bescherming tegen cholera uitsluitend wordt gemedieerd door factoren in het darmlumen, de mucuslaag en de epitheelcel. Het is de vraag of de antistoffen in serum beschermend zijn, of slechts een marker van een doorgemaakte infectie, aangezien er een slechte correlatie is tussen serumtiters en beschermend effect. Naast aspecifieke afweermechanismen, zoals de lage pH in de maag en de mucuslaag in de darm, wordt het secretoire IgA (immunoglobuline A) (sIgA) beschouwd als de belangrijkste beschermende factor (Svennerholm 1994). SIgA gericht tegen het lipopolysaccharide in de celwand van de bacterie voorkomt kolonisatie van de darm met V. cholerae, terwijl toxinespecifieke antistoffen een neutraliserend effect hebben. Recent onderzoek suggereert dat T-cellen een rol spelen in het induceren van B-cel-gemedieerde immuniteit (Rashu 2019).
Infectie met cholera leidt tot immunologische geheugenvorming (Svennerholm 1994). Naast snelle sIgA-respons tegen choleratoxine bij hernieuwd contact met V. cholerae, komt dit ook tot uiting in de epidemiologie van cholera in endemische gebieden. De leeftijdsgerelateerde incidentie vertoont een piek bij 2- tot 9-jarigen, waarna de incidentie afneemt (Sack 2004). De lage incidentie bij kinderen onder 2 jaar wordt toegeschreven aan een beschermend effect van sIgA in borstvoeding (Svennerholm 1994).
Reservoir
V. cholerae O1 komt wereldwijd voor, voornamelijk in Zuid-Azië, Afrika, Zuid-Amerika en de Golf van Mexico; V. cholerae O139 lijkt tot nu toe beperkt tot Zuid-Azië (Sack 2004). V. cholerae non-O1/O139 kan worden aangetoond in water uit riviermondingen, langs kusten en ander (brak) oppervlaktewater over de gehele wereld, inclusief de Verenigde Staten van Amerika, Europa (ook in Nederland) en Australië (Morris 1994, Visser 1994).
Vibrio’s kunnen in water overleven door zich aan te passen op diverse stressoren, waaronder nutriëntengebrek, veranderingen in zoutgehalte en temperatuur, en contact met bacteriofagen. Hiernaast kunnen ze overleven door zich te hechten aan plankton, roeipootkreeftjes en andere natuurlijke aquatische gastheren (Mavian 2020). Klimaatveranderingen die de groei van plankton beïnvloeden kunnen ook van invloed zijn op het voorkomen van cholera (Sack 2004).
Transmissie
Besmettingsweg
Indirect
Mensen worden ziek door de inname van besmet water of voedsel of door indirecte feco-orale besmetting (Chin 2000). Met name in gebieden met onvoldoende toegang tot veilig drinkwater en onvoldoende sanitaire voorzieningen is het risico op besmetting tijdens een epidemie groot (Waldor 2019). Schelp- en schaaldieren concentreren de vibrio’s en consumptie of ander contact hiermee kan leiden tot infecties. Transmissie via oppervlakken en objecten kan ook een rol spelen, waarbij de bacteriën 1-4 uur tot 7 dagen kunnen overleven op objecten (resp. in kweekbare en niet-kweekbare staat) (Farhana 2016). Daarnaast kan zwemmen in besmet water leiden tot infecties veroorzaakt door V. cholerae non-O1/O139 (Lukinmaa 2006, Morris 1994, Muijsken 2007).
Direct
Directe feco-orale transmissie van persoon tot persoon, zonder tussenkomst van een waterbron, is mogelijk (George 2017, Waldor 2019). De ontlasting van cholerapatiënten bevat grote hoeveelheden vibrio’s en kan daarmee zeer besmettelijk zijn. Bij importgevallen echter wordt, indien normale hygiënische maatregelen in acht worden genomen, cholera niet van mens op mens overgedragen (zie ook Bron-en contactonderzoek en Maatregelen ten aanzien van index, contacten en bron). Dit komt waarschijnlijk door de hoge dosis die benodigd is om ziekteverschijnselen te induceren en de gevoeligheid van vibrio’s voor uitdroging (Waldor 2019).
Besmettelijke periode
De uitscheiding begint bij de eerste symptomen en duurt enkele dagen tot 2 weken na klinisch herstel (Clemens 2017). Antibiotica bekorten de uitscheidingsduur (Chin 2000).
Besmettelijkheid
De dosis waarbij geïnfecteerde individuen ziekteverschijnselen ontwikkelen, bedraagt meer dan 108 organismen bij gezonde personen, maar is veel lager (104-105) bij mensen met verstoorde maagzuursecretie (Sack 2004). Deze dosis is ook afhankelijk van het type besmet voedsel of water, en wel van de mate waarin het maagzuur door dit voedsel wordt geneutraliseerd. In de endemische situatie kan de dosis waarbij klachten optreden mogelijk veel lager zijn aangezien de attack rate in de endemische situatie lager is dan bij vrijwilligersstudies en veel cholerapatiënten gestoorde maagzuursecretie blijken te hebben (Sack 2004).
Risicogroepen
Verhoogde kans op infectie
In het algemeen hebben individuen met verstoorde maagzuursecretie een groter risico op infectie en een verhoogde kans op ernstig beloop.
Op basis van de situatie waarin een cholerageval wordt geïdentificeerd, zijn verschillende risicogroepen te onderscheiden:
- Reizigers. Gezien het zeer kleine aantal reizigers met een ernstige symptomatische infectie door V. cholerae, is het niet mogelijk om specifieke groepen aan te geven (Wittlinger 1995). Bij uitbraken onder vliegtuigpassagiers veroorzaakt door besmet voedsel blijkt dat personen > 60 jaar groter risico hebben om geïnfecteerd te raken en ziekteverschijnselen te ontwikkelen (Eberhart-Phillips 1996, Sutton 1974).
- Kinderen 2-9 jaar in endemische gebieden. In gebieden waar elk jaar een choleraseizoen is met hetzelfde type V. cholerae, komen infecties met V. cholerae het meest frequent voor bij kinderen van 2-9 jaar (periode van primo-infectie, daarna partieel immuun) (Sack 2004).
- Bewoners in epidemische gebieden. Indien een nieuw type V. cholerae wordt geïntroduceerd in een gebied, spreekt men van een epidemische vorm van cholera. Hierbij hebben alle leeftijdscategorieën een even grote kans om geïnfecteerd te raken (Sack 2004). In sommige streken wordt waargenomen dat volwassen mannen die het meest met besmet water in aanraking komen bij de uitoefening van hun beroep, de eerste groep vormt die besmet wordt met een nieuw type V. cholerae.
Risicofactoren voor infecties met V. cholerae non-O1/O139 zijn: levercirrose, diabetes mellitus en maligniteit (Chen 2015).
Verhoogde kans op ernstig beloop
Inname van een grote infectieuze dosis is een risicofactor voor een ernstig beloop van cholera (Collins 2022). Hiernaast bestaat bij de volgende groepen een verhoogde kans op ernstig beloop (Chin 2000, Sack 2004):
- zwangeren; in de zwangerschap, met name het laatste trimester, heeft cholera een zeer slechte prognose voor de foetus – tot 50% van de zwangerschappen gaat verloren indien geen adequate rehydratie plaatsvindt;
- kinderen < 1 jaar;
- ernstig ondervoede kinderen;
- personen > 70 jaar;
- personen met een verhoogde pH van de maag;
- personen met bloedgroep O (mechanisme onbekend).
Behandeling
De hoeksteen van de behandeling van cholera bestaat uit rehydratietherapie. De eerste fase bestaat uit intensieve rehydratie om het reeds aanwezige vochttekort aan te vullen. Bij ernstig gedehydreerde patiënten is intraveneuze rehydratie nodig met vocht en elektrolyten. Bij milde dehydratie kan worden volstaan met rehydratie per os met ‘oral rehydration solution’ (ORS).
Na rehydratie volgt de onderhoudsfase om het continue vochtverlies te compenseren. Tijdens de onderhoudsfase moet de patiënt zelf kunnen drinken. Terugval van rehydratie kan worden voorkomen door adequate intake. Patiënten dienen daarom zorgvuldig geobserveerd te worden (Hill 2006).
In de Nederlandse situatie zullen gedehydreerde patiënten worden opgenomen en vaak intraveneus worden gerehydreerd (Smit 1994). Patiënten in goede hydratietoestand hebben vanzelfsprekend geen rehydratietherapie nodig maar moeten wel worden geïnformeerd over het ziektebeeld en dienen tevens instructies te krijgen over het gebruik van ORS. Frisdranken en sportdranken zijn niet geschikt als rehydratievloeistof vanwege het te lage natrium- en te hoge glucosegehalte (Kist-van Holthe 1999).
Naast rehydratie wordt antibiotische therapie aangeraden wanneer sprake is van matig ernstige of ernstige V. cholerae-infecties. Antibiotische therapie bekort de duur van diarree met ongeveer een dag, vermindert het volume met 50%, vermindert de benodigde hoeveelheid rehydratievloeistof met 40% en vermindert de gemiddelde duur van uitscheiding van V. cholerae met bijna 3 dagen (Leibovici-Weissman 2014). De keus van de antibiotische behandeling hangt in belangrijke mate af van lokale resistentiepatronen (Sack 2004, Harris 2012). Zie voor uitgebreide informatie over de behandeling de website van de Stichting Werkgroep Antibiotica Beleid.
Diagnostiek
Zie ook Diagnostisch Vademecum Vibrio Cholerae.
Microbiologische diagnostiek
Directe diagnostiek
In Nederland wordt de diagnose gesteld door het aantonen van V. cholerae in ontlasting van patiënten. Voor het aantonen van Vibrio spp. in feces worden specifieke kweekmedia gebruikt.
De meest gebruikte is het TCBS-medium (thiosulfaat-citraat-bilesalt-sucrose), waarop V. cholerae door sucrosefermentatie gele kolonies geeft. Naast direct enten van ontlasting wordt aangeraden alkalisch peptonwater als ophopingsmedium te gebruiken. Identificatie van verdachte kolonies wordt in de meeste laboratoria door middel van Maldi-Tof verricht. Ook een grampreparaat (gebogen gramnegatiefstaafjes), het observeren van beweeglijkheid onder de microscoop en een oxidasetest (Vibrio spp. zijn oxidase-positief) kunnen worden gebruikt om tot een voorlopige identificatie te komen. Een als V. cholerae geïdentificeerde stam wordt geagglutineerd met O-polyvalent en O1- en O139-specifieke antisera. Eventueel kunnen O1-positieve stammen nog verder worden getypeerd met Ogawa- en Inaba-specifieke antisera. Biotypering wordt verricht in gespecialiseerde laboratoria (zie het Diagnostisch Vademecum Vibrio cholerae).
In afgelopen jaren zijn er ook PCR-assays ontwikkeld voor het directe aantonen van V. cholerae (en andere Vibrio spp.) in ontlasting. Hiervan wordt in Nederland momenteel weinig gebruik gemaakt.
In gebieden waar geen kweekdiagnostiek mogelijk is, kan de diagnose worden gesteld door observatie van de beweeglijkheid onder de microscoop. In situaties waar geen laboratoriumdiagnostiek voorhanden is, kunnen immunoassays worden gebruikt die lipopolysaccharide van V. cholerae O1 en O139 aantonen.
Indirecte diagnostiek
Niet van toepassing.
Typering voor bron- en contactonderzoek
Niet van toepassing.
Niet-microbiologische diagnostiek
In een epidemische situatie is cholera een klinische diagnose. Elke patiënt met waterige diarree tijdens een cholera-epidemie heeft cholera.
Preventie
Immunisatie
Vaccinatie
Er zijn verschillende orale choleravaccins. Omdat vrijwel alle reizigers over schoon drinkwater kunnen beschikken, is het oplopen van het klassieke ziektebeeld van cholera onder reizigers extreem zeldzaam (zie Voorkomen in Nederland). Vaccinatie is voor gewone reizigers dus niet geïndiceerd. Zie voor meer informatie over de vaccins en de indicaties voor reizigers het LCR-protocol Cholera (voor abonnees via mijnlcr.nl).
- Dukoral is in Nederland geregistreerd voor personen vanaf de leeftijd van 2 jaar. Het vaccin biedt alleen gedeeltelijke bescherming tegen infecties met V. cholerae O1, en niet tegen serogroep O139. Het orale vaccin bevat een mengsel van V. cholerae klassiek, El Tor-biotype en recombinant choleratoxine. Twee orale doses, 1-6 weken na elkaar, bieden bescherming vanaf 1 week na de tweede dosis gedurende 2 jaar. Kinderen van 2-6 jaar hebben een derde dosis nodig; voor hen geldt een beschermingsduur van 6 maanden. De effectiviteit bedraagt 50-80%, afhankelijk van de leeftijd (lagere effectiviteit bij kinderen van 2-6 jaar). Daarnaast biedt het vaccin door kruisreactiviteit tevens gedurende ongeveer 3 maanden gedeeltelijke bescherming tegen reizigersdiarree veroorzaakt door enterotoxische Escherichia coli (ETEC) (Clemens 1988, Hill 2006).
- Shanchol en Euvicol-Plus hebben dezelfde vaccinformule, maar worden geproduceerd door verschillende fabrikanten. Dit zijn orale choleravaccins die bestaan uit een mengsel van geïnactiveerd V. cholerae serogroep O1 (klassiek en El Tor biotype) en O139. Twee orale doses van Shanchol, 14 dagen na elkaar, bieden tot 65% bescherming na 5 jaar (Clemens 2017). De vaccins zijn beschikbaar voor grote vaccinatiecampagnes via de Global OCV Stockpile. In Nederland zijn Shanchol en Euvicol-Plus (niet geregistreerd en) niet beschikbaar.
In andere landen zijn parenterale vaccins nog wel geregistreerd, maar door de lage effectiviteit en vele bijwerkingen obsoleet (Hill 2006).
Algemene preventieve maatregelen
Cholera wordt overgedragen door besmet water of voedsel. Preventieve maatregelen in risicogebieden hebben derhalve betrekking op het vermijden van potentieel besmette levensmiddelen, net zoals bij andere feco-oraal overdraagbare ziekten.
De volgende preventieve maatregelen moeten worden geadviseerd (conform LCR-protocol Reizigersdiarree, voor abonnees via mijnlcr.nl):
- na toiletgebruik en voor het eten goed de handen wassen met water en zeep (voorkeur) of de handen reinigen met handalcohol;
- preventieve dieetmaatregelen ('Boil it, cook it, peel it, or forget it'):
- geen leidingwater maar water uit afgesloten, ongeopende flessen of gekookt water drinken;
- geen ijsklontjes of koude melkproducten (ijs, melk, yoghurtdrank) gebruiken;
- geen rauwkost, salades of ongeschild fruit eten;
- fruit zelf schillen of pellen;
- uitsluitend vers en goed verhit (d.w.z. nog heet) gekookt of doorbakken vlees of vis eten, inclusief schaal- en schelpdieren.
Reiniging, desinfectie en sterilisatie
V. cholerae kan slecht tegen vriezen en uitdroging, maar kan lang overleven in water. Vibrio’s worden effectief gedood door alcohol 70% en natriumhypochloriet 0,025% (250 ppm).
Verder conform de standaardmethoden in de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Maatregelen
Meldingsplicht
Cholera is een meldingsplichtige ziekte groep B2. Dit houdt in dat artsen en hoofden van laboratoria bij vaststelling van de infectieziekte of verwekker dit binnen 1 werkdag moeten melden aan de GGD (Gemeentelijke gezondheidsdienst). De GGD meldt gepseudonimiseerd conform de Wet publieke gezondheid binnen 3 dagen aan het CIb (Centrum Infectieziektebestrijding) en levert gegevens voor de landelijke surveillance van meldingsplichtige ziekten.
Meldingscriteria:
Elk persoon met ten minste 1 van de volgende 2 symptomen:
- diarree,
- braken,
in combinatie met:
- aantonen van V. cholerae (type O1 of O139) in feces of braaksel.
Meldingen op basis van clusters
Als zich in een instelling een of meerdere gevallen met klachten en symptomen passend bij de ziekteverwekker uit deze richtlijn voordoen, kan er sprake zijn van meldingsplicht op basis van clusters, conform de Wet publieke gezondheid.
Inschakelen van andere instanties
De GGD coördineert de samenwerking met andere instanties zoals het CIb en eventueel de IGZ (Inspectie voor de Gezondheidszorg).
Bron- en contactonderzoek
Bronopsporing
Gevallen in Nederland betreffen meestal sporadische gevallen waarbij besmetting in het buitenland is opgetreden. In deze gevallen is bronopsporing niet haalbaar. Bij 2 bevestigde gevallen binnen 5 dagen (de maximale incubatieduur) dient wel bronopsporing plaats te vinden. Bronopsporing bij reizigers gebeurt alleen bij een uitbraak indien er verdenking bestaat op besmetting tijdens de reis (bijvoorbeeld door besmet vliegtuigvoedsel).
Contactonderzoek
Contactonderzoek is niet van toepassing omdat cholera in de Nederlandse situatie bij inachtneming van normale hygiënische maatregelen niet van mens op mens wordt overgedragen. Reisgenoten of medepassagiers behoeven niet te worden gescreend voor uitscheiding van V. cholerae. Nosocomiale uitbraken van cholera zijn beschreven in gebieden waar cholera voorkomt, maar nooit in de westerse wereld (Ryder 1986, Swaddiwudhipong 1991).
Maatregelen ten aanzien van index, contacten en bron
Aangezien de kans op transmissie van mens op mens bij normale hygiëne zeer klein is, zijn geen extra maatregelen nodig bij een geval van cholera waarvoor geen ziekenhuisopname noodzakelijk is. Om het risico op transmissie binnen een gezin, ziekenhuis of instelling te verkleinen zijn de standaardmaatregelen op gebied van hygiëne (zie o.a. de RIVM-toolkit hygiëne en de richtlijnen van de Werkgroep Infectiepreventie) voldoende.
Postexpositieprofylaxe
Profylaxe
Antibiotische (postexpositie)profylaxe wordt alleen voorgeschreven bij uitbraken waarbij een hoog risico bestaat voor verdere verspreiding. Dit is bijvoorbeeld het geval in instellingen waar mensen verblijven met slechte persoonlijke hygiëne (Swaddiwudhipong 1991). Effect van profylaxe op huisgenoten is nooit bewezen (Sack 2004). Massaprofylaxe in epidemische gebieden is controversieel, onder andere vanwege het ontstaan van antibioticumresistentie.
De WHO heeft een voorraad van oraal choleravaccin beschikbaar voor immunisatiecampagnes bij uitbraken (Hsiao 2017).
Wering
Bij ernstige diarree zal het kind om die reden niet naar school of kinderdagverblijf gaan. Indien de ontlastingsfrequentie en consistentie het weer toelaten om naar school of kinderdagverblijf te gaan, wordt de transmissiekans zo laag geacht dat wering niet zinvol is (zie ook Besmettelijkheid en Maatregelen ten aanzien van index, contacten en bron).
Wering van werk kan van toepassing zijn, zie onder Arbeidsgerelateerde aanvullingen.
Arbeidsrelevante aanvullingen
Deze aanvullingen zijn geschreven voor en door bedrijfsartsen en beschrijven de preventieve maatregelen om het oplopen van infectieziekten tijdens het werk te voorkomen (werknemer als risicoloper) en de maatregelen/aanpassingen die genomen kunnen worden bij vaststelling van de infectieziekte bij de werknemer (werknemer als risicovormer). In de werksituatie gelden de Arbowet, het Arbeidsomstandighedenbesluit (Arbobesluit) en de Europese Richtlijn 2000/54 gericht op preventie. Zie ook biologische agentia in de wet (Arboportaal.nl).
Arbeidsgerelateerde risicogroepen
Verhoogde kans op infectie
In de Nederlandse situatie is de kans op besmetting met V. cholerae O1/O139 zeer klein. Blootstelling aan V. cholerae non-O1/O139 kan plaatsvinden tijdens werk met brak- en zoutwaterzeedieren. Met name immuungecompromitteerde patiënten en leverpatiënten lopen een verhoogd risico.
De incidentie van het aantal arbeidsgerelateerde ziektegevallen is niet bekend. Wel zijn er voorvallen beschreven van besmetting met V. cholerae (Muijsken 2007) na het schoonmaken van paling.
Voor werknemers die reizen naar of werken in landen waar cholera endemisch is (met name Afrika), ligt het risico op besmetting hoger. Hierbij kan gedacht worden aan militairen en hulpverleners die in een land verblijven waar cholera endemisch is.
Preventieve maatregelen op het werk
Vaccinatie voor werknemers
Vaccinatie is aangewezen voor hulpverleners en militairen die in vluchtelingengebieden gaan werken waarvan niet bekend is of zij over schoon drinkwater kunnen beschikken. Of voor personen die reizen naar gebieden waar cholera heerst en waar geen of nauwelijks toegang is tot gezondheidszorg (Hill 2006).
Overige preventieve maatregelen op het werk
In de zorgsector en in de sector voedselproductie en -bereiding is er sprake van specifieke regelgeving rondom hygiëne en voedselveiligheid. Zie ook LCI-draaiboek Gastro-enteritis en voedselvergiftigingen. Werknemers dienen bij indiensttreding over het weringsbeleid bij gastro-enteritisklachten te worden geïnformeerd.
Bij personen die contact hebben met oppervlaktewater en na contact met risicodieren en -kweeksystemen is een goede handhygiëne van belang. Werknemers in risicoberoepen, zoals palingkwekers, moeten handschoenen dragen om zo de eventuele overdracht te minimaliseren.
V. cholerae valt in risicoklasse 2 van de biologische agentia. Medewerkers van laboratoria die met materialen werken die mogelijk V. cholerae kunnen bevatten, moeten beheersmaatregelen nemen die behoren bij beheersingsniveau 2. Deze maatregelen zijn beschreven in bijlage V van de Europese richtlijn 200/54/EG L 262/21.
Maatregelen
Wering van werk
Personen met gastro-enteritisklachten (o.a. diarree) die betrokken zijn bij de bereiding, verpakking of behandeling van eet- en drinkwaren en/of verplegend personeel dienen de eerstverantwoordelijke van de afdeling hiervan direct op de hoogte te stellen. Deze kan hierop actie ondernemen. De voorkeur heeft een tijdelijke tewerkstelling elders in de instelling tot klinisch herstel.
Melden als beroepsziekte
Indien de ziekte (waarschijnlijk) is opgelopen tijdens de beroepsuitoefening moet de casus door een geregistreerde bedrijfsarts worden gemeld bij het Nederlands Centrum voor Beroepsziekten.
Literatuur
- Barua D 1992. History of cholera. In: Barua D, Greenough III WB (eds.). Cholera. New York: Plenum Publishing Corporation; 1992: 1-36.
- Chen YT et al. 2015. Clinical manifestations of non-O1 Vibrio cholerae infections. PLoS One 2015; 10 (1): e0116904.
- Chin JC 2000. Cholera and other vibrioses. In: Control of communicable diseases manual. Washington: American Public Health Association; 2000: 100-13.
- Clemens JD et al. 1988. Cross-protection by B subunit-whole cell cholera vaccine against diarrhea associated with heat-labile toxin-producing enterotoxigenic Escherichia coli: results of a large-scale field trial. J Infect Dis 1988; 158 (2): 372-7.
- Clemens JD et al. 2017. Cholera. Lancet 2017; 390: 1539-49.
- Collins JP et al. 2022. Cholera vaccine: recommendations of the Advisory Committee on Immunization Practices, 2022. MMWR (Morbidity and Mortality Weekly Report) Recomm Rep 2022; 71 (2): 1-8.
- Eberhart-Phillips J et al. 1996. An outbreak of cholera from food served on an international aircraft. Epidemiol Infect 1996; 116 (1): 9-13.
- Farhana I et al. 2016. Survival of Vibrio cholerae O1 on fomites. World J Microbiol Biotechnol 2016; 32 (9): 146.
- George CM 2017. Genetic relatedness of Vibrio cholerae isolates within and beteween households during outbreaks in Dhaka, Bangladesh. BMC genomics 2017; 18 (1): 903.
- Harris JB et al. 2012. Cholera. Lancet 2012; 379 (9835): 2466-76.
- Hill DR et al. 2006. Oral cholera vaccines: use in clinical practice. Lancet Infect Dis 2006; 6 (6): 361-73.
- Hsiao A et al. 2017. Lessons learnt from 12 oral cholera vaccine campaigns in resource-poor settings. Bull World Health Organ 2017; 95 (4): 303–312.
- Johnson JA et al. 1994. Vibrio cholerae O139 synonym Bengal is closely related to Vibrio cholerae El Tor but has important differences. Infect Immun 1994; 62: 2108-10.
- Kanungo S et al. 2022. Cholera. Lancet 2022; 399 (10333): 1429-40.
- Kay BA et al. 1994. Isolation and identification of Vibrio cholerae O1 from fecal specimens. In: Wachsmuth IK, Blake PA, Olsvik O (eds.). Vibrio cholerae and cholera. Washington: ASM Press; 1994: 3-26.
- Kechker P et al. 2017. Otitis Media caused by V. Cholerae O100: a case report and review of the literature. Front Microbiol 2017; 8: 1619.
- Kist-van Holthe JE, Van der Heijden AJ. Dehydratie ten gevolge van gastro-enteritis bij kinderen. Ned Tijdschr Geneeskd 1999; 143 (4): 193-6.
- Leibovici-Weissman Y et al. 2014. Antimicrobial drugs for treating cholera. Cochrane Database Syst Rev 2014 (6): CD008625.
- Lukinmaa S et al. 2006. Territorial waters of the Baltic Sea as a source of infections caused by Vibrio cholerae non-O1, non-O139: report of 3 hospitalized cases. Diagn Microbiol Infect Dis 2006; 54 (1): 1-6.
- Mavian C et al. 2002. Toxigenic Vibrio cholerae evolution and establishment of reservoirs in aquatic ecosystems. Proc Natl Acad Sci USA 2020; 117 (14): 7897-904.
- Morris JG 1994. Non-O group 1 Vibrio cholerae strains not associated with epidemic disease. In: Wachsmuth IK, Blake PA, Olsvik O (eds.). Vibrio cholerae and cholera. Washington: ASM Press; 1994: 103-16.
- Muijsken MA, Menger HJ 2007. Vibrio cholerae: ook in Nederland zijn infecties mogelijk. Infectieziekten Bulletin 2007; 151: 1203.
- Rashu R et al. 2019. Cognate T and B cell interaction and association of follicular helper T cells with B cell responses in Vibrio cholerae O1 infected Bangladeshi adults. Microbes Infect 2019; 21: 176–83.
- Rouard C et al. 2022. Contribution of microbial genomics to cholera epidemiology. C R Biol 2022; 345 (1): 37-56.
- Ryder RW et al. 1986. An outbreak of nosocomial cholera in a rural Bangladesh hospital. J Hosp Infect 1986; 8 (3): 275-82.
- Sack DA et al. 2004. Cholera. Lancet 2004; 363 (9404): 223-33.
- Smit AA et al. 1994. Twee Nederlandse reizigers uit Thailand met cholera. Ned Tijdschr Geneeskd 1994; 138 (17): 871-3.
- Sutton RG 1974. An outbreak of cholera in Australia due to food served in flight on an international aircraft. J Hyg (Lond) 1974; 72 (3): 441-51.
- Svennerholm AM et al. 1994. Immunity to Vibrio cholerae infection. In: Wachsmuth IK, Blake PA, Olsvik O (eds.). Vibrio cholerae and cholera. Washington: ASM Press; 1994: 257-72.
- Swaddiwudhipong W, Limpakarnjanarat K 1991. An outbreak of El Tor cholera in an institution for the mentally retarded in Nonthaburi, June-July 1987. J Med Assoc Thai 1991; 74 (6): 306-10.
- Visser IJ. 1994. Non-O1-Vibrio cholerae in oppervlaktewater van Nederland. Ned Tijdschr Geneeskd 1994; 138 (43): 2155-6.
- Waldor MK, Ryan ET. Vibrio cholerae. In: Bennett JE, Dolin R, Blaser MJ (eds.). Mandell, Douglas and Bennett’s Principles and practice of infectious diseases. 9th ed. Philadelphia: Elsevier; 2019: Chapter 214.
- WHO (World Health Organization) 2008. Cholera, 2007. Weekly epidemiological record 2008; 83 (31): 269-84.
- WHO 2022a. Cholera, 2021. Weekly epidemiological record 2022; 97 (37): 453-464.
- WHO 2022b. Cholera. WHO Factsheet 30 March 2022. who.int/news-room/fact-sheets/detail/cholera.
- WHO 2022c. Cholera – Global situation. WHO Disease Outbreak News 16 December 2022. who.int/emergencies/disease-outbreak-news/item/2022-DON426.
- Wittlinger F et al. 1995. Risk of cholera among Western and Japanese travelers. J Travel Med 1995; 2 (3): 154-8.