Samenvatting
Verwekker: Hepatitis C-virus (RNA virus)
Incubatieperiode: Gemiddeld zeven weken (spreiding 2-26 weken)
Besmettingsweg: Direct bloed-bloedcontact (iatrogeen, parenteraal, perinataal, seksueel)
Besmettelijke periode: Zolang HCV (hepatitis C-virus)-RNA aantoonbaar is in het bloed
Maatregelen: Meldingsplicht groep B2. Bron- en contactopsporing; voorlichting
Symptomen: Merendeel zonder of milde aspecifieke klachten; bij chronische HCV kans op levercirrose na 20-30 jaar
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 4 juni 2019. Diagnostiek vastgesteld : 28 juni 2019. Publicatie: 24 juli 2019.
Wijzigingen vanaf laatste vaststelling LOI:
- 3 november 2025: Bij contactonderzoek zijn de criteria voor contactonderzoek verduidelijkt. Inhoudelijk is er geen wijziging. Voor inschatting van risicocontact wordt nu expliciet verwezen naar de paragraaf Transmissie.
- 29 oktober 2025: De arboparagraaf is op organisatorische aspecten aangepast naar aanleiding van het opheffen van de commissie Preventie Iatrogene Transmissie van HBV (hepatitis B-virus), HCV (hepatitis C-virus) en hiv (PIT).
- 18 maart 2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en waar van toepassing arbeidsrelevante aanvullingen en veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen.
- 22 februari 2024: De informatie onder Contactonderzoek is geüpdatet op basis van het recent herziene draaiboek Soa- en hiv-partnermanagement: acute hepatitis C zonder klachten is toegevoegd en bij seksuele contacten is de termijn aangepast van '6 maanden terug' naar '3 maanden terug'.
- 24 juli 2019: Publicatie herziene richtlijn. De richtlijn is herzien onder leiding van dr. A.T. Urbanus (RIVM-CIb). Het hoofdstuk diagnostiek is herzien door Thijs van de Laar (Sanquin). Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn:
- actualisatie van de epidemiologische data;
- behandeling geactualiseerd;
- meldingscriteria aangepast conform huidige meldplicht;
- actualisatie van diagnostiek.
Achtergronden
Verwekker
Het hepatitis C-virus (HCV) werd pas in 1989 ontdekt en bleek de belangrijkste oorzaak van wat voor die tijd 'posttransfusie non-A, non-B hepatitis' werd genoemd (Choo 1989). HCV is een 50 nm (nanometer) groot, enkelstrengs RNA-virus met een lipide envelop en infecteert hepatocyten (levercellen). HCV komt alleen voor bij mensen en (experimenteel) bij enkele genetisch sterk verwante primaten zoals chimpansees. Vanwege overeenkomsten in de opbouw van het virale genoom is HCV ondergebracht in de familie Flaviviridae, samen met onder andere het gelekoortsvirus, denguevirus, westnijlvirus en japanse-encefalitisvirus (Kuiken 2009).
Het virale genoom van HCV codeert voor 1 groot eiwit. Dit polyproteïne wordt later gesplitst in 3 structurele eiwitten (de kern en 2 envelopeiwitten) en 7 niet-structurele eiwitten die coderen voor de verschillende virale enzymen. HCV vermenigvuldigt zich snel; per dag kunnen in een chronisch geïnfecteerde patiënt een biljoen virusdeeltjes worden geproduceerd. HCV-replicatie wordt slordig uitgevoerd (replicatie zonder proofreading), wat leidt tot een zeer hoge mutatiesnelheid en dus ook een enorme diversiteit van het virus (Lindenbach 2005).
In totaal zijn er 7 HCV-genotypes bekend (1 t/m 7), die, met uitzondering van genotypes 5 en 7, verder zijn onderverdeeld in subtypes (a, b, c, …). De genotypes zijn niet uniform over de wereld verdeeld (Kuiken 2009, Ray 2018). Er zijn subtypes die wereldwijd voorkomen, (1a, 1b, 2b en 3a) en er zijn subtypes die specifiek geassocieerd met bepaalde geografische locaties (van de Laar 2006, Kuiken 2009, Gower 2014).
Ook verschilt de verdeling van genotypes per transmissieroute. In Nederland zijn genotypes 1a, 3a en 4d vooral geassocieerd met injecterend drugsgebruik; 1b, 2a, 2b en 2c met geïnfecteerde bloedtransfusies voor implementatie van HCV-donorscreening in 1991 en nosocomiale transmissie; en verspreiden 1a en 4d zich momenteel onder (hivpositieve) mannen die seks hebben met mannen (MSM) (van de Laar 2009a).
Epidemiologie
Verspreiding in de wereld
Wereldwijd wordt geschat dat 184 miljoen mensen antistoffen hebben tegen HCV, waarvan 71 miljoen het virus chronisch bij zich dragen. De HCV-prevalentie verschilt enorm per land en per risicogroep (Gower 2014).
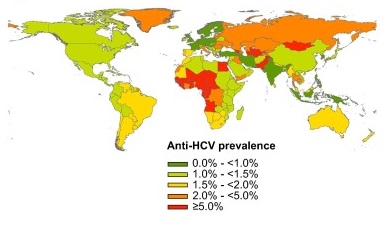
De laagste HCV-prevalenties worden gevonden in Noordwest-Europa. Hoge HCV-prevalenties worden vooral gevonden in Azië en Afrika met een gemiddelde prevalentie van > 3,5%. Zuidoost-Azië, Zuid-Amerika, Australië en Sub-Sahara-Afrika zijn regio's met een prevalentie van 1,5-3,5% (Thrift 2017). In Egypte is de prevalentie hoog (10-15%) als gevolg van een onhygiënisch uitgevoerde overheidscampagne (hergebruikte naalden) in 1920-1960 met parentale behandeling tegen bilharzia (Kandeel 2017). Voor de introductie van routinematige HCV-screening van bloed en bloedproducten hebben ook in West-Europa grootschalige besmettingen met HCV plaatsgevonden door bijvoorbeeld gecontamineerde batches stollingsfactoren anti-D-immunoglobulines (Wiese 2005).
Figuur: Anti-HCV prevalentie
Voorkomen in Nederland
Na het invoeren van de meldingsplicht voor HCV-infecties in april 1999 werden er, tot oktober 2003, 600-700 meldingen per jaar gedaan (3,9-4,1 per 100.000 inwoners). Het merendeel betreft chronische HCV. Slechts een zeer kleine minderheid (circa 3%) betreft acute HCV (Op de Coul 2003). De ware incidentie is onbekend omdat slechts 10-15% van de acute HCV-infectie symptomatisch verloopt.
Tussen oktober 2003 en december 2018 was de meldingsplicht beperkt tot alleen acute/recente HCV-infecties (jaarlijks 30-70 meldingen). Sinds 1 januari 2019 is de meldingsplicht voor chronische HCV weer opnieuw ingevoerd vanwege de verbeterde behandelingsmogelijkheden.
De geschatte anti-HCV-prevalentie onder de algemene bevolking in Nederland is 0,06-0,27% en is daarmee een van de laagste ter wereld (Koopsen 2019).
In Nederland beperken HCV-infecties zich vooral tot de risicogroepen.
Volgens de laatste prevalentieschattingen vormen eerstegeneratiemigranten afkomstig uit endemische gebieden de grootste groep met HCV in Nederland (60% van het totaal aantal chronische HCV-infecties) met een prevalentie van 0,9% (= 13.819 migranten). HCV-infectie vond veelal plaats in het land van herkomst; eenmaal gevestigd in Nederland vinden er nauwelijks nog nieuwe infecties plaats onder migranten (Urbanus 2011).
Hivpositieve MSM (mannen die seks hebben met mannen) vormen ook een hoogrisicogroep met een prevalentie van 4,9% (n=672) (Koopsen 2019). Hoewel deze groep naar schatting slechts 3% uitmaakt van het totaal aantal mensen met een chronische HCV-infectie, is dit wel de groep waarin de meeste nieuwe infecties voorkomen.
De groep injecterende drugsgebruikers heeft, door het gebruik van vervuilde naalden, de hoogste prevalentie. Sinds de spuitomruilprogramma's zijn ingevoerd, is het aantal nieuwe infecties in deze groep echter bijna nul (de Vos 2013).
Voor specifieke informatie over de prevalentie onder risicogroepen, zie onderstaande tabel (Koopsen 2019).
| Risicogroep | HCV-RNA-prevalentie % (laag-hoge schatting) | Populatie in Nederland n (laag-hoge schatting) | Geschat aantal chronische gevallen n (laag-hoge schatting) |
|---|---|---|---|
| Eerstegeneratiemigranten afkomstig uit endemische landen* | 0,90% (0,37-1,44%) | 1.527.032 (1.527.032-1.527.032) | 13.819 (5.671-21.967) |
| Hivpositieve MSM | 4,92% (4,55-5,29%) | 13.650 (13.200-14.100) | 672 (601-746) |
| Hivpositieve injecterende drugsgebruikers | 59,35% (55,70-63,00%) | 511 (310-712) | 303 (173-449) |
| Hivpositieve niet-injecterende drugsgebruikers en niet-MSM | 3,68% (3,26-4,10%) | 8.889 (8.289-9.489) | 327 (270-389) |
| Hivnegatieve injecterende drugsgebruikers | 59,36% (34,93-83,78%) | 5.276 (4.357-6.194) | 3.131 (1.522-5.189) |
| Hemofiliepatiënten behandeld voor 1992 | 53,90% (49,96-57,84%) | 785 (450-1.120) | 423 (225-648) |
| Individuen met een laag risico (hidden population) | 0,03% (0,00-0,07%) | 12.623.206 (12.620.701-12.625.710) | 4.210 (0-8.421) |
| Totaal | 0,16% (0,06-0,27%) | 14.179.348 | 22,885 (8,461-37,809) |
NB. Hivnegatieve MSM met hoog-seksueel risicogedrag zijn mogelijk ook een risicogroep (prevalentie 4,8% in AMPrEP-studie, zie ook 'Seksuele transmissie' in de paragraaf Algemene preventieve maatregelen).
Zie voor actuele informatie over het voorkomen van HCV in Nederland:
- Hepatitis C (RIVM.nl)
- Virologische weekstaten
Pathogenese
Na binnenkomst in het lichaam, veelal via bloed-bloedcontact, verspreidt HCV zich via de bloedbaan verder door het lichaam. Tijdens seksuele transmissie van HCV bij hivpositieve MSM bereikt HCV waarschijnlijk de bloedbaan wanneer met HCV geïnfecteerd bloed of sperma in contact komt met (beschadigde) genitale slijmvliezen (Kaplan-Lewis 2015).
HCV is een hepatotroop virus en infecteert en repliceert hoofdzakelijk, maar niet uitsluitend, in hepatocyten (levercellen). Op de lange termijn kan leverschade als gevolg van een chronische HCV-infectie optreden door directe schade die HCV-replicatie in de levercel aanricht, evenals indirecte schade door de tegen HCV opgewekte immuunrespons (Mengshol 2007). Ook buiten de lever kunnen HCV-gerelateerde ziektes zoals HCV-gerelateerde auto-immuunziekte of lymfoproliferatieve aandoening optreden, veelal veroorzaakt door circulerende immuuncomplexen (Cacoub 2016).
Incubatieperiode
Gemiddeld 7 weken (spreiding 2-26 weken). Hivpositieven tonen vaak later HCV-antistoffen dan hivnegatieven (Seeff 2002 Vogel 2009).
Ziekteverschijnselen
Acute HCV
Het merendeel van de acute HCV-infecties verloopt zonder of met slechts milde aspecifieke klachten. Slechts 30-50% rapporteert vermoeidheid, milde griepachtige symptomen, misselijkheid, overgeven, donkere urine en/of verkleurde ontlasting en pijn rechtsboven in de buik als gevolg van acute HCV. In minder dan 10% van de patiënten wordt dit gevolgd door icterus (geelzucht). De klachten kunnen 3-12 weken aanhouden, maar gaan meestal vanzelf weer over, wanneer de ALT-spiegels weer zijn gedaald.
Acute HCV verloopt hoogst zelden fulminant. Zonder behandeling slaagt 10-40% van de HCV-geïnfecteerden erin binnen 6 maanden het virus kwijt te raken (klaren van de infectie) (Micallef 2006). De overige onbehandelde HCV-geïnfecteerden blijven chronisch geïnfecteerd met het virus en dragen levenslang HCV-antistoffen met zich mee. Wanneer de infectie wordt geklaard, zal de hoeveelheid antistoffen geleidelijk afnemen (vaak binnen 12 weken, maar kan tot 2 jaar duren). Dit leidt tot een zwak-positieve of dubieuze blot (Micallef 2006).
De volgende personen hebben een verhoogde kans om HCV spontaan te klaren, zonder tussenkomst van therapie (Seeff 2002, Sagnelli 2009, Aisyah 2018):
- personen ≤ 45 jaar;
- personen met een symptomatische acute infectie;
- vrouwen - oestrogeen speelt mogelijk en rol bij spontane klaring van HCV;
- personen met een witte huidskleur - spontane klaring van HCV treedt minder vaak op bij mensen met een donkere huidskleur; dit wordt hoogstwaarschijnlijk deels veroorzaakt door een hogere prevalentie van het beschermende IL28B CC genotype bij witte mensen in vergelijking met andere etnische groepen (Thomas 2009);
- personen met een chronische hepatitis B-co-infectie (HbsAg-positief);
- personen met een gunstig IL28B-genotype (CC) versus het ongunstige IL28B-genotype (CT of TT);
- personen zonder hiv-co-infectie;
- personen met een HCV-genotype 1-infectie.
Acute HCV bij personen met een hivinfectie
Bij personen met een hivinfectie verlopen de klachten van een acute infectie met HCV vaak milder en/of treden vaak minder hoge leverenzymstijgingen op. Dit is waarschijnlijk afhankelijk van het aantal CD-4 cellen (hoe hoger hoe beter de immuunrespons). Slechts bij 55% van de personen met een hivinfectie stijgen de leverenzymen tot 5x boven de normaalwaarde, in vergelijking met 83% bij personen zonder hiv (Vogel 2009). Van de mensen met hiv-HCV-co-infectie is 5-20% in staat om HCV zonder behandeling te klaren; meer dan 80% blijft chronisch geïnfecteerd met beide virussen (van de Laar 2009a). Hiv-geïnfecteerden hebben een significant sneller beloop naar levercirrose dan patiënten met een mono-infectie.
Chronische HCV
Een chronische HCV-infectie wordt bij velen gekenmerkt door een lange klachtenvrije periode. HCV-RNA blijft aantoonbaar in het bloed en vaak blijven afwisselend verhoogde en normale ALT-spiegels bestaan als teken van meer of minder ernstige leverontsteking. Slechts bij een minderheid (15-30%) ontstaan niet-specifieke verschijnselen als moeheid of malaise in de acute fase van de infectie (Hajarizadeh 2013).
Een chronische infectie met HCV kan, wanneer er niet behandeld wordt, leiden tot leverfibrose, levercirrose, leverfalen en hepatocellulair carcinoom (HCC). Naar schatting heeft 16% 20 jaar na infectie levercirrose; na 30 jaar is dit 2x zoveel. Naarmate men ouder is (> 40 jaar), neemt de kans op levercirrose toe. Ook risicofactoren zoals roken en overmatig alcoholgebruik verhogen dit risico. Na 30 jaar heeft 1-3% kans op HCC. Soms ontwikkelt levercirrose zich al binnen enkele jaren; bij anderen is er gedurende vele jaren geen progressie (Hajarizadeh 2013).
Bij gecompenseerde levercirrose blijven symptomen vaak uit. Pas als de ziekte in een vergevorderd stadium is en er sprake is van gedecompenseerde cirrose, treden symptomen van leverdisfunctie op (geelzucht, ascites, encefalopathie en gastro-intestinale bloedingen met name van oesofagusvarices). In dit stadium van de ziekte is de prognose voor de patiënt sterk verslechterd. Als er eenmaal levercirrose is opgetreden, is er een kans van 2-4% per jaar op ernstige complicaties, zoals leverkanker en/of leverfalen (Seeff 2002, Hajarizadeh 2013).
Ten minste 40% van de chronisch geïnfecteerden krijgt last van ten minste een van de zogenaamde extrahepatische uitingen van HCV. Extrahepatische uitingen van HCV zijn vooral diabetes en depressie (Younossi 2016). Volgens schattingen overlijden jaarlijks in Nederland 300-350 personen aan een chronische HCV-infectie, waaraan het ontwikkelen van cirrose en HCC vaak ten grondslag ligt (Hofman 2016). Sinds de intrede van de nieuwe behandeling met DAA (direct acting antivirals; zie paragraaf Behandeling) wordt vrijwel iedereen genezen; de verwachting is dat de mortaliteit ten gevolge van HCV de komende jaren zal dalen.
Natuurlijke immuniteit
De ontwikkeling van HCV-antilichamen leidt niet tot beschermende immuniteit. De snelle evolutie van het virus binnen zijn gastheer, vooral in hypervariabele gedeeltes van de envelopeiwitten, verklaart mogelijk waarom het virus voortdurend aan het menselijk afweersysteem kan ontsnappen. Zelfs wanneer een eerste HCV-infectie spontaan uit het lichaam wordt verwijderd, is dit geen garantie voor beschermende immuniteit tegen een mogelijk volgende blootstelling; men kan dus een herinfectie met hetzelfde of een ander genotype oplopen. Gedeeltelijke immunologische bescherming bij herinfectie, die resulteert in lagere en slechts tijdelijke viremie en mogelijk bescherming biedt tegen specifieke virusvarianten wordt niet uitgesloten (Osburn 2010).
In hoogrisicogroepen, in Nederland voornamelijk mannen die seks hebben met mannen, komt een HCV-herinfectie (het oplopen van een nieuwe HCV-infectie nadat een eerdere HCV-infectie met of zonder tussenkomst van therapie uit het lichaam is verwijderd) veelvuldig voor (van de Laar 2009b, Lambers 2011).
Reservoir
De mens (experimentele besmetting van chimpansees is mogelijk) (Burm 2018).
Transmissie
Besmettingsweg
Overdracht van HCV geschiedt voornamelijk door direct bloed-bloedcontact en in sommige risicogroepen ook tijdens hoogrisico-seksueel contact (onder andere onbeschermd anaal contact).
Iatrogene transmissie
Voor 1992 was overdracht via transfusie van bloed en bloedproducten (bijvoorbeeld stollingsfactor 8 bij hemofiliepatiënten) een van de belangrijkste besmettingswegen. Sinds de invoer van HCV-donorscreening in 1991 is het risico om HCV op te lopen via bloed, bloedproducten of orgaanweefseldonaties verwaarloosbaar klein geworden (van de Laar 2006).
Medische of tandheelkundige ingrepen, en in het bijzonder hemodialyse, zijn mogelijke andere bronnen van iatrogene HCV-transmissie. Zelfs in landen waar de gezondheidszorg voldoet aan een hoge hygiënische standaard (zoals Nederland) worden incidenteel (uitbraken van) HCV-infecties waargenomen in dialysecentra of als gevolg van gecontamineerde 'multi-dose vials', slecht gesteriliseerde medische apparatuur of chirurgische ingrepen (Schneeberger 2000, Prati 2006). De kans op overdracht via risicovormend personeel is in Nederland minimaal (Zaaijer 2012).
Parenterale transmissie
Parenterale overdracht van HCV als gevolg van het delen van spuiten en naalden door injecterende drugsgebruikers is dé belangrijkste route van HCV-transmissie in Westerse landen zoals Australië en de Verenigde Staten. In Nederland is het aantal nieuwe HCV-infecties als gevolg van injecterend drugsgebruik de laatste jaren sterk afgenomen door zowel de impopulariteit van injecterend drugsgebruik en een effectief risicoreductiebeleid bestaande uit onder meer spuitomruilprogramma's en methadonbehandeling (de Vos 2013). Toch zijn veel van de huidige chronische HCV-infecties in Nederland veroorzaakt door onveilig injecterend drugsgebruik in het verleden. Ook het delen van rietjes en lepels om drugs te bereiden, en in mindere mate het delen van crackpijpjes of rietjes door niet-injecterende drugsgebruikers, kan mogelijk leiden tot overdracht van HCV (Scheinmann 2007).
Andere gedragingen of accidenten die mogelijk leiden tot bloed-bloedcontact zijn beschreven als routes voor HCV-overdracht, zoals prikaccidenten, accidenten waarbij lichamelijk of seksueel geweld wordt gebruikt, tatoeëren, piercen, acupunctuur, besnijdenis, het gemeenschappelijk gebruik van scheergerei, manicure-/pedicureartikelen, en het delen van tandenborstels. De mate waarin ze bijdragen aan de verspreiding van HCV is onzeker.
Seksuele transmissie
Seksuele transmissie van HCV kan optreden. In langdurige heteroseksuele relaties waarbij vaginaal contact plaatsvindt, wordt seksuele transmissie zelden waargenomen. De kans op heteroseksuele transmissie is klein en wordt geschat op 0-0,7% per jaar in langdurige monogame relaties, wat neerkomt op 1 transmissie op 190.000 seksuele contacten (Terrault 2013). Heteroseksuelen met meerdere wisselende contacten hebben een kans van 0,4-1,8% per jaar op overdracht (Terrault 2002), waarbij achterliggende risicofactoren zoals drugsgebruik ook nog een rol kunnen spelen.
HCV manifesteert zich sinds eind jaren 90 wel in toenemende mate als seksueel overdraagbare aandoening (soa) bij hivpositieve mannen die seks hebben met mannen (MSM) (van de Laar 2009a). Factoren die een rol spelen bij de overdracht van HCV tijdens seksueel contact zijn (Kaplan-Lewis 2015, van de Laar 2017):
- aanwezigheid HCV-RNA in het sperma;
- tijdens een acute hivinfectie;
- onbeschermd anaal seksueel contact;
- het delen van handschoenen en/of seksspeeltjes;
- recreatief drugsgebruik waarbij naalden of rietjes worden gedeeld;
- slijmvliesbeschadigingen veroorzaakt door onder andere ruwe seksuele technieken;
- aanwezigheid soa.
Hivnegatieve MSM lijken geen verhoogd risico te lopen op HCV (Urbanus 2009). Echter in de AMPrEP-studie (een studie naar gebruik van pre-expositieprofylaxe (PrEP) bij hivnegatieven) is bij aanvang van PrEP (pre-expositieprofylaxe)-gebruik wel een hoge prevalentie van HCV (4,8%) onder hivnegatieven gevonden. De genotypes van deze HCV+/hiv-MSMdie met PrEP begonnen, behoorden tot een MSM-specifiek cluster (Urbanus 2009, Hoornenborg 2017), wat suggereert dat transmissie plaatsvindt tussen het hivpositieve netwerk en het hivnegatieve netwerk. Een meer algemeen gebruik van PrEP kan de toename van HCV onder hivnegatieve MSM versnellen. Daarom is het aan te bevelen om deze groep hivnegatieven met hoogrisicogedrag regelmatig te testen (Price 2018).
Overig
De transmissieroute blijft in sommige gevallen onduidelijk. Als gevolg van de vaak lange periode tussen infectie en diagnose spelen herinneringsbias en (bewust) verzwegen risicogedrag mogelijk een rol. Een deel van de infecties kan veroorzaakt zijn door minder voor de hand liggende gedragingen of onhygiënische medische handelingen die mogelijk tot bloed-bloedcontact hebben geleid. HCV-overdracht via personen met wie men samenleeft of intensief contact heeft, zogenaamde intrafamiliaire transmissie, is beschreven; de kans op overdracht binnen het gezin lijkt echter zeer klein (Indolfi 2013).
Perinatale transmissie
Perinatale transmissie naar het kind geschiedt bij 4-14% van de HCV-RNA-positieve moeders en is afhankelijk van de virale load van de moeder (England 2006, Chappell 2018, Pott 2018). Er is overdracht beschreven in drie fases van de zwangerschap/bevalling, namelijk intra-uterien, peripartum en postpartum. Van alle moeder-op-kindtransmissies die plaatsvinden is 30-40% intra-uterien en 60% peripartum; postpartum komt zelden voor.
Wanneer de moeder ge-co-infecteerd is met hiv is de kans op overdracht naar het kind 3-4 keer hoger. De wijze van bevallen (vaginaal of via een keizersnede) heeft, voor zover nu bekend is, geen invloed op de overdracht van het virus. Hoewel het hepatitis C-virus is aangetroffen in moedermelk, lijkt het aantal virusdeeltjes te laag te zijn voor overdracht (Pott 2018).
Besmettelijke periode
Het bloed van een HCV-geïnfecteerde is infectieus zolang er HCV-RNA aantoonbaar is. Dit kan 1 week na de besmetting al het geval zijn.
In chronische en acute HCV-geïnfecteerde MSM heeft men HCV-RNA in het sperma gevonden. Dit blijkt niet afhankelijk te zijn van hivstatus of de fase van de HCV-infectie. Tijdens onderzoek werd er bij een derde van de hivgeïnfecteerde MSM met HCV HCV-RNA in het sperma gevonden, waarbij de virale load hoog genoeg was voor overdracht van het virus (Bradshaw 2015, Turner 2016).
Besmettelijkheid
Beschreven kansen op overdracht bij een prikaccident met HCV-positief bloed lopen uiteen van 0 tot 10%, afhankelijk van het type prikaccident (zie de LCI-richtlijn Prikaccidenten). Geschat wordt dat er per prikaccident een kans van 1,9% is op HCV-overdracht; dit is lager dan voor HBV (hepatitis B-virus) en hoger dan voor hiv (Naggie 2017).
Er bestaat een kans van circa 4-14% dat HCV in de perinatale periode wordt overgedragen van moeder naar kind. Dit is afhankelijk van de virale load van de moeder. Deze kans wordt 3-4 keer hoger als de moeder ge-co-infecteerd is met hiv (England 2006, Pott 2018).
De kans op seksuele overdracht van HCV is klein en lijkt zich voornamelijk te beperken tot hivpositieve MSM. De kans in deze groep neemt echter mogelijk toe bij aanwezigheid van een andere soa of bij veel wisselende seksuele contacten (Terrault 2002, van de Laar 2007, Terrault 2013, Vanhommerig 2015b).
Risicogroepen
Verhoogde kans op infectie
De overdracht via bloed bepaalt grotendeels de risicogroepen voor HCV-infectie:
- (voormalige) injecterende drugsgebruikers;
- eerstegeneratiemigranten uit hoogendemische gebieden (prevalentie > 2%, waarbij transmissie vaak heeft plaatsgevonden door nosocomiale overdracht (infectie opgelopen door verblijf in ziekenhuis) of intraveneus druggebruik;
- hivpositieve mannen die seks hebben met mannen (MSM);
- hivnegatieve MSM op PrEP;
- personen met een tatoeage of piercing gezet onder onhygiënische omstandigheden of gezet in een HCV-endemisch land;
- personen die ongetest bloed of ongeteste bloedproducten of weefsel- of orgaantransplantaten ontvingen (in Nederland voor 1992);
- dialysepatiënten;
- kinderen geboren uit HCV-positieve moeders.
Behandeling
Zie het multidisciplinaire HCV-richtsnoer (2018).
Vanaf eind 2014 zijn nieuwe, direct werkende antivirale middelen (direct acting antivirals; DAA's) beschikbaar in Nederland. Voor acute HCV zijn de DAA's (nog) niet geregistreerd en wordt men alleen in studieverband behandeld in de acute fase. Voor chronische HCV worden de behandelingen volledig vergoed via het basispakket van de zorgverzekering. Door de intrede van DAA's is een volledig orale en interferonvrije behandeling mogelijk geworden, waarbij de behandelduur ook aanzienlijk is verkort (8-12 weken).
Behandeling met een combinatie van deze nieuwe DAA's is zeer effectief en brengt over het algemeen nauwelijks bijwerkingen met zich mee. De behandeling wordt als succesvol beschouwd zodra 12 weken na het einde van de behandeling geen HCV-RNA meer in het bloed kan worden aangetoond. Dit wordt 'sustained virological response' ofwel SVR genoemd. In tegenstelling tot SVR bij de behandeling van hiv en chronische HBV, betekent SVR bij HCV genezing van de HCV-infectie.
Het doel van een HCV-behandeling is het verlagen van mortaliteit en levergerelateerde morbiditeit (zoals eindstadium leverziekte en hepatocellulair carcinoom) en het voorkomen van verdere verspreiding van HCV. Sinds 1 oktober 2015 worden alle DAA's voor alle patiënten met een chronische HCV-infectie in Nederland vergoed.
Met de beschikbaarheid van de DAA's is het extra relevant om alle patiënten meteen chronische HCV-infectie tijdig in beeld te krijgen en te behandelen, ook om transmissie te voorkomen. De GGD (Gemeentelijke gezondheidsdienst) kan een coördinerende rol spelen in de toeleiding tot specialistische zorg voor HCV-patiënten.
Diagnostiek
Zie ook Diagnostisch Vademecum Hepatitis C.
Microbiologische diagnostiek
Microbiologische diagnostiek naar HCV bestaat uit een combinatie van serologische en moleculaire testen. Het te kiezen testalgoritme is afhankelijk van het mogelijke/vermoedelijke moment van blootstelling. De ontwikkeling van detecteerbare HCV-antistoffen duurt gemiddeld 65 dagen; > 90% van de HCV-geïnfecteerden ontwikkelt detecteerbare HCV-antistoffen binnen 3 maanden na blootstelling aan het virus (Glynn 2005). De ontwikkeling van HCV-antistoffen in immuungecompromitteerde patiënten (bijvoorbeeld hivpatiënten of patiënten die behandeld worden met immuunsuppressiva) kan vertraagd verlopen (tot 12 maanden) of helemaal niet plaatsvinden (Thomson 2009, Vanhommerig 2014).
Voor screening op een infectie met HCV start de microbiologische diagnostiek met een anti-HCV bepaling (zie algoritme A), meestal een enzyme immunoassay (EIA). Wanneer blootstelling aan HCV mogelijk korter dan 3 maanden geleden heeft plaatsgevonden, of wanneer de patiënt een (sterk) verminderde afweer heeft, start microbiologische diagnostiek met een HCV EIA (enzym immunoassay) in combinatie met een HCV-RNA (zie algoritme B).
Doorverwijzing naar een internist-infectioloog of maag-, darm- en lever (MDL)-arts dient plaats te vinden na een positieve HCV-RNA-test, of, indien geen HCV-RNA-test wordt uitgevoerd, na geconfirmeerde positieve HCV-serologie.
Directe diagnostiek en indirecte diagnostiek
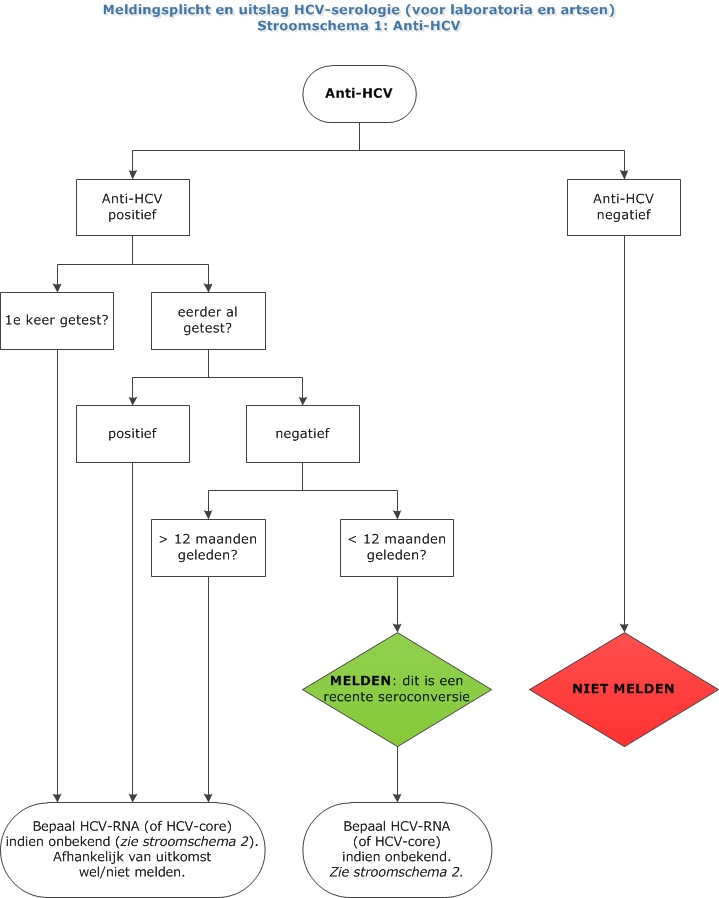
Algoritme A: verdenking chronische HCV-infectie (blootstelling > 3 maanden geleden)
Bij verdenking op een chronische HCV-infectie geschiedt microbiologische diagnostiek in 2 of 3 stappen, te beginnen met een HCV-antistof bepaling.
Een negatieve HCV-antistoftest sluit een HCV-infectie in de meeste gevallen uit. Een HCV-infectie zonder aantoonbare HCV-antistoffen kan voorkomen bij immuungecompromitteerde personen en bij personen met een recente HCV-infectie vanwege de relatief lange periode tussen besmetting en het aantoonbaar worden van HCV-antistoffen in bloed (gemiddeld 60-70 dagen).
Een positieve HCV-antistoftest dient altijd een vervolg te krijgen om de aan-of afwezigheid van een actuele HCV-infectie vast te stellen. Vervolgonderzoek na een positieve HCV-antistoftest bestaat uit een HCV-RNA-bepaling (i) en/of HCV-immunoblot (ii). Een HCV-RNA-bepaling bevestigt de aan- of afwezigheid van een actuele HCV-infectie. De immunoblot bevestigt de aan- of afwezigheid van HCV-antistoffen. Aangezien de aanwezigheid van HCV-RNA bepaalt of iemand voor behandeling doorverwezen wordt, wordt in de praktijk de HCV-immunoblot veelal overgeslagen en gekozen voor een HCV-RNA-bepaling.
- (i) Indien als vervolgstap gekozen wordt voor een HCV-RNA-bepaling en deze positief is, is er sprake van een bewezen actuele HCV-infectie. De patiënt dient voor behandeling doorverwezen te worden naar een internist-infectioloog of MDL (maag, darm en lever)-arts. Indien er geen HCV-RNA kan worden aangetoond, kan met een HCV-immunoblot onderscheid gemaakt worden tussen een doorgemaakte HCV-infectie en een initieel foutpositieve anti-HCV-test.
- (ii) Indien als vervolgstap gekozen wordt voor alleen een HCV-immunoblot en deze is positief, dan is blootstelling aan HCV bewezen. Echter, bij bewezen HCV-blootstelling dient alsnog een HCV-RNA-bepaling uitgevoerd te worden om onderscheid te maken tussen een actuele en een doorgemaakte HCV-infectie. Een negatieve HCV-immunoblot suggereert een foutpositieve HCV-antistoftest en dus afwezigheid van een actuele HCV-infectie. Echter, een actuele HCV-infectie bij een immuungecompromitteerde of ten gevolge van recente HCV-blootstelling (< 3 maanden geleden) kan met een negatieve HCV-immunoblot niet worden uitgesloten.
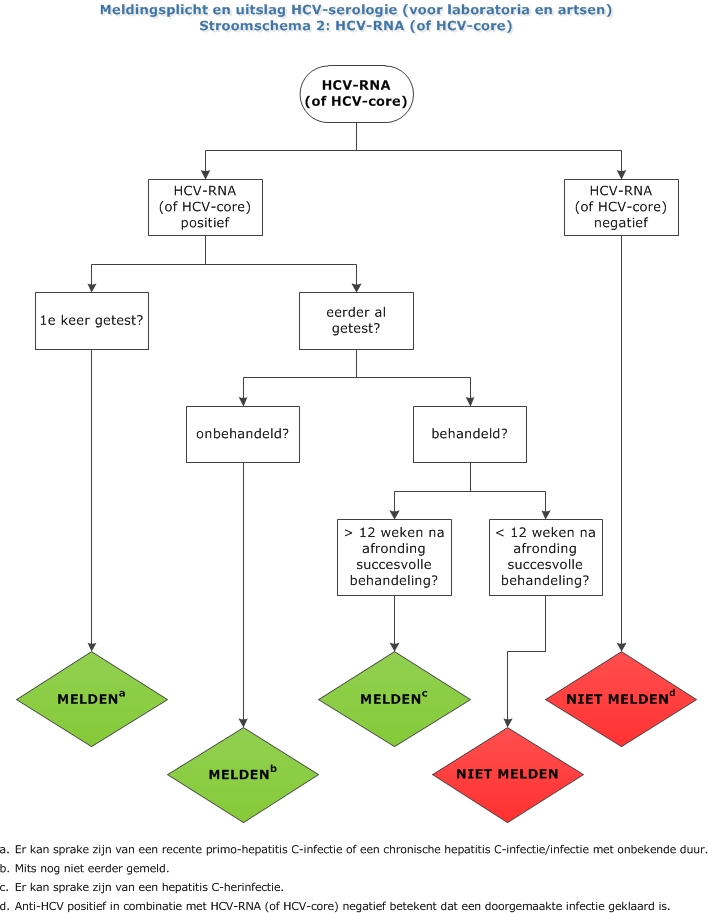
Algoritme B: vermoedelijke blootstelling < 3 maanden geleden, en bij patiënten met een verminderde afweer
Bij verdenking op een mogelijk recente HCV-infectie start microbiologische diagnostiek met een anti-HCV-bepaling in combinatie met een HCV-RNA-bepaling. HCV-RNA is door middel van een PCR na 7-10 dagen aantoonbaar in bloed (Glynn 2005). Starten met alleen een anti-HCV-bepaling zou tot een foutnegatief resultaat kunnen leiden, aangezien de ontwikkeling van detecteerbare HCV-antistoffen veelal 60-70 dagen duurt (window-periode). De standaard voor het aantonen van een actieve HCV-infectie is de aanwezigheid van HCV-RNA.
Buiten Nederland wordt naast de HCV-RNA test soms ook de core-antigeen (Ag)-test gebruikt om een actieve HCV-infectie aan te tonen. De detectielimiet van de huidige core-Ag-testen is 100-1100 IU/ml, wat 100x minder gevoelig is dan de huidige HCV-RNA-testen (Medici 2011, Cresswell 2015, Vanhommerig 2015). Vanwege de lagere gevoeligheid is de klinische meerwaarde van de core-Ag-test beperkt en wordt deze in Nederland (vrijwel) niet gebruikt.
| Anti-HCV | HCV-immunoblot | HCV-RNA HCV-Ag | Interpretatie testresultaten |
|---|---|---|---|
| NEG | NEG | NEG | Geen actuele HCV-infectie, en ook niet eerder doorgemaakt |
| POS | NEG | NEG | Geen actuele HCV-infectie, en ook niet eerder doorgemaakt |
| POS | POS | NEG | Geen actuele HCV-infectie, maar wel in het verleden een HCV-infectie doorgemaakt |
| POS | POS | POS | Actuele HCV-infectie, chronisch |
| POS | NEG | POS | Actuele HCV-infectie, recent |
| NEG | NEG | POS | Actuele HCV-infectie, acuut |
Rol van sneltesten voor HCV
Serologische sneltesten detecteren HCV-antistoffen in bijvoorbeeld vingerprikbloed of speeksel. Deze testen zijn geschikt als point-of-care-testing (POCT) voor HCV-screening op locatie. De sensitiviteit van de huidige serologische sneltesten is lager dan de meeste EIA's, waardoor mogelijk infecties gemist kunnen worden. Een positief testresultaat dient, net als bij een EIA, bevestigd te worden met vervolgtesten voordat er een definitieve conclusie getrokken kan worden over HCV-infectie. Serologische HCV-sneltesten worden alleen aanbevolen wanneer er geen laboratoriumfaciliteiten beschikbaar zijn, maar er wel geschoold personeel is voor het uitvoeren van de test en medische counseling (Tang 2017, Mane 2019).
Moleculaire sneltesten detecteren relatief snel het HCV-RNA in bloed of plasma. Vaak worden deze bepalingen uitgevoerd op apparatuur die geschikt is voor random access. De sensitiviteit en specificiteit van deze testen is goed (> 99% ten opzichte van andere diagnostische PCR-en). Het voordeel van deze testen is de snelle beschikbaarheid van het testresultaat (Gupta 2017).
Aanvullende microbiologische diagnostiek: HCV-virale load, HCV-genotypering en HCV-resistentiebepaling
De ontwikkeling van DAA's (protease (NS3/4A)-remmers, NS5A-remmers en polymerase (NS5B)-remmers) heeft de kans op succesvolle HCV-behandeling sterk verhoogd. De keuze van antivirale middelen wordt onder andere gebaseerd op het HCV-genotype, de hoogte van de HCV-virale load, de mate van leverfibrose/cirrose en het succes van een eventueel eerdere HCV-behandeling. De HCV-virale load-bepaling (kwalitatief en/of kwantitatief) wordt gebruikt om het effect van de therapie te meten.
Indien HCV-behandeling met een DAA-regime faalt, kan met een zogenaamde HCV-RAS (resistentie-geassocieerde substituties)-bepaling de aan- of afwezigheid van resistentiemutaties tegen een of meerdere van de antivirale middelen worden vastgesteld (EASL 2018; zie ook de HCV-richtsnoer). RAS kunnen bepaald worden door middel van sequentie-analyse.
Typering voor bron- en contactonderzoek
HCV-genotypering kan een suggestie geven over de mogelijke bron van infectie. In Nederland komen vooral HCV-subtypes 1a/b, 2a/b, 3a en 4d voor. Andere HCV-subtypes zijn vaak geassocieerd met specifieke geografische locaties buiten Nederland (Gower 2014). Binnen Nederland zijn HCV-stammen bekend (vooral subtypes 1a en 4d) die specifiek geassocieerd zijn met seksuele overdracht bij MSM (van de Laar 2009a). Daarnaast wordt HCV-genotypering met aanvullende fylogenetische analyse incidenteel ingezet om HCV-herinfectie na eerdere HCV-blootstelling te bevestigen (Lambers 2011).
Niet-microbiologische diagnostiek
In de klinische praktijk worden verhoogde ALT-spiegels vaak gebruikt als marker voor het wel of niet aanvragen van HCV-diagnostiek. Echter, in een groot deel van de HCV-geïnfecteerden blijven ALT-spiegels normaal (tot 71%), zelfs gedurende de acute fase van infectie. Dit benadrukt dat niet de verhoging van leverenzymen maar de aanwezigheid van HCV-risicofactoren leidend dient te zijn bij het aanvragen van HCV-diagnostiek (Matthews 2009, Thomson 2009, Vanhommerig 2015a). Andersom geldt wél dat wanneer er afwijkende leverfuncties (bijvoorbeeld verhoogde ALT-spiegels) worden waargenomen, onderzoek naar HCV en andere hepatitisvirussen geïndiceerd is.
Voorafgaand aan HCV-behandeling dient de mate van leverfibrose of -cirrose en de eventuele aanwezigheid van comorbiditeiten te worden vastgesteld (EASL 2018). De mate van leverfibrose of -cirrose wordt bij voorkeur vastgesteld met een non-invasieve methode, bijvoorbeeld met een fibroscan of door middel van het bepalen van bepaalde combinaties van biochemische parameters (Castéra 2005, Degos 2010). Patiënten met een acute, chronische of doorgemaakte/genezen infectie met hepatitis C dienen eveneens getest worden op de aanwezigheid van andere bloedoverdraagbare infecties, met name hiv, HBV, HAV (hepatitis A-virus) en HEV. Vaccinatie tegen HBV en HAV wordt aangeraden indien de patiënt niet gevaccineerd is of niet immuun is tegen deze virussen. Dit is een overweging die de behandelend arts dient te maken afhankelijk onder andere van blootstellingsrisico en mate van leverfibrose. De vaccinatie valt dan onder de Zorgverzekeringswet.
Preventie
Immunisatie
Er is nog geen vaccin ter voorkoming van hepatitis C.
Algemene preventieve maatregelen
Preventie van HCV berust op het vermijden van bloed-bloedcontact, veilig seksueel contact bij hivpositieve MSM, en op de veiligheid van bloedproducten en transplantaten. Aandacht voor het zich bewust zijn van de risicofactoren is daarom belangrijk.
Veiligheid van bloedproducten en donormaterialen
In Nederland wordt gebruikgemaakt van vrijwillige donoren. Personen uit groepen met het meeste risico (zoals MSM die < 1 jaar seksueel contact hebben gehad met een man en injecterend druggebruikers) worden dringend verzocht niet als donor op te treden. Bloedproducten worden in Nederland getest op anti-HCV en HCV-RNA om de kans op besmetting zo klein mogelijk te houden. Het residuele risico om in Nederland via een bloedtransfusie, bloedproducten of transplantaten HCV op te lopen wordt kleiner geschat dan 1 op 30 miljoen donaties (van de Laar 2006).
Veiligheid tijdens injecterend drugsgebruik
Momenteel wordt er een actief risicoreductiebeleid gevoerd onder injecterende drugsgebruikers. Het beleid omvat spuitomruilprogramma's, methadonverstrekking, counseling en het testen op HCV, het beschikbaar stellen van gebruikersruimten, voorlichting en training op het gebied van veilig spuiten (alleen eigen spuitmateriaal, desinfectie met chloorwater), en het ontmoedigen van injecterend drugsgebruik. Daarnaast is het gebruik van (injecterende) drugs tijdens seksuele activiteiten in opkomst (chemseks), vooral onder de doelgroep MSM (Nationale Drug Monitor Jaarbericht 2017).
Huishoudelijke transmissie
Hoewel de kans op overdracht binnen het gezin uiterst klein is, wordt aangeraden dat een HCV-patiënt uit voorzorg tandenborstel en scheergerei niet deelt met anderen.
Seksuele transmissie
Binnen een monogame heteroseksuele relatie is de kans op HCV zo klein dat condoomgebruik ter voorkoming van HCV niet nodig is (Terrault 2013).
De opkomst van HCV als soa bij hivpositieve MSM heeft geleid tot een actief preventiebeleid binnen deze doelgroep. Het preventiebeleid richt zich op:
- voorlichting over mogelijke risicogedragingen;
- bewustwording van risicoverhogend gedrag van HCV;
- behandeling in een vroeg stadium van de infectie;
- routinematige HCV-screening bij mogelijke blootstelling.
Sinds 2018 wordt aangeraden om alle hivpositieve MSM die op een soaconsult komen een anti-HCV- en HCV-RNA-test aan te bieden, omdat in deze risicogroep de incidentie het hoogst blijft (zie het draaiboek Consult seksuele gezondheid).
Hivpositieve MSM worden geadviseerd:
- altijd beschermde seks te hebben;
- seksspeeltjes te desinfecteren (voor meer informatie, zie www.nomorec.nl);
- bij bepaalde seksuele technieken een handschoen te gebruiken (bijvoorbeeld bij fisting).
(Her)opsporing van chronisch HCV-geïnfecteerden
Naar aanleiding van het Advies van de Gezondheidsraad (2016) en het Nationaal Hepatitisplan (2016) is een stuurgroep hepatitis aangesteld die zorg moet dragen voor de implementatie van een (her)opsporingsbeleid van chronisch HCV-geïnfecteerden, onder andere door actieve case finding. De doelen van dit beleid zijn de eliminatie van hepatitis in 2030, een daling van de incidentie met 90% en een daling van de mortaliteit met 65% (aansluitend op de WHO (World Health Organization)-doelen; zie Global Hepatitis Report 2017). Hiertoe is informatie beschikbaar zoals e-learningprojecten, foldermateriaal, overzichten van al uitgevoerde (her)opsporingsprojecten en aanvullende informatie over de vergunningplicht. Daarnaast is er een tool beschikbaar die regionaal inzicht geeft in het aantal HCV- en HBV-geïnfecteerde migranten en hun afkomst.
Veel GGD'en hebben in de afgelopen jaren heropsporingsprojecten uitgevoerd met wisselende resultaten. In 2018 is het landelijke project CELINE (Hepatitis C Elimination in The Netherlands) gestart, waarbij alle 8 academische ziekenhuizen al eerder gediagnostiseerde HCV-patiënten gaan heropsporen, evalueren en eventueel terug in zorg gaan brengen.
Reiniging, desinfectie en sterilisatie
Conform de standaardmethoden in de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Zie ook de LCHV-hygiënerichtlijn voor seksbedrijven en sekswerkers.
Zie voor aanvullende informatie over het desinfecteren van seksspeeltjes www.nomorec.nl.
Maatregelen
Meldingsplicht
Hepatitis C is een meldingsplichtige ziekte groep B2.
Dit houdt in dat artsen en hoofden van laboratoria bij vaststelling van de infectieziekte of verwekker dit binnen 1 werkdag moeten melden aan de GGD. De GGD meldt gepseudonimiseerd conform de Wet publieke gezondheid binnen 1 week aan het CIb (Centrum Infectieziektebestrijding) en levert gegevens voor de landelijke surveillance van meldingsplichtige ziekten.
Meldingscriteria
- Alle personen bij wie een anti-HCV seroconversie, of voor het eerst een HCV-RNA en/of HCV-core-antigeen is aangetoond, of bij wie voor het eerst een combinatie van anti-HCV en HCV-RNA is aangetoond (een recente primo hepatitis C-infectie of een chronische hepatitis C-infectie/infectie met onbekende duur)
OF
- Alle personen bij wie > 12 weken na afronding van eerdere succesvolle behandeling voor een HCV-infectie opnieuw HCV-RNA en/of HCV-core-antigeen is aangetoond (een hepatitis C-herinfectie)
Voor personen met een positieve HCV-antistoftest, van wie HCV-RNA en HCV-core-antigeen onbekend zijn, geldt het advies om HCV-RNA of HCV-core-antigeen te laten bepalen.
Personen met een positieve HCV-antistoftest, die recent negatief getest zijn op HCV-RNA en/of HCV-core-antigeen, hebben de infectie geklaard en worden daarom niet gemeld.
Definities HCV-infectie
Een recente primo hepatitis C-infectie is een aangetoonde HCV-antistofseroconversie in de afgelopen 12 maanden óf het voor het eerst aantonen van HCV-RNA en/of HCV-core-antigeen, zonder dat anti-HCV aantoonbaar is.
Hepatitis C-herinfectie is het voor het eerst opnieuw aantonen van HCV-RNA en/of HCV-core-antigeen meer dan 12 weken na afronding van succesvolle behandeling voor een HCV-infectie.
Een chronische hepatitis C-infectie/infectie met onbekende duur is het voor het eerst aantonen van HCV-RNA en/of HCV-core-antigeen én de infectie voldoet niet aan bovenstaande criteria voor recente primo-infectie of herinfectie.
Stroomschema's meldingsplicht en uitslag HCV serologie (voor laboratoria en artsen)
NB Een PDF-bestand van de stroomschema’s is bijgevoegd als bijlage.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing naar aanleiding van een melding van HCV dient uitgevoerd te worden door de GGD indien het een nieuwe of nog niet eerder gemelde (acute of chronische) HCV-infectie betreft.
Brononderzoek bij een acute of recente HCV is van belang in het geval van seksuele overdracht (voor eventuele partnerwaarschuwing) en in het geval van iatrogene verspreiding (transfusie, transplantatie, procedurefouten). Geadviseerd wordt om, indien mogelijk, bij bronopsporing maximaal 6 maanden in de tijd terug te gaan.
Bij posttransfusie- of posttransplantatie-HCV neemt de behandelend arts contact op met de betrokken bloedbank of de leverancier van het transplantaat om andere patiënten die behandeld zijn met het HCV-positief materiaal op te sporen en om nog niet gebruikt materiaal te blokkeren.
De bron van een chronische HCV-infectie kan meestal niet meer exact worden opgespoord. Wel is het zinvol om de meest voorkomende bronnen en transmissieroutes na te gaan. Bij bijvoorbeeld verdenking op een iatrogene bron, zoals plasmaferese of prikaccidenten, is het van belang om dit in beeld te krijgen.
Contactonderzoek
De transmissie van HCV vindt vrijwel alleen plaats via bloed-bloedcontact en via seksueel hoogrisico contact bij MSM, zie transmissie. Contactonderzoek bij huisgenoten wordt daarom niet standaard geadviseerd (Indolfi 2018, CDC 2015).
Contactonderzoek uitgevoerd door de GGD wordt aanbevolen bij;
- acute hepatitis C met klachten: 3 maanden voor start van de klachten;
- acute hepatitis C zonder klachten: 3 maanden voor laatste negatieve test;
- hepatitis C van onbekende duur, indien niet eerder of lang geleden getest: in ieder geval 1 jaar terug;
- kinderen van HCV-positieve moeders: indien de moeder ten tijde van de bevalling mogelijk al HCV-geïnfecteerd was (Pott 2018);
- kinderen die nog geboren moeten worden van een HCV-positieve zwangere: test bij geboorte (Pott 2018).
Informeer familieleden van HCV-positieve eerstegeneratiemigranten uit endemische gebieden, die zelf ook eerstegeneratiemigrant zijn (zie Hepatitistool voor een lijst van endemische landen). Overweeg om hen een HCV-test aan te bieden. De tweede generatie heeft geen verhoogde kans op HCV in vergelijking met de algemene Nederlandse populatie tenzij bij veelvuldig bezoek en eventuele medische behandelingen in het land van herkomst (Urbanus 2011).
Opgespoorde contacten dienen een HCV-test aangeboden te krijgen en tevens geïnformeerd te worden over de ziekte hepatitis C, over de mate van risico dat men mogelijk gelopen heeft (zie ook het Stappenplan hepatitis C).
Maatregelen ten aanzien van index, contacten en bron
- De huisarts in Nederland verwijst (conform de NHG-Standaard Virushepatitis) een acute of chronische HCV-patiënt naar een specialist (of deze te consulteren) om te beoordelen of de patiënt in aanmerking kan komen voor HCV-behandeling. Bij voorkeur wordt de patiënt verwezen naar een hepatitis behandelcentrum. HCV-geïnfecteerden moeten worden voorgelicht over het risico van HCV-overdracht door bloed-bloedcontact. Mensen met chronische HCV zijn ongeschikt voor bloed- of orgaandonorschap. Alcoholgebruik wordt sterk afgeraden omdat het leverschade als gevolg van HCV bespoedigt.
- MSM worden geadviseerd condooms of andere beschermingsmaatregelen (zoals een latex handschoen) te gebruiken tijdens seksuele activiteiten. Tevens wordt aanbevolen om seksspeeltjes en andere gebruikers attributen regelmatig te desinfecteren. (Voor aanvullende informatie over het schoonmaken van seksspeeltjes en andere adviezen rondom seksueel contact zie www.nomorec.nl). Omdat er geen vaccin bestaat, is voorlichting een belangrijk onderdeel van de preventie. Zeker gezien het feit dat in deze risicogroep de kans op een herinfectie hoog is (Ingiliz 2017).
- Mensen met een chronische hepatitis C-virusinfectie hebben een sterk verhoogde kans op een fulminante hepatitis, ernstige leverschade en eventueel overlijden als gevolg van een acute hepatitis A- en/of hepatitis B-infectie (Vento 2000, Chu 2008). Geadviseerd wordt hepatitis C-patiënten te vaccineren tegen zowel hepatitis A als hepatitis B, mits zij deze infecties niet eerder hebben doorgemaakt. Vaccinatie kan tijdens behandeling gegeven worden. Deze indicatie voor vaccinatie is, uitsluitend voor verzekerden, opgenomen in de farmaceutische regeling van de zorgverzekeraars.De kosten van de immunisatie betreffen individuele zorg en vallen daarmee onder de zorgverzekeringswet. De GGD kan deze kosten bij de zorgverzekeraar declareren op basis van de Beleidsregel overige geneeskundige zorg. Op het GGD kennisnet kunt u meer informatie over deze beleidsregel vinden.
- Contacten dienen een HCV-test aangeboden te krijgen en tevens geïnformeerd te worden over de ziekte hepatitis C over de mate van risico wat men mogelijk gelopen heeft.
Maatregelen ten aanzien van zwangeren
Kinderen van HCV-positieve moeders (indien de moeder ten tijde van de bevalling al was geïnfecteerd) dienen getest te worden (Chappell 2018). Overleg met een gespecialiseerd arts op welke leeftijden dit dient te gebeuren.
Omdat de perinatale transmissiekans niet wordt beïnvloed door de wijze van bevallen of door borstvoeding (zie paragraaf Besmettingsweg), gelden hiervoor geen bijzondere maatregelen en kan borstvoeding gewoon gegeven worden.
Postexpositieprofylaxe
Postexpositieprofylaxe tegen HCV is niet beschikbaar. Bij mogelijke blootstelling aan HCV dient gehandeld te worden zoals vermeld in de LCI-richtlijn Prikaccidenten.
Wering
Bij normaal sociaal verkeer vindt er geen overdracht van het virus plaats. Op scholen en kinderdagverblijven vormt HCV dus geen probleem.
Arbeidsrelevante aanvullingen
Deze aanvullingen zijn geschreven voor en door bedrijfsartsen en beschrijven de preventieve maatregelen om het oplopen van infectieziekten tijdens het werk te voorkomen (werknemer als risicoloper) en de maatregelen/aanpassingen die genomen kunnen worden bij vaststelling van de infectieziekte bij de werknemer (werknemer als risicovormer). In de werksituatie gelden de Arbowet, het Arbeidsomstandighedenbesluit (Arbobesluit) en de Europese Richtlijn 2000/54 gericht op preventie. Zie ook biologische agentia in de wet (Arboportaal.nl).
Arbeidsgerelateerde risicogroepen
(Para)medisch personeel (inclusief tandartsen) dat veel invasieve handelingen verricht (bijvoorbeeld gynaecologen), heeft een verhoogde kans op infectie met HCV (hepatitis C-virus).
Preventieve maatregelen op het werk
Bij verschillende beroepen kan mogelijk bloed-bloedcontact ontstaan, veelal in de zogenaamde geüniformeerde beroepen (gezondheidszorg, politie, brandweer).
Daar waar de kans op een prik-, bijt-, snij- of krabaccident zich 24 uur per dag en 7 dagen per week kan voordoen, is een 24-uurs bereikbare, laagdrempelige melding en risicobeoordeling noodzakelijk. Periodieke controle op de afhandeling van accidenten, analyse van accidenten en de eventueel daaruit voortvloeiende maatregelen wordt aanbevolen. Zie ook de Landelijke Richtlijn Prikaccidenten voor meer informatie.
Preventieve iatrogene transmissie door risicovormend personeel
Een risicovormer is iemand die risicohandelingen uitvoert. Risicohandelingen zijn die handelingen waarbij de kans op bloed-bloedcontact tussen gezondheidszorgwerker en patiënt groot is. Het betreft vooral handelingen waarbij de (gehandschoende) handen binnen lichaamsholten of wonden in contact kunnen komen met scherpe instrumenten, naalden of scherpe weefseldelen (bijvoorbeeld botpunten of gebitselementen), terwijl de handen of vingertoppen soms niet zichtbaar zijn. Zie voor meer informatie over de definitie van risicovormer de Landelijke Richtlijn Preventie van transmissie van hepatitis B-virus door risicovormend medisch personeel.
RIVM (Rijksinstituut voor Volksgezondheid en Milieu)/LCI is beschikbaar voor vragen over de preventie van transmissie van hepatitis C virus van medisch personeel naar patiënten en RIVM/LCI kan advies geven bij individuele casuïstiek.
Contact via e-mail: lci@rivm.nl
Contact via telefoon: 088 689 7000
Literatuur
- Aisyah DN, Shallcross L, Hully AJ et al., 2018. Assessing hepatitis C spontaneous clearance and understanding associated factors: a systematic review and meta-analysis. J Viral Hepat 25(6): 680-698.
- Bradshaw D, Lamoury F, Catlett B et al., 2015. A comparison of seminal hepatitis C virus (HCV) RNA levels during recent and chronic HCV infection in HIV-infected and HIV-uninfected individuals. J Infect Dis 211(5): 736-743.
- Burm R, Collignon L, Mesalam AA, et al., 2018. Animal models to study hepatitis C virus infection. Front Immunol 9: 1032.
- Cacoub P, Comarmond C, Domont F, et al., 2016. Extrahepatic manifestations of chronic hepatitis C virus infection. Ther Adv Infect Dis 3(1): 3-14.
- Castéra L, Vergniol J, Foucher J, et al., 2005. Prospective comparison of transient elastography, fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 128(2): 345-350.
- CDC (Centers for Disease Control and Prevention), 2015. Testing recommendations for hepatitis C virus infection. Page last reviewed October 15, 2015. Page accessed June 11, 2019.
- Chappell CA, Hillier SL, Crowe D, et al., 2018. Hepatitis C virus screening among children exposed during pregnancy. Pediatrics 141(6): pii: e20173273.
- Choo QL, Kuo G, Weiner AJ, et al., 1989. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 244(4902): 359-362.
- Chu CJ, Lee SD, 2008. Hepatitis B virus/hepatitis C virus coinfection: epidemiology, clinical features, viral interactions and treatment. J Gastroenterol Hepatol 23(4): 512-520.
- Cresswell FV, Fisher M, Hughes DJ, et al., 2015. Hepatitis C core antigen testing: a reliable, quick, and potentially cost-effective alternative to hepatitis C polymerase chain reaction in diagnosing acute hepatitis C virus infection. Clin Infect Dis 60(2): 263-266.
- Degos F, Perez P, Roche B, et al., 2010. Diagnostic accuracy of FibroScan and comparison to liver fibrosis biomarkers in chronic viral hepatitis: A multicenter prospective study (the FIBROSTIC study). J Hepatology 53(6): 1013–1021.
- EASL (European Association for the Study of the Liver), 2018. EASL recommendations on treatment of hepatitis C 2018. J Hepatol 69(2): 461-511.
- England K, Thorne C, Newell ML, 2006. Vertically acquired paediatric coinfection with HIV and hepatitis C virus. Lancet Infect Dis 6(2): 83-90.
- Glynn SA, Wright DJ, Kleinman SH, et al., 2005. Dynamics of viremia in early hepatitis C virus infection. Transfusion 45(6): 994-1002.
- Gower E, Estes C, Blach S, et al., 2014. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol 61(1 Suppl): S45-57.
- Gupta E, Agarwala P, Kumar G, et al., 2017. Point-of-care testing (POCT) in molecular diagnostics: performance evaluation of GenXpert HCV RNA test in diagnosing and monitoring HCV infection. J Clin Virol 88: 46-51.
- Hajarizadeh B, Grebely J, Dore GJ, 2013. Epidemiology and natural history of HCV infection. Nat Rev Gastroenterol Hepatol 10(9): 553-562.
- Hofman R, Nusselder WJ, Veldhuijzen IK, et al., 2016. [Mortality due to chronic viral hepatitis B and C infections in the Netherlands]. Ned Tijdschr Geneeskd 160: D511.
- Hoornenborg E, Achterbergh RCA, Schim van der Loeff MF, et al., 2017. MSM (mannen die seks hebben met mannen) starting preexposure prophylaxis are at risk of hepatitis C virus infection. AIDS 31(11): 1603-1610.
- Indolfi G, Nesi A, Resti M, 2013. Intrafamilial transmission of hepatitis C virus. J Med Virol 85(4): 608-614.
- Ingiliz P, Martin TC, Rodger A, et al., 2017. HCV reinfection incidence and spontaneous clearance rates in HIV-positive men who have sex with men in Western Europe. J Hepatol 66(2): 282-287.
- Kandeel A, Genedy M, El-Refai S, et al., 2017. The prevalence of hepatitis C virus infection in Egypt 2015: implications for future policy on prevention and treatment. Liver Int 37(1): 45-53.
- Kaplan-Lewis E, Fierer DS, 2015. Acute HCV in HIV-infected MSM: modes of acquisition, liver fibrosis, and treatment. Curr HIV/AIDS Rep 12(3): 317-325.
- Koopsen J, van Steenbergen JE, Richardsu JH, et al., 2019. Chronic hepatitis B and C infections in the Netherlands: estimated prevalence in risk groups and the general population. Epidemiol Infect 147: e147.
- Kuiken C, Simmonds P, 2009. Nomenclature and numbering of the hepatitis C virus. Methods Mol Biol 510: 33-53.
- van de Laar TJ, Koppelman MH, van der Bij AK, et al., 2006. Diversity and origin of hepatitis C virus infection among unpaid blood donors in the Netherlands. Transfusion 46(10): 1719-1728.
- van de Laar TJ, van der Bij AK, Prins M, et al., 2007. Increase in HCV incidence among men who have sex with men in Amsterdam most likely caused by sexual transmission. J Infect Dis 196(2): 230-238.
- van de Laar T, Pybus O, Bruisten S, et al., 2009a. Evidence of a large, international network of HCV transmission in HIV-positive men who have sex with men. Gastroenterology 136(5): 1609-1617.
- van de Laar TJ, Molenkamp R, van den Berg C, et al., 2009b. Frequent HCV reinfection and superinfection in a cohort of injecting drug users in Amsterdam. J Hepatol 51(4): 667-674.
- van de Laar TJ, Richel O, 2017. Emerging viral STIs among HIV-positive men who have sex with men: the era of hepatitis C virus and human papillomavirus. Sex Transm Infect 93(5): 368-373.
- Lambers FA, Prins M, Thomas X, et al., 2011. Alarming incidence of hepatitis C virus re-infection after treatment of sexually acquired acute hepatitis C virus infection in HIV-infected MSM. AIDS 25(17): F21-27.
- LCI 2024. Draaiboek soa- en hiv-partnermanagement. Februari 2024.
- Lindenbach BD, Rice CM, 2005. Unravelling hepatitis C virus replication from genome to function. Nature 436(7053): 933-938.
- Mane A, Sacks J, Sharma S, et al., 2019. Evaluation of five rapid diagnostic tests for detection of antibodies to hepatitis C virus (HCV): a step towards scale-up of HCV screening efforts in India. PLoS One 14 (1): e0210556.
- Matthews GV, Hellard M, Haber P, et al., 2009. Characteristics and treatment outcomes among HIV-infected individuals in the Australian Trial in Acute Hepatitis C. Clin Infect Dis 48(5): 650-658.
- Medici MC (Medisch Centrum), Furlini G, Rodella A, et al., 2011. Hepatitis C virus core antigen: analytical performances, correlation with viremia and potential applications of a quantitative, automated immunoassay. J Clin Virol 51(4): 264-269.
- Mengshol JA, Golden-Mason L, Rosen HR, 2007. Mechanisms of Disease: HCV-induced liver injury. Nat Clin Pract Gastroenterol Hepatol 4(11): 622-634.
- Micallef JM, Kaldor JM, Dore GJ, 2006. Spontaneous viral clearance following acute hepatitis C infection: a systematic review of longitudinal studies. J Viral Hepat 13(1): 34-41.
- Naggie S, Holland DP, Sulkowski MS, et al., 2017. Hepatitis C virus postexposure prophylaxis in the healthcare worker: why direct-acting antivirals don't change a thing. Clin Infect Dis 64(1): 92-99.
- Op de Coul EL, Bosman A, Laar M, 2003. Surveillance van hepatitis C in Nederland, 1992-2002: aangifte van HCV moet beter. Infectieziekten Bulletin (9): 323-327.
- Osburn WO, Fisher BE, Dowd KA, et al., 2010. Spontaneous control of primary hepatitis C virus infection and immunity against persistent reinfection. Gastroenterology 138(1): 315-324.
- Pott HJ, Theodoro M, de Almeida Vespoli J, et al., 2018. Mother-to-child transmission of hepatitis C virus. Eur J Obstet Gynecol Reprod Biol 224: 125-130.
- Prati D, 2006. Transmission of hepatitis C virus by blood transfusions and other medical procedures: a global review. J Hepatol 45(4): 607-616.
- Price JC, McKinney JE, Crouch PC, et al., 2018. Sexually acquired hepatitis C infection in HIV-uninfected men who have sex with men using pre-exposure prophylaxis against HIV. J Infect Dis. 219(9): 1373-1376.
- Ray RB, Ray R, 2019. Hepatitis C virus manipulates humans as its favorite host for long-term relationship. Hepatology 69(2): 889-900.
- Sagnelli E, Coppola N, Pisaturo M, et al., 2009. HBV (hepatitis B-virus) superinfection in HCV chronic carriers: a disease that is frequently severe but associated with the eradication of HCV. Hepatology 49(4): 1090-1097.
- Scheinmann R, Hagan H, Lelutiu-Weinberger C, et al., 2007. Non-injection drug use and hepatitis C virus: a systematic review. Drug Alcohol Depend 89(1): 1-12.
- Schneeberger PM, Keur I, van Loon AM, et al., 2000. The prevalence and incidence of hepatitis C virus infections among dialysis patients in the Netherlands: a nationwide prospective study. J Infect Dis 182(5): 1291-1299.
- Seeff LB, 2002. Natural history of chronic hepatitis C. Hepatology 36(5 Suppl 1): S35-46.
- Tang W, Chen W, Amini A, et al., 2017. Diagnostic accuracy of tests to detect hepatitis C antibody: a meta-analysis and review of the literature. BMC Infect Dis 17 (Suppl 1): 695.
- Terrault NA, 2002. Sexual activity as a risk factor for hepatitis C. Hepatology 36(5 Suppl 1): S99-105.
- Terrault NA, Dodge JL, Murphy EL, et al., 2013. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology 57(3): 881-889.
- Thomas DL, Thio CL, Martin MP, et al., 2009. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature 461(7265): 798-801.
- Thomson EC, Nastouli E, Main J, et al., 2009. Delayed anti-HCV antibody response in HIV-positive men acutely infected with HCV. AIDS 23(1): 89-93.
- Thrift AP, El-Serag HB, Kanwal F, 2017. Global epidemiology and burden of HCV infection and HCV-related disease. Nat Rev Gastroenterol Hepatol 14(2): 122-132.
- Turner SS, Gianella S, Yip MJ, et al., 2016. Shedding of hepatitis C virus in semen of human immunodeficiency virus-infected men. Open Forum Infect Dis 3(2): ofw057.
- Urbanus AT, van de Laar TJ, Stolte IG, et al., 2009. Hepatitis C virus infections among HIV-infected men who have sex with men: an expanding epidemic. AIDS 23(12): F1-7.
- Urbanus AT, van de Laar TJ, van den Hoek A, et al., 2011. Hepatitis C in the general population of various ethnic origins living in the Netherlands: should non-Western migrants be screened? J Hepatol 55(6): 1207-1214.
- Vanhommerig JW, Thomas XV, van der Meer JT, et al., 2014. Hepatitis C virus (HCV) antibody dynamics following acute HCV infection and reinfection among HIV-infected men who have sex with men. Clin Infect Dis 59(12): 1678-1685.
- Vanhommerig JW, van de Laar TJ, Koot M, et al., 2015a. Evaluation of a hepatitis C virus (HCV) antigen assay for routine HCV screening among men who have sex with men infected with HIV. J Virol Methods 213: 147-150.
- Vanhommerig JW, Lambers FA, Schinkel J, et al., 2015b. Risk factors for sexual transmission of hepatitis C virus among human immunodeficiency virus-infected men who have sex with men: a case-control study. Open Forum Infect Dis 2(3): ofv115.
- Vento S, 2000. Fulminant hepatitis associated with hepatitis A virus superinfection in patients with chronic hepatitis C. J Viral Hepat 7 Suppl 1: 7-8.
- Vogel M, Deterding K, Wiegand J, et al., 2009. Initial presentation of acute hepatitis C virus (HCV) infection among HIV-negative and HIV-positive individuals-experience from 2 large German networks on the study of acute HCV infection. Clin Infect Dis 49(2): 317-319; author reply 319.
- de Vos AS, van der Helm JJ, Matser A, et al., 2013. Decline in incidence of HIV and hepatitis C virus infection among injecting drug users in Amsterdam; evidence for harm reduction? Addiction 108(6): 1070-1081.
- Wiese M, Grungreiff K, Guthoff W, et al., 2005. Outcome in a hepatitis C (genotype 1b) single source outbreak in Germany: a 25-year multicenter study. J Hepatol 43(4): 590-598.
- Younossi Z, Park H, Henry L, et al., 2016. Extrahepatic manifestations of hepatitis C: a meta-analysis of prevalence, quality of life, and economic burden. Gastroenterology 150(7): 1599-1608.
- Zaaijer HL, Appelman P, Frijstein G, 2012. Hepatitis C virus infection among transmission-prone medical personnel. Eur J Clin Microbiol Infect Dis 31(7): 1473-1477.