Samenvatting
Verwekker: Parasiet: Echinococcus multilocularis (lintworm vos).
Incubatieperiode: Maanden tot vele jaren.
Besmettingsweg: Oraal: echinococcus-eitjes, bijvoorbeeld via door vossenfeces gecontamineerde grond, rauw voedsel of water.
Besmettelijke periode: Niet van mens op mens overdraagbaar.
Symptomen: Vaak asymptomatisch. Symptomen en beloop afhankelijk van de grootte en lokalisatie van de dunwandige en grillig gevormde cyste (lever, nier, CZS (centraal zenuwstelsel)), de groeisnelheid en het aantal cysten.
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding): 17 december 2024. Diagnostiek vastgesteld: 22 januari 2025.
Wijzigingen vanaf laatste vaststelling LOI:
-
18 maart 2025: Nieuwe indeling in achtergrondinformatie en een richtlijndeel (met de hoofdstukken Diagnostiek, Preventie en Maatregelen en en Veterinaire informatie). Historie is ondergebracht in andere hoofdstukken en ten dele vervallen.
-
14 januari 2025: Herziene richtlijn gepubliceerd (op 17 december 2024 vastgesteld door het LOI). De richtlijn is herzien door drs. Florien Dusseldorp, LCI (Landelijke Coördinatie Infectieziektebestrijding), RIVM (Rijksinstituut voor Volksgezondheid en Milieu) met uitzondering van het hoofdstuk Diagnostiek en de veterinaire informatie. Veterinaire informatie herzien door Joke van der Giessen en Titia Kortbeek (LCI, RIVM).
Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn: De oude richtlijn Echinokokkose is opgesplitst in twee richtlijnen: Alveolaire echinokokkose en Cysteuze echinokokkose. Alle hoofdstukken zijn geüpdatet. Er zijn geen significante wijzigingen doorgevoerd in de (preventieve) maatregelen.
Achtergronden
Verwekker
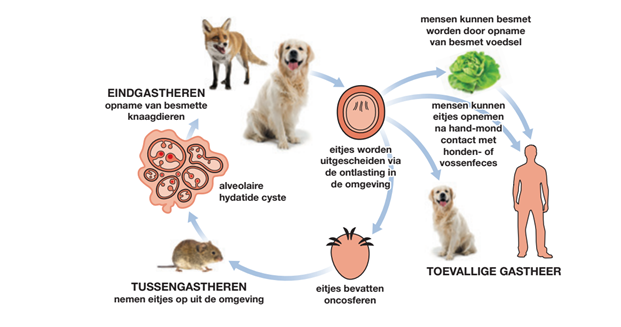
Echinococcus multilocularis is een kleine lintworm die in de dunne darm van wilde carnivoren zoals vos, wolf en wasbeerhonden, en in mindere mate ook bij honden en sporadisch bij katten, het volwassen stadium (de lintworm) kan bereiken. In de ontlasting van een geïnfecteerde wilde carnivoor komen infectieuze eitjes voor die op vegetatie (waaronder groente of fruit) kunnen komen en door kleine knaagdieren kunnen worden opgegeten (Beerli, 2017). In deze tussengastheren bevindt E. multilocularis zich in het larvale stadium. Dit presenteert zich als een blaasworm (hydatide). Als wilde carnivoren geïnfecteerde knaagdieren eten ontwikkelt zich in de dunne darm uit deze cysten weer een lintworm en is de cyclus rond.
Naast eindgastheer kan de hond ook tussengastheer zijn, door zichzelf te besmetten als hij zelf eitjes uitscheidt (auto-infectie) of door het eten van besmette vossenfeces. In dat geval ontwikkelt zich net als bij knaagdieren het blaaswormstadium. Ook de mens is een tussengastheer en kan na inname van eitjes het blaaswormstadium ontwikkelen, de mens is dan tevens een ‘dead-end host’. Zie figuur 1 voor de levenscyclus van E. multilocularis.
Figuur 1: Levenscyclus van E. multilocularis. Bron: ESCAPP BeNeLux.
Epidemiologie
Verspreiding in de wereld
E. multilocularis komt alleen voor op het noordelijk halfrond. De parasiet geeft wereldwijd een aanzienlijke ziektelast met meer dan 18.000 gevallen per jaar en een geschatte last van 660.000 voor DALY’s (Torgerson, 2010). In Europa is de humane incidentie van E. multilocularis-infecties significant gestegen sinds 2000, maar het overgrote deel van de humane casussen (ruim 90%) bevindt zich in China (Torgerson, 2010).
In Zwitserland, Oostenrijk, Zuid-Duitsland, België, Luxemburg, Oost-Frankrijk en Oost-Europa komt de vossenlintworm al langere tijd voor bij vossen. Het verspreidingsgebied van de parasiet breidt zich uit richting het noorden inclusief België, Nederland, Denemarken en Zweden en de Baltische Staten, maar ook naar Noordoostelijke gebieden zoals centraal Duitsland, Slowakije, Hongarije en Roemenië (Gloor, 2001). In Europa is de humane incidentie van E. multilocularis-infecties gestegen sinds 2000. In Zwitserland werd een tweevoudige stijging van de jaarlijkse incidentie gezien in de periode tussen 1993-2000 (10-15 casussen per jaar) en 2001-2005 (20-30 casussen per jaar) (Schweiger, 2007). Ook in Frankrijk en Oostenrijk is de incidentie gestegen. Sinds 1999 zijn er ook autochtone casussen gerapporteerd in Oost-Europese landen zoals in Litouwen, Slowakije, Slovenië, Roemenië, Tsjechië en Polen en in Noordwest Europese landen zoals Nederland en België. De humane casuïstiek ligt daarmee zoals verwacht redelijk in lijn met de distributie van E. multilocularis-geïnfecteerde vossen, hoewel daar vertraging in kan zitten gezien de lange incubatietijd van alveolaire echinokokkose bij mensen.
In Alberta in Canada is een recente toename van AE-casussen gerapporteerd, mogelijk geassocieerd met een toename van geürbaniseerde coyotes (Housten, 2021). In de VS zijn autochtone gevallen van menselijke AE historisch beperkt tot St. Lawrence Island, waar een spillover heeft plaatsgevonden vanuit de spitsmuis naar gedomesticeerde honden. Daarnaast zijn er in de VS enkele casus in het noorden van het vasteland van Alaska en één geval in de continentale VS (Davidson, 2016). In de voormalige Sovjet Unie worden besmette vossen in bijna alle gebieden gevonden, met name in de vallei van de Wolga, in het Oeralgebergte en in Siberië. In Rusland zijn meerdere humane AE-casussen gerapporteerd in de Altai republiek (welke grenst aan Aziatische landen). In Azië komt E. multilocularis historisch vooral voor in Noord-Azië met de meeste casussen in China en Japan, maar een toename van AE wordt ook gezien in Zuid-Siberië en Kyrgyzstan.
Voorkomen in Nederland
In Nederland is in 1997 een eerste geval van geïmporteerde E. multilocularis gemeld bij een patiënt uit Zwitserland (Raasveld, 1997). In 2008 en 2011 zijn in totaal 3 patiënten met alveolaire echinokokkose vastgesteld, waarbij de infectie vermoedelijk in Nederland is opgelopen. Daarna zijn er nog enkele casussen vastgesteld in Nederland waarbij het onzeker is of de infectie in Nederland of het buitenland is opgelopen.
Pathogenese
De mens raakt geïnfecteerd met de vossenlintworm (E. multilocularis) na ingestie van eitjes. E. multiloculariss vormt onregelmatige holtes gelijkend op longalveoli (vandaar de naam alveolaire echinokokkose) zonder vrije scolices erin (nieuwe lintwormen). Er is sprake van centrale necrose met holtevorming, sterk lijkend op een invasieve tumor, zonder cystenwand. Dit kan een beeld van een pseudocyste geven bij beeldvorming. Door deze andere structuur dan de duidelijke cysten bij cysteuze echinokokkose (CE), zie je maar zeer zelden acute allergische reacties bij alveolaire echinokokkose (AE).
Omdat het larvale stadium langzaam progressief doorgroeit in het weefsel in de aangedane organen, heeft een infectie met E. multilocularis een uitgesproken kwaadaardig beloop. In 92-100% van de gevallen groeit de parasiet destructief in het leverparenchym. Hematogene metastasering naar longen, skelet, ogen en hersenen kan optreden (10% van de patiënten).
Incubatieperiode
De incubatieperiode varieert van maanden tot jaren afhankelijk van de lokalisatie en groeisnelheid van de parasiet. Bij immuungecompromitteerden kan het verloop sneller zijn (Kern, 2011).
Ziekteverschijnselen
E. multilocularis veroorzaakt het ziektebeeld alveolaire echinokokkose (AE). Aanvankelijk ontwikkelt het larvale stadium van E. multilocularis zich bijna exclusief in de lever, vooral in de rechter leverkwab en groeit door alle structuren heen (door het diafragma naar de longen) of door hematogene verspreiding naar verder gelegen locaties (botten, spieren hersenen etc.). Primaire locaties buiten de lever zijn zeldzaam: 97% van de gevallen heeft een primaire laesie in de lever (Kern, 2003). Het merendeel van de infecties met E. multilocularis betreft waarschijnlijk een abortieve infectie waarbij alleen een serologisch litteken en mogelijk een kleine verkalkte laesie in de lever te zien is (Gottstein, 2001; Bresson-Hadni 1995).
De mortaliteit bij onbehandelde patiënten met een actieve infectie is hoog. Onbehandeld is de mortaliteit na 10 jaar >90% (Kern, 2011). In Europa is de levensverwachting bij het stellen van de diagnose door behandeling verschoven van 3 jaar in 1970 naar 20 jaar in 2005 (Torgerson, 2010).
Natuurlijke immuniteit
Er is tot nu toe geen bewijs dat tussengastheren (zoals de mens) in staat zijn een re-infectie met oncosferen (het larvale stadium) te weerstaan. Er zijn wel aanwijzingen dat herhaalde blootstelling aan echinococcuseitjes de immuniteit tegen een herhaalde infectie stimuleert. Deze immuniteit geldt niet voor de al aanwezige metacestoden.
Reservoir
De mens is geen reservoir, zie Dierlijke reservoirs in de bijlage Veterinaire informatie.
Transmissie
Besmettingsweg
De mens wordt besmet door het eten van echinococcuseitjes, bijvoorbeeld door ingestie van door vossenfeces gecontamineerde grond, rauwe groenten of zachtfruit en besmet water. Lintwormeitjes kleven aan schoenzolen of aan de haren van besmette eindgastheren en kunnen zo worden verspreid. De mens wordt niet besmet door het eten van geïnfecteerd vlees.
Een recent Europees pilotonderzoek naar besmetting van slasoorten en zachtfruit met Echinococcus toonde E. multilocularis-DNA aan bij aardbeien en bosbessen uit Zuid-Limburg (MEmE: Multi-centre study). Dit betekent echter niet dat hiermee daadwerkelijk infectieuze eitjes zijn aangetoond. Tot voor kort werd het eten van ongewassen zachtfruit uit endemische gebieden als een theoretische risicofactor voor het oplopen van E. multilocularis-infectie gezien, deze pilot laat zien dat dit inderdaad een mogelijkheid is. Het RIVM (Rijksinstituut voor Volksgezondheid en Milieu) doet onderzoek om meer inzicht te krijgen wat de rol is van zachtfruit als mogelijke besmettingsroute.
Besmettelijke periode
Niet van toepassing. De mens is voor zijn omgeving niet besmettelijk (theoretisch via orgaantransplantatie mogelijk).
Besmettelijkheid
Zelfs in hoogendemische gebieden met hoge prevalenties bij vossen (>30%) worden relatief weinig infecties bij patiënten gezien. De meeste infecties zijn waarschijnlijk abortief, slechts 1 op 100 infecties leidt tot ziekte (Gottstein, 2015).
Risicogroepen
Immuungecompromitteerde patiënten hebben mogelijk een verhoogde incidentie van AE, vaak een meer progressief ziektebeeld en tevens kans op een vertraagde diagnose door atypische presentatie (Chauchet, 2014).
Verhoogde kans op infectie
Door de lange incubatietijd is het aanwijzen van risicofactoren erg lastig. In hoogendemische gebieden blijkt er een relatie te zijn met landbouwers en jagers. Daarnaast laat een meta-analyse uit 2017 naar de risicofactoren van AE ook zien dat onder andere het hebben van een kat of hond als huisdier, direct contact met vossen en het hebben van een moestuin een verhoogd risico geeft op de ziekte in hoog-endemische gebieden (Conraths, 2017).
Verhoogde kans op ernstig beloop
Immuungecompromiteerden hebben een hoger risico op meer progressief ziektebeeld bij diagnose (Chauchet, 2014).
Behandeling
De WHO (World Health Organization)-IWGE (WHO informal working groups on Echinococcosis) heeft een classificering voor AE ontwikkeld ter ondersteuning voor behandelaren voor de meest geschikte behandeling. Het stadium van AE is gebaseerd op 3 belangrijke factoren 1) locatie en uitbreiding van de primair parasitaire laesie in de lever, 2) betrokkenheid van naburige organen, 3) aan- of afwezigheid van metastase (PNM-classificering) (Kern, 2006). Indien technisch mogelijk, verdient radicale chirurgische verwijdering de voorkeur.
Medicamenteuze behandeling met albendazol (mebendazol als albendazol onvoldoende aanslaat) beperkt de morbiditeit en mortaliteit. Inoperabele patiënten die jarenlang met mebendazol of albendazol werden behandeld, hebben een goede overlevingskans (Husmann, 2022). Voor verdere informatie over de behandeling van AE kan ‘De therapierichtlijn Parasitaire infecties’ van de Nederlandse vereniging voor parasitologie worden geraadpleegd.
Diagnostiek
Zie ook het Diagnostisch Vademecum Infectieziekten tabel.
Microbiologische diagnostiek
Directe diagnostiek
De parasiet kan vaak niet worden aangetoond door middel van microscopisch onderzoek van materiaal uit de cyste doordat de haken en protoscolices veelal ontbreken. De cyste bestaat meestal uit tumorachtig weefsel met verkalkingen, necrose en holtevorming. Histopathologisch onderzoek laat parasitaire blaasjes zien, afgebakend door een Periodic-Acid-Schiff (PAS) positieve gelamineerde laag. Rondom de parasiet ligt een granuloom dat bestaat uit epitheelcellen met daarin parasitaire blaasjes, macrofagen, (myo)fibroblasten, reuscellen en allerlei cellen van de niet specifieke immuunrespons met daaromheen lymfocyten. Er is bovendien collageen aanwezig en andere extracellulaire eiwitdeposities (Brunetti 2010). Biopsiemateriaal uit de laesie kan worden gebruikt om met moleculaire technieken DNA van de parasiet aan te tonen en ook te bepalen om welke soort het gaat. Aspiratie van cystemateriaal pro diagnosi geeft substantieel risico voor de patiënt en wordt bij voorkeur pas gedaan na een korte (2-4 weken) albendazolkuur (zeker bij verdenking op een virale parasiet).
Indirecte diagnostiek
Er zijn verschillende serologische methoden beschikbaar, waaronder ELISA (enzym-linked immuno sorbent assay) en immunoblot, maar er is slechts een klein aantal beschikbaar op de Europese markt. Er zijn antigenen beschikbaar die specifiek zouden zijn, maar in de praktijk valt de specificiteit lager uit dan in de literatuur. De specificiteit van de serologie wordt bij alle methoden beperkt door kruisreacties met bijvoorbeeld E. granulosus (>20%), Taenia solium en sommige andere worminfecties. Bevestiging van een positief resultaat met een andere methode is noodzakelijk.
In Nederland wordt de serologie verricht door het RIVM. Indien de diagnostiek niet sluitend is, kan materiaal ter confirmatie naar een Europees referentiecentrum gestuurd worden.
Typering voor bron- en contactonderzoek
Verschillende markers worden gebruikt voor de genetische typering van E. multilocularis (Umhang 2021; Santoro, 2024). Umhang et al heeft de genetische diversiteit van Eurasiatische stammen vergeleken met een microsatelliet marker. Hieruit blijkt dat de Europese stammen voortkomen en zich verspreid hebben vanuit Azië. Santoro suggereert dat er drie verschillende genetische clusters bestaan in Europa, regionaal te verdelen in west, midden en oost. De typering is echter nog niet bruikbaar om individueel bron en contactonderzoek te doen.
Niet-microbiologische diagnostiek
Beeldvormende technieken: echo, röntgenfoto, CT-scan of MRI. Bij alveolaire echinokokkose worden in 70% van de gevallen hyper- en hypo-echogene gebieden gezien in een pseudotumor, met irregulaire randen en verspreid liggende calcificaties. Er lijkt sprake te zijn van een pseudocyste omgeven door grote gebieden van centrale necrose die zich presenteert als een onregelmatige hyperechogene ring. Bij een minderheid (30%) is sprake van minder typische kenmerken zoals 1) hemangioom-achtige hyperdense knobbeltjes als initiële afwijking en 2) kleine verkalkte laesies door een dode of zich nog ontwikkelende parasiet (Bresson-Hadni 2006).
Teneinde actieve laesies van de parasiet op te kunnen sporen is het soms aan te bevelen om naast genoemde beeldvormende technieken een F18-fluorodeoxyglucose-positron emission tomography (FDG-PET) te laten verrichten (Bresson-Hadni 2006).
Preventie
Immunisatie
Vaccinatie
Geen.
Passieve immunisatie
Geen.
Algemene preventieve maatregelen
Echinococcuseitjes kunnen maandenlang overleven in de omgeving, zelfs bij omgevingstemperaturen onder het vriespunt. In water van 4°C kunnen eitjes anderhalf jaar infectieus blijven. Droogte wordt minder goed verdragen. E. multilocularis-eitjes zijn niet meer besmettelijk na koken of verhitten tot ten minste 60 °C gedurende 60 minuten. Echinococcuseitjes zijn niet bestand tegen temperaturen van -80°C gedurende 48 uur (Eckert 2001, Veit 1995, Federer 2015).
Voor honden en katten die in endemische gebieden wonen of zijn geweest en de mogelijkheid hebben om knaagdieren te eten, is het advies om deze te ontwormen met een praziquantel-houdend ontwormmiddel gedurende twee dagen (zie paragraaf Verspreiding in de wereld bij dieren). Tot twee dagen na het ontwormen moet de ontlasting van de hond/kat worden opgeruimd tijdens het uitlaten of uit de tuin. De ontlasting mag niet bij het GFT of de composthoop worden gegooid, ter voorkoming van besmetting van de omgeving.
De volgende preventieve maatregelen/risico’s zijn alleen van toepassing op gebieden waar E. multilocularis endemisch (in Nederland betreft dit Zuid-Limburg en Noord-Oost Groningen) voorkomt:
- Draag bij voorkeur handschoenen als je met aarde in de natuur en de tuin werkt. Was daarna goed je handen.
- Spoel zelf geplukte bosvruchten en paddenstoelen, noten, valfruit en groenten altijd goed af. Kook enkele minuten, of verhit tot ten minste 60 °C gedurende 60 minuten,deze producten voordat je ze eet. Thuis invriezen helpt niet, de eitjes gaan pas dood bij -80°C.
- Draag handschoenen wanneer het aanraken van vossen (levend of dood) of vossenfeces onvermijdelijk is. Vervoer dode vossen in afgesloten plastic zakken.
- Ontworm honden en katten maandelijks met praziquantel of epsiprantel om de aanwezigheid van volwassen E. multilocularis (en daarmee de eiproductie) te voorkomen. Dit geldt zeker voor jachthonden of honden waarvan bekend is dat zij knaagdieren vangen.
- Was de handen goed na contact met honden of katten. De eitjes kunnen vastkleven aan de vacht.
Reiniging, desinfectie en sterilisatie
Conform de standaardmethoden beschreven in de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Echinococcuseitjes zijn resistent tegen desinfectiemiddelen met fenol, aldehyden en ethanol. Echinococcuseitjes kunnen worden gedood door blootstelling aan 3,75% natriumhypochloriet gedurende 10 minuten (CFSPH 2020, Krauss 2005, Gökçe 2023).
Maatregelen
Meldingsplicht
Echinokokkose is geen meldingsplichtige ziekte.
Inschakelen van andere instanties
De Nederlandse Voedsel en Waren Autoriteit (NVWA) bij o.a. verdenking op dierlijke hoogrisicobron.
Zie ook het Vademecum Zoönosen.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing door de GGD (Gemeentelijke gezondheidsdienst) kan zinvol zijn als er aanwijzingen zijn dat er meer mensen blootgesteld zijn aan eenzelfde (hoogrisico)bron. Inventariseer handelingen en praktijken die tot infectie kunnen leiden. Identificeer mogelijke import.
Contactonderzoek
Wonen in een endemisch gebied
Screenen van de algemene bevolking woonachtig in een endemisch gebied is niet nodig. De kans om besmet te raken met E. multilocularis is zeer laag (Gottstein 2015). Ook voor mensen die (beroepsmatig) veel in de natuur verblijven zoals boswachters, levert screening niet veel op. De kans om echinokokkose t.g.v. E. multilocularis te ontwikkelen is klein, een positieve serologische testuitslag betekent niet dat er werkelijk ziekteverschijnselen zullen ontstaan. Daarnaast is de kans op een foutpositieve serologische testuitslag aanwezig vanwege de laag positief voorspellende waarde, waarbij vervolgtesten en echografie nodig zijn (Hadni 1996). Dit zorgt voor hoge kosten en onnodige ongerustheid die niet opweegt tegen het lage risico op ziekte. In China lijkt het risico op AE bij blootgestelden consistent hoger te zijn dan in Europa, maar nog steeds relatief laag (Torgerson 2010). Serologische diagnostiek kan ingezet worden als mensen erg ongerust zijn. Het kan zijn dat dit niet wordt vergoed door de zorgverzekering.
Na contact met een hoogrisicobron
Diagnostiek kan een meerwaarde hebben voor personen die contact hebben gehad met een hoogrisicobron, bijvoorbeeld met een dier dat bewezen E. multilocularis uitscheidt, of blootstelling aan dezelfde bron als een patiënt met echinokokkose. Serologische diagnostiek kan worden gedaan bij het RIVM. Het doel van dit onderzoek is om vroegtijdig een besmetting met eitjes van de lintworm te herkennen en te behandelen. In de volgende situaties wordt aanvullende diagnostiek en follow-up daarom wel aanbevolen:
Na contact met een (huis)dier die bewezen E. multilocularis-eitjes heeft uitgescheiden
- Verwijzing naar de huisarts voor serologisch onderzoek op dag 0 en herhalen na 12 maanden
- Bij positieve serologie, verwijzing naar de tweede lijn voor aanvullende diagnostiek en follow-up
Na blootstelling aan een hoogrisicobron op een onbekend moment in het verleden
(bijvoorbeeld dezelfde aannemelijke bron als een patiënt met alveolaire echinokokkose, of een huisgenoot van een patiënt)
- Verwijzing naar de huisarts voor eenmalig serologisch onderzoek
- Bij positieve serologie, verwijzing naar de tweede lijn voor aanvullende diagnostiek en follow-up
NB. Het is belangrijk om betrokkenen van tevoren duidelijk te maken dat een positieve serologie niet altijd duidt op een actieve infectie. Nadere diagnostiek met beeldvormende technieken is vereist. Daarnaast sluit een negatieve serologie een infectie niet uit.
Voor onderbouwing van het contactonderzoek, zie bijlage Onderbouwing.
Maatregelen ten aanzien van index, contacten en bron
Behandeling, voorts: geen.
Postexpositieprofylaxe
Geen.
Wering
Echinokokkose is niet van mens op mens overdraagbaar. Wering is niet van toepassing.
Literatuur
- Ammann RW, Stumpe KD, Grimm F, Deplazes P, Huber S, Bertogg K, Fischer DR, Müllhaupt B. Outcome after Discontinuing Long-Term Benzimidazole Treatment in 11 Patients with Non-resectable Alveolar Echinococcosis with Negative FDG-PET/CT and Anti-EmII/3-10 Serology. PLoS Negl Trop Dis. 2015 Sep 21;9(9):e0003964
- Beerli O, Guerra D, Baltrunaite L, Deplazes P, Hegglin D. Microtus arvalis and Arvicola scherman: Key Players in the Echinococcus multilocularis Life Cycle. Front Vet Sci. 2017 Dec 13;4:216.
- Bresson-Hadni, S., Delabrousse, E., Blagosklonov, O., Bartholomot, B., Koch, S., Miguet, J.P., Mantion, G., Vuitton, D.A., 2006. Imaging aspects and non-surgical interventional treatment in human alveolar echinococcosis. Parasitol. Int. 55 (Suppl.), S267–S272.
- Brunetti et al. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Tropica 2010. 114. 1-16
- Carmena, G.a. Cardona, ‘Echinococcosis in wild carnivorous species; epidemiology, genotypic diversity, and implications for veterinary public health’veterinary parasitology 202 (2014) 69-94.
- CFSPH (The Center for Food Security and Public Health), 2020. Technical Factsheet Echinococcosis. https://www.cfsph.iastate.edu//
- Conraths FJ, Probst C, Possenti A, Boufana B, Saulle R, La Torre G, et al. (2017) Potential risk factors associated with human alveolar echinococcosis: Systematic review and meta-analysis. PLoS Negl Trop Dis 11(7): e0005801
- Chauchet A, Grenouillet F, Knapp J, Richou C, Delabrousse E, Dentan C, Millon L, Di Martino V, Contreras R, Deconinck E, Blagosklonov O, Vuitton DA, Bresson-Hadni S. 2014. Increased incidence and characteristics of alveolar echinococcosis in patients with immunosuppression_associated conditions. Clin Infect Dis 59:1095–110
- Davidson RK, Lavikainen A, Konyaev S, Schurer J, Miller AL, Oksanen A, Skirnisson K, Jenkins E. Echinoccus across the north: Current knowledge, future challenges. Food and Waterborne Parasitology 4 (2016) 39–53
- Deplazes P, Eckert J. Veterinary aspects of alveolar echinococcosis- a zoonosis of public health significance. Veterinary parasitology 98 (2001) 5-87.
- EFSA, Koutsoumanis, K., Allende, A., Alvarez-Ordóñez, A., Bolton, D., Bover-Cid, S., . . . Robertson, L. (2018). Panel on Biological Hazards. Public health risks associated with food-borne parasites. EFSA Journal, 16(12), e05495.
- Eckert, J., B. Gottstein, D. Heath, and F.-J. Liu. 2001. Prevention of echinococcosis in humans and safety precautions, p. 238–247. In J. Eckert, M. A. Gemmell, F.-X. Meslin, and Z. S. Pawlowski (ed.), WHO (World Health Organization)/OIE manual on echinococcosis in humans and animals: a public health problem of global concern. World Organisation for Animal Health, Paris, France.
- Gloor S, Bontadina F, Hegglin D, Deplazes P, Breitenmoser U. The rise of urban fox populations in Switzerland. Journal of Mammalian Biology. 2001;66:155–64 + D.
- Gökçe ON, Çetin K, Taş Ş, Alkan S, Dinç U. Hypochlorous Acid: A Novel Agent Against Echinococcus granulosus Protoscoleces. Infect Dis Clin Microbiol. 2023 Jun 23;5(2):158-164. doi: 10.36519/idcm.2023.238. PMID: 38633006; PMCID: PMC10985818.
- Gottstein B, Wang J, Boubaker G, Marinova I, Spiliotis M, Müller N, Hemphill A, Susceptibility versus resistance in alveolar echinococcosis (larval infection with Echinococcus multilocularis). Veterinary Parasitology. 2015. 213 (3–4): p103-109,
- Gottstein B., Saucy F., Deplazes P., Reichen J., Demierre G., Busato A., Zuercher C., Pugin P. Is high prevalence of Echinococcus mulitlocularis in wild and domestic animals associated with disease incidence in humans?. Emerging infectious diseases, 8(3):p 408-412.
- Gottstein B, Deplazes P. Alveolar echinococcosis: what triggers emergence in North America, Central Europe and Asia ? 2021 Current Opinion in Infectious Diseases 34(5):p 440-446,.
- Houston S, Belga S, Buttenschoen K, Cooper R, Girgis S, Gottstein B, Low G, Massolo A, MacDonald C, Müller N, Preiksaitis J, Sarlieve P, Vaughan S, Kowalewska-Grochowska K. Epidemiological and Clinical Characteristics of Alveolar Echinococcosis: An Emerging Infectious Disease in Alberta, Canada. Am J Trop Med Hyg. 2021 Mar 22;104(5):1863-1869
- Bresson-Hadni S, Laplante JJ, Lenys D, Rohmer P, Gottstein B, Jacquier P, Mercet P, Meyer JP, Miguet JP, Vuitton DA. Seroepidemiologic screening of Echinococcus multilocularis infection in a European area endemic for alveolar echinococcosis. Am J Trop Med Hyg. 1994 Dec;51(6):837-46
- Karin F, Armua-Fernandez AT, Hoby S, Wenker C, Deplazes P. In vivoviability of echinococcus multicolaris eggs in a rodent model after different thermos-treatmnets. Experimental Parasitology. 2015; 154; 14-19,
- Preiser W. Hartmut Krauss, Albert Weber, Max Appel, Burkhard Enders, Henry D. Isenberg, Hans Gerd Schiefer, Werner Slenczka, Alexander von Graevenitz, and Horst Zahner. Zoonoses: infectious diseases transmissible from animals to humans, 3rd edition. Med Microbiol Immunol. 2005;194(4):219–20. doi: 10.1007/s00430-004-0232-3. Epub 2004 Nov 24. PMCID: PMC7086707.
- Husmann L, Gruenig H, Reiner CS, Deibel A, Ledergerber B, Liberini V, Skawran S, Muehlematter UJ, Messerli M, Hasse B, Muellhaupt B, Huellner MW. Prediction of benzimidazole therapy duration with PET/CT in inoperable patients with alveolar echinococcosis. Sci Rep. 2022 Jul 6;12(1):11392
- Kern P. Clinical features and treatment of alveolar echinococcosis. Current Opinion in Infectious Diseases 2010,23:505–512;
- Kern, P., Grüner, B., Wahlers, K. Diagnosis and course of echinococcocal diseases in the transplant setting. Transplant infectious disease. 2011 Jun; 13 (3); 217-221
- Kern, P., Bardonnet, K., Renner, E., Auer, H., Pawlowski, Z., Ammann, R.W., Vuitton,D.A., 2003. European echinococcosis registry: human alveolar echinococcosis,Europe, 1982–2000. Emerg. Infect. Dis. 9, 343–349.).
- Maas M, Dam-Deisz WD, van Roon AgM, Takumi K, van der Giessen JW. Significant increase of Echinococcus multilocularis prevalence in foxes, but no increased predicted risk for humans. Vet Parasitol. 2014 Oct 12;206(3-4):167-172
- Maas M, van den End S, van Roon A, Mulder J, Franssen F, Dam-Deisz C, Montizaan M, van der Giessen J. First findings of Trichinella spiralis and DNA of Echinococcus multilocularis in wild raccoon dogs in the Netherlands. Int J Parasitol Parasites Wildl. 2016 Sep 21;5(3):277-279.
- Maas M, van Roon A, Dam-Deisz C, van der Giessen J. Wildziekten in beeld ‘Geringe verspreiding van vossenlintworm in Groningen’. De Jager 2017, nr 2. 52-53.
- Oksanen, A., Siles-Lucas, M., Karamon, J. et al. The geographical distribution and prevalence of Echinococcus multilocularis in animals in the European Union and adjacent countries: a systematic review and meta-analysis. Parasites Vectors 9, 519 (2016).
- Raasveld MHM, Ponsioen CY, Den Boer S, Schipper HG, Kager PA. Een patiënt met alveolaire echinokokkose (infectie met Echinococcus multilocularis). NTVG 1997;141 nr 20:p1007-10.
- Santoro A, Santolamazza F, Cacciò SM, La Rosa G, Antolová D, Auer H, Bagrade G, Bandelj P, Basso W, Beck R, Citterio CV, Davidson RK, Deksne G, Frey CF, Fuglei E, Glawischnig W, Gottstein B, Harna J, Huus Petersen H, Karamon J, Jansen F, Jarošová J, Jokelainen P, Lundström-Stadelmann B, Maksimov P, Miljević M, Miterpáková M, Moks E, Origgi F, Ozolina Z, Ryser MP, Romig T, Šarkūnas M, Scorrano N, Saarma U, Šnábel V, Sréter T, Umhang G, Vengušt G, Žele Vengušt D, Casulli A. Mitochondrial genetic diversity and phylogenetic relationships of Echinococcus multilocularis in Europe. Int J Parasitol. 2024 Apr;54(5):233-245.
- Schweiger, A., Ammann, R.W., Candinas, D., Clavien, P.A., Eckert, J., Gottstein, B., Halkic, N., Muellhaupt, B., Prinz, B.M., Reichen, J., Tarr, P.E., Torgerson, P.R., Deplazes, P., 2007. Human alveolar echinococcosis after fox population increase, Switzerland. Emerg. Infect. Dis. 13, 878–882.
- Takumi K, de Vries A, Chu ML, Mulder J, Teunis P, van der Giessen J. Evidence for an increasing presence of Echinococcus multilocularis in foxes in The Netherlands. Int J Parasitol. 2008 Apr;38(5):571-8.
- Takumi K, Hegglin D, Deplazes P, Gottstein B, Teunis P, VAN DER Giessen J. Mapping the increasing risk of human alveolar echinococcosis in Limburg, The Netherlands. Epidemiol Infect. 2011 Jul 7:1-5.
- Takumi K, de Vries A, Chu ML, Mulder J, Teunis P, van der Giessen J. Evidence for an increasing presence of Echinococcus multilocularis in foxes in The Netherlands. Int J Parasitol. 2008 Apr;38(5):571-8.
- Torgerson PR, Keller K, Magnotta M, Ragland N (2010) The Global Burden of Alveolar Echinococcosis. PLoS Negl Trop Dis 4(6): e722.)
- Umhang G, Bastid V, Avcioglu H, Bagrade G, Bujanić M, Bjelić Čabrilo O, Casulli A, Dorny P, van der Giessen J, Guven E, Harna J, Karamon J, Kharchenko V, Knapp J, Kolarova L, Konyaev S, Laurimaa L, Losch S, Miljević M, Miterpakova M, Moks E, Romig T, Saarma U, Snabel V, Sreter T, Valdmann H, Boué F. Unravelling the genetic diversity and relatedness of Echinococcus multilocularis isolates in Eurasia using the EmsB microsatellite nuclear marker. Infect Genet Evol. 2021 Aug;92:104863
- Van Dommelen L, Stoot JH, Cappendijk VC, Abdul Hamid MA, Stelma FF, Kortbeek LM, van der Giessen J, Oude Lashof AM. The first locally-acquired human infection of Echinococcus multilocularis in the Netherlands. J Clin Microbiol. 2012 Feb 22.
- Van der Giessen JW, Rombout Y, Teunis P. Base line prevalence and spatial distribution of Echinococcus multilocularis in a newly recognized endemic area in the Netherlands. Vet Parasitol. 2004 Jan 5;119(1):27-35
- Van der Giessen JW, Rombout YB, Franchimont JH, Limper LP, Homan WL. Detection of Echinococcus multilocularis in foxes in The Netherlands. Vet Parasitol. 1999 Mar 22;82(1):49-57. doi: 10.1016/s0304-4017(98)00263-5. PMID: 10223349.
- Veit P, Bilger B, Schad V, Schäfer J, Frank W, Lucius R. Influence of environmental factors on the infectivity of Echinococcus multilocularis eggs. Parasitology. 1995 Jan;110 ( Pt 1):79-86
- Wen et al. Echinococcus: Advances in the 21st Century. Clin Microbiol Rev. 2019 feb 13;32(2):e0075-18.
- Wilson JF, Rausch RL, McMahon BJ, Schantz PM. Parasiticidal effect of chemotherapy in alveolar hydatid disease: review of experience with mebendazole and albendazole in Alaskan Eskimos. Clin Infect Dis 1992;15:p234-49.