Cysteuze echinokokkose Richtlijn
Samenvatting
Verwekker: Parasiet: Echinococcus granulosus (lintworm hond)
Besmettingsweg: Oraal: E. granulosus-eitjes, bijvoorbeeld via door hondenfeces gecontamineerde grond, rauw voedsel of water.
Incubatieperiode: Maanden tot jaren
Besmettelijke periode: Geen directe overdracht van mens op mens
Maatregelen: In specifieke situaties kan bij contacten serologisch onderzoek worden ingezet
Symptomen: Vaak asymptomatisch. Symptomen en beloop afhankelijk van de grootte, groeisnelheid en lokalisatie van de cyste (lever, nier, CZS) en het aantal cysten.
Doel en doelgroep
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. De richtlijn beschrijft duidelijke adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. De zorgprofessional kan de richtlijn ook gebruiken voor het bijhouden en vergaren van kennis. De uitvoering van de richtlijn overstijgt institutionele en professionele domeingrenzen en is bedoeld voor het gebruik binnen diverse sectoren van de gezondheidszorg. Voor meer informatie zie Totstandkoming LCI-richtlijnen.
Versiebeheer
Vastgesteld LOI: 17 december 2024.
Diagnostiek: de opgenomen conceptversie wordt naar verwachting vastgesteld door subcommissie diagnostiek in samenwerking met NVMM: 22 januari 2025
Wijzigingen sinds vaststelling:
- 14 januari 2025: Herziene richtlijn gepubliceerd (op 17 december 2024 vastgesteld door het LOI). De richtlijn is herzien door drs. Florien Dusseldorp, LCI, RIVM met uitzondering van het hoofdstuk Diagnostiek en de veterinaire paragrafen. Veterinaire paragrafen herzien door Joke van der Giessen en Titia Kortbeek (LCI, RIVM).
Nieuw en anders in deze richtlijn ten opzichte van de oude richtlijn: De oude richtlijn Echinokokkose is opgesplitst in twee richtlijnen: Cysteuze echinokokkose en Alveolaire echinokokkose. Alle hoofdstukken zijn geüpdatet. Er zijn geen significante wijzigingen doorgevoerd in de (preventieve) maatregelen.
Ziekte & Besmettelijkheid
Verwekker
Echinococcus granulosus is een kleine lintworm van de hond. De volwassen lintworm is 3-11 mm lang en leeft in de dunne darm van honden en hondachtigen. De worm bestaat uit een kop met vier zuignappen en een dubbele hakenkrans, een korte nek en een paar proglottiden waarvan er slechts één een uterus vol met E. granulosus-eitjes bevat. De eitjes komen via de ontlasting van de hond in het milieu terecht. Morfologisch zijn de eitjes niet te onderscheiden van Taenia-eitjes of van eitjes van E. multilocularis.
Voor het volbrengen van de levenscyclus is behalve de eindgastheer (hond) ook een tussengastheer (zoals runderen, varkens en schapen) noodzakelijk. In de tussengastheer bevindt Echinococcus zich in het larvale stadium, dit presenteert zich als een blaasworm (hydatide). Als honden vlees eten dat met cysten is geïnfecteerd, ontwikkelt zich in de dunne darm van de hond uit deze cysten weer een lintworm en is de cyclus rond.
De taxonomie van E. granulosus is sinds een aantal jaren sterk veranderd door moleculaire identificatie. Er wordt onderscheid gemaakt tussen verschillende E. granulosus-genotypen en sommige E. granulosus-subtypen hebben nu een andere speciesnaam gekregen. In Europa spelen Echinococcus granulosus sensu stricto (vooral via schapen), Echinococcus ortleppi (via runderen), Echinococcus equinus (via paarden) en Echinococcus canadensis (via het varken) een rol. Hondachtigen zijn altijd de eindgastheer van E. granulosus spp.
Naast E. granulosus en E. multilocularis worden er wereldwijd sporadisch casussen van E. vogeli en E. oligarthrus gediagnosticeerd. In Nederland zijn er twee importcasussen van E. vogeli uit Suriname in Nederland gerapporteerd (Stijnis 2013, Stijnis 2015).
Zie figuur 1 voor de levenscyclus van E. granulosus.
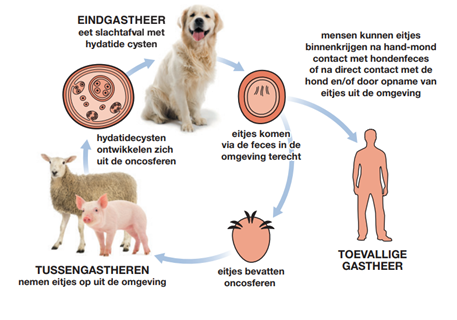
Pathogenese
Als E. granulosus-eitjes door mensen of andere tussengastheren zoals schapen, runderen, kamelen of paarden worden opgegeten, worden de oncosferen (larven) geactiveerd en migreren door de darmwand. Uiteindelijk komen de oncosferen via de mesenteriale vaten in de lever terecht, waar ze veelal vastlopen. Bij de mens wordt het merendeel van de cysten in de lever gevonden (>65%), gevolgd door de longen (~20%) (Pawlowski, 2001). Ook in de buikholte en in andere organen zoals hersenen, hart, milt, nieren, mammae, pancreas, skelet en organen in het hoofd-halsgebied worden cysten gevonden.
De larven ontwikkelen zich tot ‘blaasworm’ (hydatide, echinococcuscyste, een met vocht gevulde ruimte met een laag kiemepitheel). Na ongeveer drie weken heeft deze cyste, waarin de larve zich ontwikkelt, een diameter van 250 micrometer en heeft de gastheer een fibrinelaag om de cyste gevormd. Vanuit het kiemepitheel ontstaan meerdere broedblaasjes, op basis van de morfologie bij beeldvorming ook wel dochtercysten genoemd, waarin talloze in aanleg zijnde scolices (genaamd protoscolices) aanwezig zijn. Bij sommige cysten ontwikkelen zich geen protoscolices. Deze blijven steriel en zijn niet infectieus.
Alleen bij eindgastheren zoals de hond kunnen de protoscolices zich ontwikkelen tot nieuwe lintwormen met een naar buiten gestulpte kop die zich vast kan hechten in de darmwand, als zij bv. geïnfecteerd slachtafval opeten.
De schade van een hydatidecyste is vooral mechanisch van aard. Het kan door de langzame groei van een cyste lang duren voordat er klachten optreden en een deel van de cysten zal nooit klachten geven. De cysten kunnen door hun omvang of ligging druk uitoefenen op bijvoorbeeld galgangen of leverkapsel waardoor klachten ontstaan. Een ruptuur van de cyste kan een ernstige allergische of anafylactische reactie geven. Door secundaire infectie kan abcesvorming optreden. Soms is er sprake van arteriële embolie en systemische verspreiding van de echinococcuscysten naar vitale organen.
Incubatieperiode
De incubatieperiode varieert van maanden tot jaren en hangt af van het aantal en de lokalisatie van de cysten en tevens van hun groeisnelheid. Het verloop tussen infectie en begin van de symptomen is vaak meer dan 10 jaar.
De meeste infecties worden gediagnosticeerd bij patiënten tussen de 10 en 50 jaar oud. Bij jonge kinderen kunnen ook al symptomatische cysten aanwezig zijn.
Ziekteverschijnselen
Cysteuze echinokokkose (CE) is een parasitaire ziekte veroorzaakt door het larvale stadium van E. granulosus. CE veroorzaakt potentieel schadelijke, langzaam groeiende cysten in verschillende organen zoals lever en longen. De meeste cysten geven echter waarschijnlijk geen klachten en zullen niet worden ontdekt. Een deel zal spontaan in regressie gaan en verkalken. Sommige cysten worden bij toeval ontdekt bij een echo-onderzoek bijvoorbeeld bij zwangerschap of cardiale echografie.
De eventuele symptomen hangen af van de grootte en lokalisatie van de cyste(n). De geringe groeisnelheid (circa 1 cm in diameter per jaar) verklaart waarom klachten vaak pas na vele jaren ontstaan. Levercysten kunnen heel groot worden (>20 cm) en een grote hoeveelheid dochtercysten bevatten. Symptomatische CE-patiënten met levercysten presenteren zich vaak met abdominale pijn en een slechte eetlust (Wen, 2019). Misselijkheid en braken komen voor, evenals icterus en portale hypertensie. Ossale lokalisaties zijn moeilijk te behandelen en kunnen leiden tot uitgebreide destructie met secundaire bacteriële infecties. Lokalisaties in het bot kunnen dan ook gepaard gaan met botbreuken. De differentiële diagnostiek met tuberculose kan moeilijk zijn in geval van botechinokokkose. Een cyste in het centraal zenuwstelsel kan gepaard gaan met verhoogde intracraniële druk, focale epilepsie en uitvalverschijnselen. Niercysten kunnen pijnklachten en hematurie geven. Eosinofilie treedt op bij 20-25% van de patiënten.
Ernstige complicaties van lever- en longechinokokkose (minder dan 10% van de patiënten) treden in het algemeen pas op wanneer de cyste barst. Door lekkage of barsten van hydatidecysten in de longen ontstaat pijn op de borst, hoesten, dyspnoe en hemoptoë. Als een cyste in de galgangen barst, leidt dit tot koorts en icterus ten gevolge van cholangitis. De cyste kan dan secundair geïnfecteerd raken. Na een voorafgaande sensibilisatie door langzame lekkage, kan een plotseling vrijkomende grote hoeveelheid hydatidevocht acuut tot een ernstige allergische reactie leiden (anafylactische shock). Vrijkomende protoscolices kunnen zich ook ontwikkelen tot nieuwe hydatiden, zodat er sprake is van ‘uitzaaiing’ van de parasiet binnen de gastheer.
De mortaliteit van CE varieert tussen 2 en 4%, maar kan stijgen als er geen adequate zorg wordt geboden aan symptomatische patiënten (Wen, 2019). De levensverwachting van succesvol behandelde patiënten lijkt normaal te zijn en patiënten met een extrahepatische lokalisatie van de cyste lijken dezelfde prognose te hebben.
Natuurlijke immuniteit
Het is onvoldoende bekend of mensen opnieuw geïnfecteerd kunnen worden. Er zou beschermende immuniteit kunnen bestaan, dit zou kunnen verklaren waarom cysten zich niet bij alle mensen in endemische gebieden volledig ontwikkelen. Het mechanisme van deze immuunrespons blijkt van antistof- en complementfunctie afhankelijk te zijn en verbetert in aanwezigheid van neutrofielen (Tamarozzi, 2015).
Reservoir
De mens is geen reservoir. Zie Dierlijke reservoirs in de bijlage Veterinaire informatie.
Besmettingsweg
De mens wordt besmet door het eten van E. granulosus-eitjes, bijvoorbeeld via met (honden)feces gecontamineerde grond, voedsel of water. De mens wordt niet besmet door het eten van besmet vlees. De mens is voor het in stand houden van de cyclus niet van belang.
Besmettelijke periode
Er is geen overdracht van mens op mens.
Besmettelijkheid
Er is geen directe overdracht van persoon op persoon. E. granulosus is hoogresistent tegen lage temperaturen. De temperatuur van huishoudvriezers van -18 ºC of -20 ºC is onvoldoende om E. granulosus-eitjes binnen acceptabele tijd te inactiveren (Eckert, 2004). De eitjes worden geïnactiveerd na 5 minuten verhitting op 60 ºC tot 80 ºC of koken na enkele minuten.
Echinococcuseitjes kunnen langdurig overleven in vochtige omstandigheden, maar worden snel geïnactiveerd door UV-straling (zonlicht).
Diagnostiek
Met medewerking van de NVMM. Tekst betreft laatste conceptversie die naar verwachting januari 2025 wordt vastgesteld.
Zie ook het Diagnostisch Vademecum Infectieziekten tabel | RIVM.
Bij het vermoeden van een infectie met Echinococcus spp. zijn de volgende klinisch diagnostische middelen van belang:
- Anamnese en klinische bevindingen;
- Beeldvormende technieken: echo, röntgenfoto, CT-scan of MRI;
- Serodiagnostiek;
- Screening bloedbeeld waarbij eosinofilie kan opvallen: meestal niet erg hoog (15%), vaak ook afwezig.
Een combinatie van verschillende diagnostische methoden verbetert de positief voorspellende waarde.
Microbiologische diagnostiek
Directe diagnostiek
De parasiet kan worden aangetoond door middel van microscopisch onderzoek van materiaal uit de cyste. Hierbij wordt gekeken naar protoscolices (het larvale stadium van de parasiet) of hun haken. Het cystevocht kan verkregen worden door fijne-naald-biopsie, chirurgie of uit BAL/sputum na ruptuur van een longcyste. Bij aspiratie van cystemateriaal moet rekening worden gehouden met het gevaar van lekkage van de inhoud, met metastasering of een anafylactische shock. De inhoud van de cyste of de wand van de cyste kan worden gebruikt om met moleculaire technieken DNA van de parasiet aan te tonen en ook te bepalen welke soort het betreft (Echinococcus G1-G10, E. multilocularis, etc.). Hoewel de sensitiviteit van microscopie en PCR op BAL/sputum na ruptuur van een longcyste zeer laag is, is de sensitiviteit van deze technieken op inhoud of wand van de cyste is hoog (Knapp 2023).
Het is mogelijk om de vitaliteit van de protoscolices vast te stellen door middel van kleuring met trypaanblauw, eosine of methyleenblauw. De detectie van parasitaire antigenen is daarentegen geen indicatie voor de vitaliteit van de cyste. Hoewel verkalkingen van de cyste, wat met behulp van beeldvormende technieken kan worden vastgesteld, vaker voorkomen in het CE4- en CE5-stadium, is dit niet altijd een betrouwbare indicator voor de vitaliteit.
Indirecte diagnostiek
Er zijn verschillende serologische methoden zoals indirecte hemagglutinatie (IHA), ELISA of latexagglutinatie met verschillende sensitiviteit welke onder meer afhankelijk is van het gebruikte antigeen in de test. De antistofproductie hangt samen met het stadium van de cyste(n) en de locatie in de gastheer. Cysten in een vroeg stadium kunnen nog afgeschermd zijn van het immuunsyseem en in een later stadium kan door afkapseling van de cyste de antistofproductie onder het detectieniveau van de test komen te liggen. Dit is vaker bij longcysten dan bij levercysten het geval. Een negatieve serologie sluit een infectie dan ook niet uit.
De sensitiviteit van de serologische testen varieert van 50-60% bij longcysten tot 85-95% bij levercysten. De specificiteit van de serologie wordt bij alle methoden beperkt door kruisreacties met bijvoorbeeld Echinococcus multilocularis (>20 %), Taenia solium en sommige andere worminfecties. Ook zijn aspecifieke reacties bekend bij levercirrose en maligniteiten (Brunetti, 2010).
Bevestiging van een positief resultaat in een van deze methoden kan bijvoorbeeld worden gedaan door middel van een immunoblot waarbij gekeken wordt naar een specifiek reactiepatroon. In Nederland wordt in een aantal centra serologie van echinokokkose uitgevoerd. Zie Vademecum Zoönosen.
Typering voor bron- en contactonderzoek
Door middel van moleculaire typering is het mogelijk onderscheid te maken tussen de verschillende E. granulosus-stammen, hetgeen inzicht geeft in welke diersoort als tussengastheer een rol speelt en in welk geografisch gebied de infectie mogelijk werd opgelopen (zie Dierlijke reservoirs in de bijlage Veterinaire informatie).
Niet-microbiologische diagnostiek
Kenmerken van E. granulosus-cysten bij echografie en CT-scan, MRI of röntgenfoto zijn een ronde of ovale hypodense afwijking en een dubbele membraan met boogvormige verkalkingen in de wand van de cyste. Bij een deel van de patiënten bevat de cyste septa of dochtercysten. Bij anderen is sprake van een ‘gespleten’ cystewand: de endocystewand ligt los van de pericystewand. Deze laatste twee vormen worden als karakteristiek voor E. granulosus beschouwd. Op basis van de echografische bevindingen heeft de WHO een indeling gemaakt (Brunetti et al, 2010) (zie paragraaf Behandeling).
NB: Voor het stellen van een diagnose is de combinatie van anamnese (verblijf of komende uit een endemisch gebied; intensief contact met honden uit buitenland), beeldvorming en serologie van belang.
Risicogroepen
Verhoogde kans op infectie
Vanwege de lange incubatietijd bij mensen is het niet mogelijk om exact aan te geven welke groepen extra risico lopen. Studies in verschillende landen geven diverse risicofactoren aan. Een systematic review uit 2016 toont dat met name het leven in rurale gebied met honden die vrij kunnen rondlopen een risicofactor voor besmetting is (Possenti, 2016). Het risico op infectie is echter ook in deze situaties afhankelijk van persoonlijke hygiëne en schoonhouden van de omgeving. Kinderen lopen een groter risico besmet te raken dan volwassenen omdat ze meer direct contact hebben met honden en minder hygiënisch zijn.
Verhoogde kans op ernstig beloop
Er zijn geen aanwijzingen dat een verminderde werking van het immuunsysteem tot ernstiger infecties of recidieven leidt zoals bij sommige andere parasitaire infecties.
Epidemiologie
Verspreiding in de wereld
E. granulosus komt wereldwijd streekgebonden voor daar waar honden gebruikt worden om het vee te hoeden en in nauw contact staan met mensen: Azië, het zuiden van Zuid-Amerika, West-Canada en Alaska, het zuiden van Australië en in delen van Afrika. In Europa komt echinokokkose in bijna alle landen voor, maar in landen zoals Noorwegen, Zweden, Denemarken, Nederland, Luxemburg en Malta wordt E. granulosus vooral als importziekte gezien. Over het algemeen is er een afname in E. granulosus-incidentie in Europa, met name in Europese landen waar de ziekte een traditioneel hoge incidentie heeft, zoals Bosnië en Herzegovina, Bulgarije, Frankrijk, Griekenland, Italië en Spanje. De incidentie neemt in sommige landen in Oost- en Zuidoost Europa wel toe, zoals in Wit-Rusland, Montenegro, Noord-Macedonië, Servië, Slovenië en Litouwen, en ook in de meeste niet-endemische landen zoals Finland, Duitsland, Noorwegen, Zweden en Zwitserland.
Voorkomen in Nederland
Voor 1945 kwam E. granulosus in Nederland endemisch voor, met name in Friesland. De intensieve veehouderij en slachthuiscontrole zullen bijgedragen hebben aan het verdwijnen van deze ziekte. Tegenwoordig wordt het vooral gezien als importziekte, meestal bij patiënten uit het Middellandse Zeegebied. Vanwege het ontbreken van een meldingsplicht zijn er geen exacte gegevens over hoeveel patiënten er in Nederland worden gediagnosticeerd, wel vraagt het RIVM cijfers van academische centra op. Bij een deel van de patiënten is het een toevalsbevinding bij een operatie; bij een deel vindt er serodiagnostiek plaats. Volgens een Europese studie van Casulli waarbij gegevens over de incidentie en trends van cystische echinokokkose in Europa werden geëxtraheerd uit zowel wetenschappelijke als grijze literatuur uit tussen 1997-2021, zijn er in Nederland tussen 2017 en 2019 jaarlijks 41-48 nieuwe patiënten gediagnosticeerd. In totaal gaat het tussen 1997 en 2020 om 915 patiënten (Casulli 2023).
Preventie
Immunisatie
Geen.
Algemene preventieve maatregelen
- Vleeskeuring en strenge naleving van de wettelijke bepalingen op destructie van besmette organen. Organen met macroscopisch waarneembare cysten worden afgekeurd, kleine blaasjes worden echter vaak niet opgemerkt. Het spiervlees ondergaat een koudebehandeling, dit is veilig voor menselijke consumptie.
- Verhit voedingsmiddelen die mogelijk zijn besmet met echinococcuseitjes minstens 5 minuten op 60 ºC tot 80 ºC of enkele minuten op 100 ºC. De eitjes zijn erg resistent tegen kou. De temperatuur van huishoudvriezers is onvoldoende om de eitjes binnen acceptabele tijd te inactiveren. Wel worden ze onschadelijk gedurende 48 uur bij -80 ºC of 96 uur bij -70 ºC (Eckert, 2001).
- Steriliseer orgaanvlees voor honden en katten of bevries gedurende 48 uur bij -80 ºC of 96 uur bij -70 ºC (Eckert, 2001).
- Behandel honden die besmet (kunnen) zijn met praziquantel, in overleg met de dierenarts.
- Bij het meenemen van de eigen hond naar een endemisch gebied de hond alleen diervoeding aanbieden die geen rauw vlees bevat.
Reiniging, desinfectie en sterilisatie
Conform de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Desinfectiemiddelen hebben geen volledig dodend effect op E. granulosus-eitjes.
Maatregelen
Meldingsplicht
Echinokokkose is geen meldingsplichtige ziekte.
Inschakelen van andere instanties
Nederlandse Voedsel- en Warenautoriteit (NVWA).
Bronopsporing
Bronopsporing door de GGD kan zinvol zijn als er aanwijzingen zijn dat er meer mensen blootgesteld zijn aan eenzelfde (hoogrisico)bron. Inventariseer handelingen en praktijken die tot infectie kunnen leiden. Identificeer mogelijke import.
Maatregelen ten aanzien van patiënt en contacten
Er is geen profylaxe beschikbaar voor blootgestelden.
Bij personen die contact hebben met bewezen besmette honden of op een andere manier als risicogroep aangemerkt kunnen worden, kan er bij verdenking op een mogelijke besmetting door de huisarts, na laagdrempelig overleg met een internist-infectioloog of arts-microbioloog, diagnostiek worden ingezet. Middels serologie wordt gekeken naar antistoffen tegen echinokokken. Het duurt enige tijd voordat antistoffen aantoonbaar worden, tenminste 2 weken, maar dit kan tot 12 weken duren. Het doel van dit onderzoek is om vroegtijdig een besmetting met E. granulosus te diagnosticeren om adequaat vervolgbeleid te maken. De serologische respons is afhankelijk van cyste-activiteit, het aantal en de grootte van de cyste. Een negatieve serologie sluit een infectie niet uit (zie Microbiologische diagnostiek).
Patiënten met CE dienen te worden vervolgd en/of behandeld door de tweede lijn.
Wering van werk, school, kinderdagverblijf of consultatiebureau
Echinokokkose is niet van mens op mens overdraagbaar. Wering is niet van toepassing.
Profylaxe & Behandeling
Profylaxe
Geen.
Behandeling
Behandeling van CE is complex. In behandelcentra wordt behandeld op basis van de WHO-IWGE (WHO informal working groups on Echinococcosis) -criteria (voor echografische weergave van de stadia, zie artikel van Wuestenberg 2014). Het doel van radicale chirurgie is de volledige verwijdering van de cysten, hetgeen niet altijd mogelijk is en gecompliceerd kan verlopen door infectie en gal-lekkage. Percutane behandeling (PAIR en PEVAC) in combinatie met medicamenteuze therapie op basis van benzimidazolen (albendazol en mebendazol zijn als enige middelen effectief tegen larvale groei van Echinococcus spp) is minder invasief en leidt tot een vergelijkbare recidiefkans en minder ziekenhuisopname en complicaties vergeleken met chirurgie (Mönnink, 2021). De stadiering van de cyste, op basis van echografische classificatie, lokalisatie en aanwezigheid van mogelijke complicerende factoren, vormt de basis voor de keuze van het type behandeling (Wen, 2019). Voor verdere informatie over de behandeling van CE kan de Therapierichtlijn Parasitaire Infecties van de Nederlandse Vereniging voor Parasitologie (NVP) worden geraadpleegd.
Literatuur
- Bowles J, van Knapen F, McManus D. Cattle strain of Echinococcus granulosus and human infection. Lancet. 1992 May 30;339(8805):1358.
- Brunetti et al. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Tropica 2010. 114. 1-16
- Casulli et al. Unveiling the incidence and trends of neglected zoonosis cystic echinococcosis in Europe: a systematic review from the MEmE project. 2023 Lancet infectious disease 23;3;e95-e107).
- Casulli A, Massolo A, Saarma U, Umhang G, Santolamazza F, Santoro A. Species and genotypes belonging to Echinococcus granulosus sensu lato complex causing human cystic echinococcosis in Europe (2000-2021): a systematic review. Parasit Vectors. 2022 Mar 28;15(1):109.
- Eckert J. Deplazes P. Biological, Epidemiological, and Clinical aspects of Echinococcosis, a Zoonosis of Increasing Concern. Clnical Microbiol Rev 2004 Jan; 17(1): 107-135
- Eckert, J., B. Gottstein, D. Heath, and F.-J. Liu. 2001. Prevention of echinococcosis in humans and safety precautions, p. 238–247. In J. Eckert, M. A. Gemmell, F.-X. Meslin, and Z. S. Pawlowski (ed.), WHO/OIE manual on echinococcosis in humans and animals: a public health problem of global concern. World Organisation for Animal Health, Paris, France.
- Knapp J, Lallemand S, Monnien F, Felix S, Courquet S, Umhang G, Millon L. Real-time multiplex PCR for human echinococcosis and differential diagnosis. Parasite. 2023;30:3. doi: 10.1051/parasite/2023003. Epub 2023 Jan 25. PMID: 36700708; PMCID: PMC9886084.
- Mönnink GLE, Stijnis C, van Delden OM, Spijker R, Grobusch MP. Percutaneous versus surgical interventions for hepatic cystic echinococcosis: A systematic review and meta-analysis. Cardiovasc Intervent Radiol. 2021 Nov; 44(11):1689-1696
- Pawlowski ZS, Eckert DA, Vuitton DA, Ammann RW, Kern P, Craig PS, et al. Echinococcosis in humans: clinical aspects, diagnosis and treatment. In: Eckert J, Gemmell MA, Meslin F-X, Pawlowski ZS, eds. WHO/OIE manual on echinococcosis in humans and animals: a public health problem of global concern. World Organisation for Animal Health, 2001:20-72
- Possenti A, Manzano-Román R, Sánchez-Ovejero C, Boufana B, La Torre G, Siles-Lucas M, Casulli A. Potential Risk Factors Associated with Human Cystic Echinococcosis: Systematic Review and Meta-analysis. PLoS Negl Trop Dis. 2016 Nov 7;10(11):e0005114.
- Raasveld MHM, Ponsioen CY, Den Boer S, Schipper HG, Kager PA. Een patiënt met alveolaire echinokokkose (infectie met Echinococcus multilocularis). NTVG 1997;141 nr 20:p1007-10.
- Sojkovic, Marija. Weber, Tim. Junghanss, Thomas. Clinical management of cystic echinococcosis: state of the art and perspectives. Current Opinion in Infectious Diseases 31(5):p 383-392, October 2018. | DOI: 10.1097/QCO.0000000000000485
- Spierenburg M, Valkenburgh S, Franssen FFJ, Van der Giesen JWB. Risico op herintroductie van Echinococcus granulosus in Nederland door import van runderen en honden uit endemische gebieden. 2017. Tijdschrift voor diergeneeskunde. 142. p30-35.
- Stijnis K, Dijkmans AC, Bart A, Brosens LA, Muntau B, Schoen C, Barth TF, van Gulik T, van Gool T, Grobusch MP, Tappe D. Echinococcus vogeli in immigrant from Suriname to the Netherlands. Emerg Infect Dis. 2015 Mar;21(3):528-30.
- Stijnis C, Bart A, Brosens L, van Gool T, Grobusch M, van gulik T, Roelfsema J, van Thiel P. First case of Echinococcus vogeli infection imported to the Netherlands, January 2013. Eurosurveillance 2013; 18(15).pii=20448
- Tamarozzi F, Mariconti M, Neumayr A, Brunetti. The intermediate host immune respons in cystic echinococcosis. Parasite immunology 2016; 38(3); 170-181
- Veit, P, Bilger B, Schad V, e.a. Influence of environmental factors on the ineffectivity of E multilocularis eggs. Parasitology 1995; 110: 79-86.
- Wilson JF, Rausch RL, McMahon BJ, Schantz PM. Parasiticidal effect of chemotherapy in alveolar hydatid disease: review of experience with mebendazole and albendazole in Alaskan Eskimos. Clin Infect Dis 1992;15:p234-49.
- Wen H, Vuitton L, Tuxun T, Li J, Vuitton DA, Zhang W, McManus DP. 2019. Echinococcosis: advances in the 21st century. Clin Microbiol Rev 32:e00075-18.
- Wuestenberg J, Grüner B, Oeztuerk S, Mason R Haenle M, Graeter T, & Akinli A, Kern P, Kratzer W. Diagnostics in cystic echinococcosis: Serology versus ultrasonography. 2014. The Turkish journal of gastroenterology. 25. 398-404. 10.5152/tjg.2014.7112.







