Vaccinatieadviezen in de context van de zorg voor personen bij wie een splenectomie is verricht, een milt (gedeeltelijk) afwezig is vanaf de geboorte of bij wie door onderliggend lijden of specifieke behandelingen sprake is van een functionele asplenie.
De behandelend specialist is de aangewezen persoon om de dezeadviezen praktisch vorm te geven bij de individuele patiënt. Andere artsen, zoals de huisarts, geven mede uitvoering aan dit beleid.
Let op: de informatie rondom pneumokokkenvaccins en Hib-vaccinatie zal worden herzien in 2025. PCV15 is vanaf 2024 onderdeel van het Rijksvaccinatieprogramma.
Vastgesteld 20 november 2018.
Wijzigingen vanaf vaststelling:
- 4 maart 2025: Aanvullingen doseringsschema’s meningokokken B-vaccinatie conform de SmPC-tekst.
- 17 september 2019: formulering van vaccinatieadviezen aangepast (bijvoorbeeld 1+1 i.p.v. 2 doses) en verwijzing naar LCR (Landelijke Coördinatiecentrum Reizigersadvisering)-protocol stollingsstoornissen toegevoegd.
- 18 februari 2019: wijzigingen in de dosering bij baby’s van 2-3 maanden n.a.v. aanpassingen in de SMPC-tekst van Bexsero.
Totstandkoming
De wijzigingen zijn voorgelegd aan de leden van de werkgroep Landelijke richtlijn (functionele) asplenie, waaruit algehele consensus is ontstaan. Vastgesteld door het LOI (Landelijk Overleg Infectieziektebestrijding) op 20 november 2018. De werkgroep was als volgt samengesteld:
- Dr. G. Berbers, vaccinoloog, RIVM (Rijksinstituut voor Volksgezondheid en Milieu)/IIV
- Dr. N.G. Hartwig, kinderarts-infectioloog, Erasmus MC (Medisch Centrum)-Sophia
- Dr. F.P. Kroon, internist-infectioloog, Leids UMC (Universitair Medisch Centrum Utrecht)
- Dr. A.J.J. Lammers, internist-infectioloog, Isala
- Dr. Q. de Mast, internist-infectioloog, Radboud UMC
- Dr. E.J.G. Peters, internist-infectioloog-acute geneeskundige, VUMC
- Dr. G. Rijkers, medisch immunoloog, Sint Antonius Ziekenhuis en UMCU
- Dr. W.L.M. Ruijs, arts infectieziektebestrijding, GGD (Gemeentelijke gezondheidsdienst) Gelderland-Zuid en RIVM/LCI
- Prof. dr. E.A.M. Sanders, kinderarts-immunoloog, UMCU en RIVM/CIb
- Drs. I. Schreuder, beleidsadviseur, RIVM/LCI (auteur herziening 2018)
- Drs. E.A.M. Slok-Raijmakers, huisarts, medisch centrum Molenzoom Houten en adviseur RIVM/LCI
- Dr. C.L. Vermont, kinderarts-infectioloog/immunoloog, Erasmus MC-Sophia
- Dr. J.G. Wildenbeest, kinderarts-infectioloog/immunoloog, UMCU (en voorheen RIVM/CIb)
De herziene richtlijn is ter accordering voorgelegd aan de volgende beroepsverenigingen:
- Nederlandse Vereniging voor Kindergeneeskunde (NVK), sectie Infectieziekten-Immunologie en sectie Kinderhematologie
- Vereniging van Infectieziekten (VIZ), Kamer van Internist-Infectiologen (KvII)
- Nederlands Huisartsen Genootschap (NHG)
- Jeugdartsen Nederland (AJN)
- Landelijk Overleg Infectieziektebestrijding (RIVM)
- Nederlandse Vereniging voor Heelkunde (NVvH), subvereniging Nederlandse vereniging voor Traumachirurgie (NVT) en subvereniging Nederlandse Vereniging voor Kinderchirurgie (NVKC)
- Landelijk Coördinatiecentrum Reizigersadvisering (LCR)
- Nederlandse Vereniging voor Hematologie (NVvH)
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
Voor goede implementatie en uitvoering van uniform advies is de richtlijn naar verschillende beroepsverenigingen gestuurd:
- Nederlandse Vereniging voor Kindergeneeskunde (NVK), sectie Infectieziekten-Immunologie (I&I)
- Vereniging van Infectieziekten (VIZ), Kamer van Internist-Infectiologen (KvII)
- Nederlands Huisartsen Genootschap (NHG)
- Jeugdartsen Nederland (AJN)
- Landelijk Overleg Infectieziektebestrijding – RIVM (LOI)
- Nederlandse Vereniging voor Heelkunde (NVvH), subvereniging Nederlandse vereniging voor Traumachirurgie (NVT) en subvereniging Nederlandse Vereniging voor Kinderchirurgie (NVKC)
- Landelijk Coördinatiecentrum Reizigersadvisering (LCR)
- Nederlandse Vereniging voor Hematologie (NVvH)
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
Samenvatting
Risico’s bij (functionele) asplenie
Personen met een (functionele) asplenie lopen een verhoogd risico op ernstige infecties met mogelijk dodelijke afloop (‘Overwhelming Postsplenectomy Infection; OPSI’, in het Nederlands ook wel aangeduid als Post Splenectomie Sepsis; PSS), door de volgende verwekkers:
- alle gekapselde bacteriën, in het bijzonder pneumokokken, maar ook Haemophilus influenzae type b en meningokokken;
- infecties na dierenbeten door een hond of kat;
- malaria;
- babesiosis, een parasitaire infectie overgebracht door tekenbeten, vooral in de endemische gebieden in het oosten van de Verenigde Staten van Amerika.
Preventie van en maatregelen bij een infectie
Zowel vaccinatie als antibioticaprofylaxe (tot de leeftijd van 5 jaar en 2 jaar na splenectomie) zijn belangrijke aspecten van de infectiepreventie bij asplenie en moeten beide worden uitgevoerd. Ook moet een mogelijke infectie zo snel mogelijk behandeld worden (= on demand-gebruik: bij koorts/koortsig gevoel direct (< 1 uur) starten met antibiotica. Men moet dus altijd een gift bij zich hebben om direct te kunnen starten.
Vaccinatieadviezen
Zie de tabellen hieronder voor specificaties van vaccinaties bij kinderen en volwassenen. Vaccinaties bij electieve (geplande) splenectomie:
- Indien mogelijk het volledige geadviseerde vaccinatieschema afronden minimaal 2 weken vóór de ingreep. Als de tijd te kort is om zowel PCV als PPV toe te dienen vóór de splenectomie, dient eerst PCV13 te worden gegeven en pas 2 weken na de splenectomie alsnog de PPV23 (wel met een interval tussen beide vaccins van minimaal 2 maanden).
- Influenzavaccinatie wordt jaarlijks gegeven tijdens de daarvoor gebruikelijke periode.
- Vaccinatie met geconjugeerde vaccins heeft de voorkeur boven vaccinatie met polysacharidevaccins. Indien beide vaccins worden geadviseerd, starten met het conjugaatvaccin en een minimaal interval van 2 maanden hanteren tussen PCV en PPV. Indien PPV23 eerder dan PCV is toegediend wordt een interval van minimaal 1 jaar tussen PPV23 en PCV13 geadviseerd.
- Indien vaccineren vóór de ingreep überhaupt niet mogelijk is, dan pas minimaal 2 weken na de ingreep de volledige geadviseerde vaccinatiereeks starten.
- Bij het gebruik van immuunsuppressieve medicatie of bij immuungecompromitteerde patiënten dient overlegd te worden met een klinisch deskundige.
- Voor mensen die in het verleden een splenectomie hebben gehad en die nog niet of slechts gedeeltelijk zijn gevaccineerd, geldt het advies om alsnog de geadviseerde ontbrekende vaccinaties toe te dienen.
- Er kunnen meerdere vaccinaties tegelijkertijd gegeven worden, mits in verschillende ledematen c.q. spiergroepen.
- De vaccinaties worden intramusculair toegediend. Ook bij mensen die anticoagulantia gebruiken (en goed zijn ingesteld na recente INR controle) kunnen vaccins tot 1 ml gewoon intramusculair worden toegediend. Alleen bij aangeboren stollingsstoornissen zoals hemofilie en de ziekte van Von Willebrandt wordt subcutane toediening van vaccins geadviseerd (en intramusculaire toediening alleen in overleg met behandelend hematoloog) (zie LCR (Landelijke Coördinatiecentrum Reizigersadvisering)-protocol stollingsstoornissen).
Antibioticaprofylaxe
Zie de stroomschema's hieronder voor specificaties van antibiotische profylaxe bij kinderen en volwassenen.
- Kinderen gebruiken dagelijks antibiotische profylaxe tot de leeftijd van 5 jaar (en tot 2 jaar na splenectomie).
- Bij kinderen jonger dan 5 jaar wordt continue profylactische behandeling geadviseerd i.p.v. on demand-gebruik. Bij kinderen ouder dan 5 jaar kan na 2 jaar overwogen worden over te gaan op on demand-antibiotica. Indien on demand-gebruik bij kinderen boven 5 jaar praktisch niet haalbaar of wenselijk is, kan in overleg met ouders antibiotische profylaxe uitgebreid worden naar de gehele kinderleeftijd.
- Bij volwassenen met asplenie is het advies van oudsher om dagelijks antibiotische profylaxe gedurende 2 jaar na splenectomie te gebruiken. Er kan met goede redenen hiervan afgeweken worden door alleen on demand-antibiotica te geven.
- Bij volwassenen met een partiële splenectomie of bij volwassenen met functionele asplenie kan overwogen worden profylactisch antibiotica achterwege te laten en direct te starten met on demand-gebruik.
- Bij patiënten met een verhoogd risico op OPSI, zoals personen die een splenectomie hebben ondergaan vanwege hematologische maligniteit, langdurige immuunsuppressieve medicatie gebruiken, of die al OPSI hebben doorgemaakt wordt geadviseerd om de duur van profylactische antibiotica te verlengen in overleg met de behandelaar.
Antibiotica bij koorts en infectie, ongeacht gebruik van antibiotische profylaxe
Zie de stroomschema's hieronder voor specificaties van antibiotische therapie bij kinderen en volwassenen.
- On demand-gebruik van antibiotica houdt in dat bij koorts/koortsig gevoel direct (< 1 uur) de persoon met asplenie zelf start met antibiotica; mensen moeten dus altijd een gift met een geldige houdbaarheidsdatum bij zich hebben om direct te starten.
- Bij koorts/koortsig gevoel altijd zo snel mogelijk contact opnemen met een arts voor klinische beoordeling. De arts kan, indien nodig, andere antibiotica voorschrijven.
Dierenbeten
De stroomschema's hieronder geven de specificaties van antibiotica na beten van honden of katten bij kinderen en volwassenen weer.
- Wond direct na beet reinigen en zo snel mogelijk door de arts laten beoordelen.
- Direct starten met antibiotica.
Maatregelen bij reizen
- Voor gedetailleerde reisadvisering verwijzing naar een reisdeskundige persoon of gespecialiseerde instantie.
- Bij reizen naar malariagebieden nauwgezet maatregelen opvolgen om muggensteken te voorkomen. Zorgvuldige toepassing van malariaprofylaxe is belangrijk. Personen zonder milt dienen altijd profylaxe te gebruiken als zij een malariagebied bezoeken. Óók in gebieden met een middelmatig of laag risico waar voor gezonde reizigers een noodbehandeling respectievelijk antimuggenmaatregelen wordt geadviseerd.
- Alertheid op tekenbeten bij reizen, in het bijzonder naar bosrijke gebieden in endemische gebieden in de Verenigde Staten van Amerika.
Diagnostiek van (functionele) asplenie
Diagnostiek van functionele asplenie is lastig. De aanwezigheid van Howell-Jolly lichaampjes suggereert asplenie. De afwezigheid hiervan sluit asplenie echter niet uit. Bij twijfel verdient het aanbeveling de patiënt te beschermen door middel van vaccinatie en andere maatregelen te nemen, die eerder in deze samenvatting zijn besproken.
Informatie en voorlichting
Alle patiënten met (functionele) asplenie dienen goed op de hoogte te zijn van de risico’s die ze lopen. Het dragen van een medisch paspoort, Medical Alert of SOS-plaatje en vaccinatiebewijs kan helpen bij adequate behandeling.
Overzicht van adviezen bij kinderen tot 16 jaar
Vaccinatie
| Leeftijd bij diagnose | 2-6 mnd | 7-11 mnd | 12-23 mnd | 2-5 jaar | 6-15 jaar |
|---|---|---|---|---|---|
| PCV13 | 3+1 | 2+1 | 1+1 | 1+1 | 1-maal |
| PPV23 | 1-maal bij 24 mnd Herhalen na 3 jaar, daarna elke 5 jaar herhalen |
1-maal bij 24 mnd Herhalen na 3 jaar, daarna elke 5 jaar herhalen |
1-maal bij 24 mnd Herhalen na 3 jaar, daarna elke 5 jaar herhalen |
1-maal bij diagnose Herhalen na 3 jaar, daarna elke 5 jaar herhalen |
1-maal bij diagnose Daarna elke 5 jaar herhalen |
| Hib |
3+1 (RVP) Booster na 2 jaar |
2+1 Booster na 2 jaar |
1+1 Booster na 2 jaar |
1-maal (inhalen) Booster na 2 jaar |
1-maal (inhalen) |
| MenACWY (meningokokken typen A,C,W,Y.) | 3+1 | 2+1 |
1+1 |
1+1 | 1+1 |
| MenB | 3+1 of 2+1 | 2+1 | 2+1 | 1+1 | Bexsero: 1+1 Trumenba: 2+1 of 1+1 |
| Influenza | - | Jaarlijks | Jaarlijks | Jaarlijks | Jaarlijks |
Pneumokokken (conjugaat) (PCV)
- Het conjugaatvaccin wordt aangeboden via het RVP (Rijksvaccinatieprogramma) met een 2+1 schema (op 3, 5 en 12 mnd). Indien niet/onvolledig ontvangen, alsnog toedienen.
- In het RVP wordt PCV10 aangeboden, voor kinderen met (functionele) asplenie wordt het hoogstvalente conjugaatvaccin geadviseerd (PCV13).
- Indien in de toekomst een hogervalent conjugaatvaccin beschikbaar komt, altijd het hoogstvalente conjugaatvaccin geven.
Schema m.b.t. toediening:
- Diagnose bij 2-6 mnd: 3+1 schema, op 2, 4, 6 en 12 mnd kalenderleeftijd. NB. Dit is een ander toedieningsschema (4 vaccinaties i.p.v. 3) dan in het RVP.
- Diagnose bij 7-11 mnd: 2+1 schema, op 0, 2 en 6 mnd (ook als (deels) RVP gevaccineerd is met lagervalent vaccin).
- Diagnose bij 1-5 jaar: 1+1 schema, met interval van 2-6 mnd, ook als (deels) gevaccineerd volgens het RVP met lagervalent vaccin.
- Diagnose bij 6-15 jaar: 1-maal.
Pneumokokken (polysacharide) (PPV)
- Er moeten minimaal 2 mnd tussen PCV en PPV23-vaccinatie zitten, waarbij eerst PCV en daarna PPV-vaccinatie wordt gegeven.
Schema m.b.t. toediening:
- Diagnose bij < 6 jaar: 1-maal bij 24 mnd, herhalen na 3 jaar, daarna elke 5 jaar herhalen.
- Diagnose bij ≥ 6 jaar: 1-maal bij diagnose min 2 mnd na PCV, daarna elke 5 jaar herhalen.
Meningokokken ACWY (conjugaat)
- MenACWY-vaccinatie is in 2018 opgenomen in RVP, voor kinderen van 14 maanden en 14 jaar.
- Indien het monovalente vaccin NeisVac-C is gegeven binnen het RVP, is het advies alsnog te vaccineren met MenACWY conform leeftijdsadvies.
- Indien eerder eenmalig gevaccineerd met MenACWY, 1-maal ontbrekende vaccinatie toedienen (min. 3 jaar na vaccinatie).
Schema m.b.t. toediening:
- Diagnose bij 2-6 mnd: 3+1 schema, op 2, 3, 4 en 12-15 mnd kalenderleeftijd.
- Diagnose bij 3-5 mnd: 2+1 schema, z.s.m. na diagnose met interval van minimaal 6 maanden tussen primaire vaccinatieserie en booster met 12-15 mnd kalenderleeftijd.
- Diagnose bij 7-11 mnd: 2+1 schema, op 0, 2 en 6 mnd.
- Diagnose bij 1-5 jaar: indien niet/onvolledig gevaccineerd 1+1 schema en booster 3-5 jaar later.
- Diagnose bij > 5 jaar: indien niet/onvolledig gevaccineerd 1 maal en booster 3-5 jaar later.
Meningokokken B
- Vaccinatie is niet opgenomen in huidige RVP.
Schema m.b.t. toediening Bexsero:
- Diagnose bij 2-5 mnd: 3+1 schema op 2, 3 en 4 mnd en booster met 12-15 mnd kalenderleeftijd of als alternatief 2+1 schema vanaf leeftijd 3 mnd op 3 en 5 mnd en booster met 12-15 mnd kalenderleeftijd.
- Diagnose bij 6-11 mnd: 2+1 schema op 0, 2 mnd en booster met 24 mnd kalenderleeftijd.
- Diagnose bij 12-23 mnd: 2+1 schema op 0, 2 mnd en booster 1-2 jaar later.
- Diagnose bij 2-10 jaar: 1+1 schema met minimaal interval van 1 mnd. Overweeg een boosterdosis bij personen met een blijvend risico op invasieve meningokokkenziekte.
- Diagnose bij > 10 jaar: 1+1 schema met min. interval van 1 mnd. Overweeg een boosterdosis bij personen met een blijvend risico op invasieve meningokokkenziekte.
Schema m.b.t. toediening Trumenba:
- Geregistreerd vanaf leeftijd 10 jaar: 2+1 schema op 0, 1-2 mnd en 5-6 mnd of als alternatief 1+1-schema op 0 en 6 mnd. Indien bescherming op korte termijn gewenst is, kan het 2+1 schema van toepassing zijn. Overweeg een boosterdosis bij personen met een blijvend risico op invasieve meningokokkenziekte.
Hib
- Wordt aangeboden via het RVP
- Indien volledig gevaccineerd conform RVP-schema en onder leeftijd van 5 jaar: 1 revaccinatie nodig 2 jaar na laatste vaccinatie. Na leeftijd 5 jaar geen revaccinaties meer nodig.
Schema m.b.t. toediening:
- Diagnose bij 2-6 mnd: 3+1-RVP-schema, op 2, 3, 5 en 12 mnd met aanvullend een extra booster 2 jaar later. Indien niet/onvolledig gevaccineerd alsnog z.s.m. 3+1- schema (0, 2 en 6 mnd) en booster 2 jaar later. NB. Dit is een ander toedieningsschema dan in het RVP (4 vaccinaties i.p.v. 3).
- Diagnose bij 7-11 mnd: RVP-schema en aanvullend een extra booster na 2 jaar. Indien niet/onvolledig gevaccineerd 2+1-schema, 0, 1-2 en 6 mnd en aanvullend een extra booster na 2 jaar.
- Diagnose bij 1-5 jaar: indien niet/onvolledig gevaccineerd 1-maal inhalen en aanvullend een extra booster na 2 jaar.
- Diagnose bij > 5 jaar: indien niet/onvolledig gevaccineerd 1-maal inhalen, geen booster.
Influenza
- Niet geregistreerd < 6 mnd. Bij vaccineren voor deze leeftijd overleg met deskundige.
Schema m.b.t. toediening:
- Een eerste influenzavaccinatie bij kinderen < 6 jaar dient 1-malig na 1 maand herhaald te worden. De jaren daarop volstaat 1-maal influenzavaccinatie.
- Jaarlijks vanuit de SNPG (risicogroepen).
Algemeen
- Indien mogelijk vaccineren voorafgaand aan de splenectomie.
- Asplenie bij kinderen jonger dan 1 jaar uiterst zeldzaam. Echter juist in deze periode worden veel vaccinaties geadviseerd (RVP+Men). In overleg met behandelaar/expert bekijken hoe het vaccinatieschema er voor die kinderen uit zal zien en wat prioriteit heeft.
- Advies op maat na individuele risico-inschatting heeft altijd prioriteit boven bovengenoemde vaccinatieadviezen.
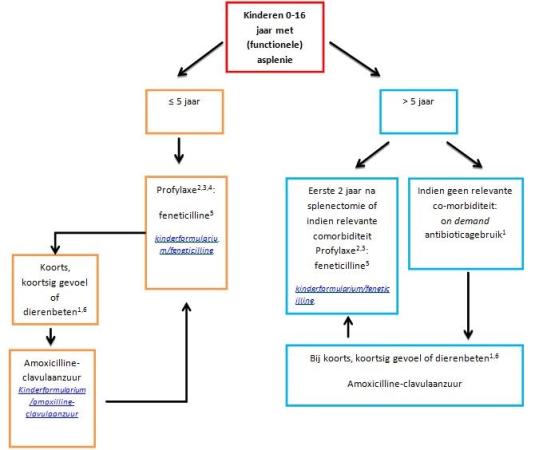
Antibiotica bij kinderen tot 16 jaar
Figuur: Stroomschema antibiotica < 16 jaar
- On demand-gebruik: bij koorts/koortsig gevoel direct (< 1 uur) starten met antibiotica; kinderen moeten dus altijd een gift bij zich hebben om direct te starten.
- Uit literatuur is het nut van antibioticaprofylaxe bewezen in de eerste 5 levensjaren en kan er na de leeftijd van 5 jaar gestopt worden met antibiotische profylaxe, mits on demand-gebruik haalbaar is. Wanneer dit niet haalbaar is kan in overleg met ouders en behandelaar de duur van de profylaxe verlengd worden, evt. tot de gehele kinderleeftijd.
- Bij patiënten met een doorgemaakte OPSI en/of ander hoog risico mogelijk duur profylactische antibiotica verlengen i.o.m. behandelaar.
- On demand-gebruik minder betrouwbaar in deze leeftijdsgroep (o.a. door hogere frequentie koorts/koortsig gevoel en/of immaturiteit immuunsysteem), om deze reden advies t/m 5 jaar alleen antibiotische profylaxe en niet on demand.
- Alternatief voor feneticilline is fenoxymethylpenicilline (dosering is idem).
- Beten van honden of katten bij kinderen en volwassenen (dierenbeten).
Bij penicilline-allergie:
- Profylaxe: azitromycine 10mg/kg 3x/wk of claritromycine 7,5 mg/kg 1dd
- On demand: azitromycine 10mg/kg 3-5dg (max. 500mg per dag) of claritromycine 15 mg/kg in 2 doses. Bij gebruik macroliden als profylaxe: overleg met kinderinfectioloog of microbioloog.
- Na honden- of kattenbeten: indien macroliden worden gebruikt als profylaxe: overleg met kinderinfectioloog of microbioloog.
Overzicht van adviezen jongeren en volwassenen vanaf 16 jaar
Vaccinatie
| Vaccinatie | Schema volwassenen |
|---|---|
| PCV13 | 1-maal (eenmalig inhalen indien nooit gevaccineerd) |
| PPV23 | 1 maal (min. 2 maanden na PCV13). Daarna elke 5 jaar herhalen |
| Hib | 1-maal (eenmalig inhalen indien nooit gevaccineerd) |
| MenACWY | 1-maal. Indien < 24 jaar 1-malig revaccinatie na 3-5 jaar |
| MenB | 1+1 |
| Influenza | Jaarlijks |
Pneumokokken (conjugaat) (PCV)
- PCV wordt gegeven vóór PPV.
- Indien niet/onvolledig PCV-gevaccineerd: eenmalig vaccineren met hoogstvalente PCV-vaccin.
- Indien in de toekomst een hogervalent conjugaatvaccin beschikbaar komt, deze vervangen zodat altijd het hoogstvalente vaccin wordt gegeven.
Pneumokokken (polysacharide) (PPV)
- Er wordt een minimaal interval van 2 maanden aangehouden tussen PCV en de hierop volgende PPV-vaccinatie.
- Bij diagnose 1 maal toedienen en elke 5 jaar herhalen.
- Personen die al eerder gevaccineerd zijn met PPV23 kunnen bij een revaccinatie eerst gevaccineerd worden met PCV13, minimaal 2 mnd later gevolgd door PPV23 (mits 5 jaar na vorige PPV23 vaccinatie).
- Indien de tijd te kort is om zowel PCV als PPV toe te dienen voor een reis of voor de splenectomie of anderszins, dient toch eerst PCV13 te worden gegeven en pas na minimaal 2 mnd PPV23.
Meningokokken ACWY (conjugaat)
- MenACWY-vaccinatie is in 2018 opgenomen in RVP.
- Indien aan volwassenen (leeftijd > 24 jaar) in het verleden het monovalente vaccin NeisVac-C is gegeven, is het niet nodig om een actieve inhaalvaccinatie MenACWY aan te bieden.
- Indien eerder gevaccineerd met MenACWY, geen vaccinaties meer nodig (tenzij leeftijd < 24 jaar, dan éénmalig revaccinatie na 3-5 jaar).
Meningokokken B
- Vaccinatie is niet opgenomen in RVP.
- Bij diagnose: Bexsero: 1+1 schema met min. interval van 1 mnd (bij gebruik van Trumenba: 2+1 schema).
Hib (conjugaat)
- Wordt aangeboden via het RVP. Indien ooit volledig gevaccineerd geen aanvullende vaccinaties nodig.
- Indien niet/onvolledig gevaccineerd: 1-maal inhalen.
Influenza
- Jaarlijks vanuit de SNPG (risicogroepen).
Algemeen
- Indien mogelijk wordt vaccineren voorafgaand aan de splenectomie geadviseerd.
- Advies op maat en individuele risico-inschatting heeft altijd prioriteit boven bovengenoemde vaccinatieadviezen.
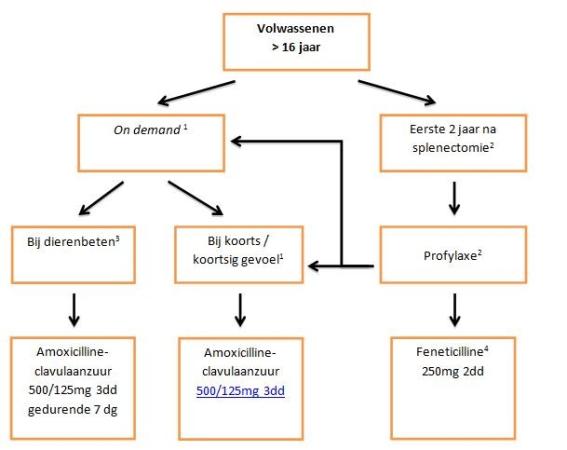
Antibiotica-adviezen vanaf 16 jaar
Figuur: Stroomschema antibiotica > 16 jaar
- On demand-gebruik: Bij koorts/koortsig gevoel direct (< 1 uur) starten met antibiotica; men moet dus altijd een gift bij zich hebben om direct te starten (= on demand-gebruik).
- Bij patiënten met een hoog risico op OPSI, zoals splenectomie voor hematologische maligniteit, langdurig gebruik van immuunsuppressieve medicatie, of een eerder doorgemaakte OPSI (zie hoofdstuk 3), mogelijk duur profylactische antibiotica verlengen i.o.m. behandelaar.
- Beten van honden of katten bij kinderen en volwassenen (dierenbeten)
- Alternatief voor feneticilline is fenoxymethylpenicilline (dosering is idem)
Bij penicilline-allergie:
- Profylaxe: azitromycine 3x/wk 250 mg of claritromycine 1 dd 500 mg (normaal preparaat)
- On demand: claritromycine 2 dd 500 mg (of moxifloxacine 1 dd 400 mg indien macroliden al profylactisch worden gebruikt)
- Na honden- of kattenbeten: clindamycine 600 mg 3 dd + ciprofloxacine 500 mg 2 dd gedurende 5 dg
1. Risico’s van (functionele) asplenie
Asplenie is het niet aanwezig zijn van een functionerende milt. De oorzaak van de asplenie kan aangeboren zijn (zgn. congenitale asplenie; uiterst zeldzaam), maar ook onderliggend lijden zoals sikkelcelanemie of specifieke behandelingen, chirurgisch ingrijpen, of een hematologische aandoening of stamceltransplantatie. Elk jaar worden in Nederland tussen 500 en 1000 splenectomieën verricht [1, 2]. Chirurgische verwijdering van de milt wordt uitgevoerd voor verschillende indicaties zoals trauma, idiopathische trombocytopenische purpura (ITP) en andere hematologische ziekten (gepaard gaande met splenomegalie, refractaire auto-immuun hemolytische anemie of sferocytose of maligniteit). Verder worden er accidentele splenectomieën uitgevoerd tijdens operaties voor een andere indicatie [1, 3]. Ook embolisatie van de milt kan tot asplenie lijden (afhankelijk van het type embolisatie en het resterende functionele miltweefsel).
Personen zonder (functionele) milt hebben een sterk verhoogd risico op ernstig verlopende infecties, vaak aangeduid met ‘Overwhelming Postsplenectomy Infection’ (OPSI, in het Nederlands ook wel aangeduid als Post Splenectomie Sepsis, PSS) [4,5]. Dit risico is het hoogst voor personen die een splenectomie hebben ondergaan vanwege hematologische maligniteiten [6]. De incidentie van dit beeld wordt geschat op 2-5 per 1000 patiënten zonder (functionele) milt per jaar [7-9]. De mortaliteit van OPSI is hoog en bedraagt 50-70% van de gevallen. De start van de infectie is vaak aspecifiek (griepachtige verschijnselen), maar het beloop is snel progressief en kan binnen enkele uren uitmonden in een septische shock, multi-orgaanfalen en overlijden [6, 7, 10-12]. Een meerderheid van de infecties lijkt op te treden in de eerste 2 jaar na splenectomie [3,6,9] maar het verhoogde risico op het optreden van infecties lijkt levenslang te bestaan [4].
Functie van de milt
De milt, in het bijzonder de marginale zone van de milt, heeft een belangrijke functie bij de afweer tegen infecties doordat hier zowel de aangeboren immuunrespons als de adaptieve immuunrespons kan worden geïnitieerd [13-15]. Via het reticulo-endotheliale-systeem (RES), ook wel het mononucleaire-fagocytensysteem genoemd, staan fagocyten in nauw contact met het bloed wat door de milt stroomt; door deze fagocyten kan een bacteriëmie snel geklaard worden [13]. Omdat bij asplenie het snelle contact tussen fagocyten uit het RES en bacteriën ontbreekt, kunnen bacteriën in de bloedbaan bij asplenie niet snel weggevangen worden. Daardoor is er bij patiënten met asplenie een verhoogd risico op ernstig beloop van bacteriëmieën.
Daarnaast heeft de milt een functie in de humorale immuunrespons, vooral in de vroege antistofvorming (immunoglobuline M, IgM (immunoglobuline M)) tegen kapselpolysacharide-antigenen. Bacteriën met een polysacharidekapsel, zoals pneumokokken, hib en meningokokken, worden alleen optimaal door fagocyten herkend als ze met antistoffen beladen zijn, de zogenaamde opsonisatie [13-15]. Na splenectomie valt deze functie weg waardoor het aantal IgM-producerende B-cellen daalt, met als mogelijk gevolg lagere IgM-titers.
De lever als orgaan kan de filterfunctie van de milt na splenectomie gedeeltelijk overnemen en zodoende bacteriën wegvangen uit de bloedbaan. Dit geldt vooral voor bacteriën die geopsoniseerd zijn met specifieke antilichamen. Opsonisatie is juist verlaagd bij patiënten met asplenie. Daarom zijn hoge antistoftiters tegen gekapselde bacteriën cruciaal bij een patiënt met (functionele) asplenie.
Risico's
Na splenectomie is er een verhoogd risico op het krijgen van ernstige infecties met gekapselde bacteriën. In het bijzonder Streptococcus pneumoniae (pneumokokken), maar ook Haemophilus influenzae type b (Hib) en Neisseria meningitidis (meningokokken) geven een verhoogd risico. Echter, infecties met de twee laatstgenoemde leiden minder vaak tot OPSI en dienen lagere prioritiet te krijgen ten opzichte van Streptococcus pneumoniae in de preventieve zorg van aspleniepatiënten. De pneumokok veroorzaakt tot 90% van de infecties door de gekapselde micro-organismen [4, 16].
In specifieke situaties kunnen ook andere micro-organismen ernstige infecties veroorzaken. Zo kan een infectie met Escherichia coli bij pasgeborenen met congenitale asplenie fulminant verlopen [17, 18]. Ook geldt dit voor infectie met bepaalde intracellulaire parasieten, zoals malaria door Plasmodium-species [13, 17-19]. Verder is er een risico op babesiosis na een tekenbeet, vooral in endemische gebieden in de Verenigde Staten van Amerika [20], en op Capnocytophaga canimorsus-infectie na een dierenbeet met hond of kat [21, 22].
2. Risicogroepen en herkenning van patiënt zonder (functionele) milt
Er zijn drie groepen patiënten met (functionele) asplenie te onderscheiden.
1. Als eerste groep onderscheiden we de patiënten bij wie embolisatie heeft plaatsgevonden na traumatisch miltletsel (afhankelijk van type embolisatie en/of functionele restfunctie van de milt) of personen bij wie de milt operatief verwijderd is (Schimmer 2012) Dit laatste kan nodig zijn na een trauma, in verband met een cyste of maligniteit of in het kader van een aantal hematologische aandoeningen. In geval van operatieve miltverwijdering wordt de ernst van de gevolgen van deze verwijdering bepaald door de volgende factoren:
- De leeftijd waarop de splenectomie heeft plaatsgevonden. Bij miltverwijdering op jongvolwassen leeftijd is de kans op problemen kleiner dan bij kinderen onder 5 jaar oud en ouderen. Jongvolwassenen hebben al verworven immuniteit en geen verminderd functioneren van hun afweer als gevolg van immaturiteit of ouderdom.
- De reden voor splenectomie. Bij splenectomie vanwege een onderliggende (hematologische) ziekte, is de kans op infectieuze complicaties beduidend groter dan bij splenectomie na een trauma [6].
- De volledigheid van de splenectomie. Indien nog een deel van de milt in situ blijft of als er sprake is van splenosis op het peritoneum, is er mogelijk resterende immunocompetentie van dit deel te verwachten [2].
- Tijdsverloop na splenectomie. De kans op OPSI is het grootst binnen 2 jaar na de operatie maar blijft levenslang verhoogd [4,5,8] Personen zonder milt die eerder OPSI hebben doorgemaakt hebben een extra verhoogd risico op recidief [23].
Een inventarisatie onder een selectie van Nederlandse ziekenhuizen maakt duidelijk dat een splenectomie in 36 procent van de gevallen electief gebeurt en in 21 procent acuut als gevolg van een trauma. Bij 34 procent was er sprake van iatrogene schade en in ruim 7 procent werd durante operatione besloten de milt te verwijderen [3].
2. De tweede, kleine, groep bestaat uit mensen die worden geboren zonder milt (congenitale asplenie). Dit is uiterst zeldzaam.
3. Als derde een grotere, maar zeer diverse groep patiënten met mogelijk een functionele hyposplenie of asplenie vanwege onderliggend lijden of specifieke behandelingen. Bij sikkelcelanemie, een miltinfarct, na bestraling van de milt of bij een ernstige IBD of ernstige coeliakie (waarvoor controle in het ziekenhuis nodig is), is de kans op een functionele asplenie zeer groot en is de mening van de werkgroep om deze patiënten allen te behandelen volgens de aanbevelingen van deze richtlijn. Bij andere ziektebeelden is het minder duidelijk in hoeverre er sprake is van hyposplenie zoals bij een deel van de mensen met een onderliggende of actieve chronische darmontsteking als gevolg van een milde coeliakie of een milde IBD [24]. Een Nederlands onderzoek in 2007 toonde aan dat de prevalentie van afwijkingen in de hielprik wijzend op hemoglobinopathie 0,035 procent (komt overeen met ongeveer 6.000 pasgeborenen) betrof. Hierbij was bij 41 kinderen (2,2:10.000) sprake van sikkelcelziekte [25]. Mensen met ernstig leverlijden of hivpositieve personen met langdurig lage CD4-cellen kunnen ook functionele hyposplenie hebben [24, 26]. Dit onderstreept het belang van maatregelen om bij hen infecties te voorkomen.
Zie de tabel hieronder voor een - niet uitputtend - overzicht van ziektebeelden die gepaard kunnen gaan met functionele asplenie [27].
Aandoeningen met het risico op (functionele) asplenie
| Cardiaal |
|
|---|---|
| Gastro-intestinaal |
|
| Leverziekten |
|
| Hematologisch |
|
| Auto-immuun |
|
| Infiltrerend |
|
| Vasculair |
|
| Overig |
|
De aanbevelingen in deze richtlijn gelden niet zonder meer voor alle patiënten met één van de aandoeningen van in deze tabel, aangezien het niet altijd duidelijk is of er sprake is van functionele asplenie.
De werkgroep is van mening dat bij patiënten met sikkelcelanemie, na een miltinfarct of na bestraling van de milt, de kans op functionele asplenie zo groot is dat huidige aanbevelingen voor deze groepen wel van toepassing zijn. Voor andere onderliggende ziekten die een functionele asplenie kunnen veroorzaken, zoals andere hemolytische anemieën met extreme bloedaanmaak, inflammatoire darmziekten, hivinfectie en coeliakie, is het minder goed mogelijk om de mate van hyposplenie in te schatten. Daarom is het advies niet om alle patiëntengroepen met een potentiële hyposplenie standaard te vaccineren en antibiotica te geven, maar dit per geval te evalueren.
Voor sommige risicogroepen (zoals hivpositieve personen) zijn aparte richtlijnen met vaccinatie-aanbevelingen. De behandelend specialist speelt hierbij, samen met een deskundig internist-infectioloog, een belangrijke rol. Onderzoek om de patiënten met één van de aandoeningen die verband houden met functionele asplenie beter te kunnen indelen in groepen met een hoger versus lager risico op OPSI, is belangrijk om de behandeling zo adequaat mogelijk te kunnen toepassen.
Bij operatieve verwijdering kan een litteken een aanknopingspunt zijn voor het herkennen van een patiënt met asplenie. Tegenwoordig wordt splenectomie echter steeds vaker laparoscopisch uitgevoerd. De milt verwijdert normaal erytrocyten met resten van kernmateriaal uit het bloed, in een bloeduitstrijkje herkenbaar als erytrocyten met Howell-Jolly lichaampjes.
Bij mensen met een functionele asplenie kan een uitstrijkje van het perifere bloed met aanwezige Howell-Jolly lichaampjes een aanwijzing zijn voor functionele asplenie [23]. De afwezigheid van Howell-Jolly lichaampjes sluit een functionele asplenie echter niet uit. Door sequestratie beïnvloedt de milt ook de celsamenstelling van het bloed. Bij splenectomie is er een matige stijging van het aantal erytrocyten en een sterke toename van het aantal trombo- en leukocyten, maar dit kan tijdelijk zijn. Met beeldvorming door middel van miltechografie is niet vast te stellen of iemand een al dan niet goed functionerende milt heeft. Miltscintigrafie (gouden standaard) biedt deze mogelijkheid wel, maar is zeer invasief. In specifieke gevallen kan dit echter wel uitkomst bieden. De behandelend specialist speelt hier, samen met een deskundig internist-infectioloog, een belangrijke rol in.
3. Morbiditeit en mortaliteit van infecties bij (functionele) asplenie
Een persoon met (functionele) asplenie heeft ongeveer 5 procent kans om ergens in het leven een levensbedreigende infectie te ontwikkelen [5, 28]. De mortaliteit is hierbij hoog en bedraagt 50-70 procent van de gevallen [9,10]. Schots onderzoek onder ruim 1600 splenectomiepatiënten toonde een incidentie van een eerste ernstige infectie van 7.0 per 100 persoonsjaren aan [9]. Bij herhaling van de infecties ontstond 61 procent van de tweede en 84 procent van de derde infecties binnen 6 maanden na de eerste infectie. Personen ouder dan 50 jaar en patiënten, die splenectomie ondergingen vanwege (hematologische) maligniteiten, liepen het grootste risico. 50-80 procent van de morbiditeit en mortaliteit van alle splenectomiepatiënten vond plaats binnen 1-3 jaar na splenectomie [9].
Homozygote sikkelcelziekte kan in een functionele asplenie in de eerste levensjaren resulteren [29, 30]. De mortaliteit van sikkelcelziekte bij kinderen en jongvolwassenen is hoog en bedraagt 5 per 1000 persoonsjaren. Hierbij waren invasieve bacteriële infecties verantwoordelijk voor 40 procent van de sterfgevallen bij deze kinderen [30, 31].
4. Invasieve infecties in Nederland
Vaccinaties tegen Haemophilus influenzae type b, meningokokken serotype C, meningokokken serotypen ACWY en tegen Streptococcus pneumoniae (7-valent) zijn in het RVP ingevoerd in respectievelijk 1993, 2002, 2018 en 2006. Het 7-valente vaccin tegen Streptococcus pneumoniae is in 2011 vervangen door het 10-valente vaccin.
Na invoering van de vaccinaties is er een duidelijke daling zichtbaar van infecties veroorzaakt door de serotypen van deze bacteriën waartegen gevaccineerd wordt, ook onder niet-gevaccineerden. Echter, voor pneumokokken zien we een verschuiving optreden (ook wel replacement genoemd) naar ziekte door niet-vaccin serotypen. Als gevolg van deze verschuiving geven de vaccins onvolledige bescherming tegen de circulerende serotypen die invasieve pneumokokkeninfecties veroorzaken en komen ernstige infecties nog steeds voor, zowel van de serotypen waartegen gevaccineerd wordt als van non-vaccinserotypen. Van pneumokokken zijn immers meer dan 90 serotypen bekend [32], van meningokokken dekken we in het RVP tot medio 2018 alleen serotype C en niet de andere belangrijke typen als B, W en Y. Ook Haemophilus influenzae kent 6 verschillende kapseleiwitten en dus 6 typen.
Na splenectomie is er een verhoogd risico op het krijgen van ernstige infecties met bovengenoemde verwekkers. In het bijzonder is de pneumokok de belangrijkste verwekker van postsplenectomie-infecties en veroorzaakt tot wel 90 procent van alle infecties [4,16]. Aangezien alle bovengenoemde verwekkers nog steeds circuleren, is bescherming van kwetsbare personen, zoals patiënten met (functionele) asplenie, hiertegen belangrijk waarbij bescherming tegen Streptococcus pneumoniae de hoogste prioriteit heeft.
5. Preventie van en maatregelen bij infectie
Vaccinaties
Er zijn geen gecontroleerde gerandomiseerde onderzoeken uitgevoerd naar de effectiviteit van vaccinaties en antibiotische profylaxe bij kinderen en volwassenen met (functionele) asplenie. Wel zijn er gegevens beschikbaar over de immunogeniciteit van vaccins en is er veelvuldig onderzoek gedaan naar het effect van de vaccinaties die in deze richtlijn worden geadviseerd bij gezonde kinderen en volwassenen. Deze gegevens zijn mogelijk extrapoleerbaar naar patiënten met (functionele) asplenie. Door het ontbreken van harde bewijzen zijn niet alle adviezen gebaseerd op wetenschappelijk onderzoek maar zijn deze mede tot stand zijn gekomen middels expert consensus. Voor kinderen, met name onder de leeftijd van 1 jaar, geldt dat asplenie bij deze groep uiterst zeldzaam is. Echter, juist bij deze groep worden veel vaccinaties geadviseerd. In overleg met de behandelaar of klinisch expert dient er bekeken te worden hoe het vaccinatieschema er voor die kinderen uit zal zien en wat prioriteit heeft. Bovendien heeft advies op maat na individuele risico-inschatting altijd prioriteit boven de genoemde vaccinatieadviezen.
Pneumokokken
Zoals eerder genoemd hebben patiënten met (functionele) asplenie een verhoogde kans op infecties met gekapselde bacteriën en in het bijzonder Streptococcus pneumoniae. Tegen de pneumokok zijn twee typen vaccins beschikbaar: conjugaatvaccins (PCV10 en PCV13) en polysacharidevaccins (PPV23).
Conjugaatvaccins
Bij conjugaatvaccins zijn polysacharide-antigenen gekoppeld aan een dragereiwit met als gevolg dat er wel een T-cel afhankelijke immuunrespons optreedt die immunologisch geheugen induceert. Hierdoor worden niet alleen plasmacellen gevormd die antistoffen produceren, maar wordt er ook een immunologisch geheugen opgebouwd wat leidt tot een boosterrespons bij herhaalde vaccinatie en/of natuurlijke infectie en langdurige bescherming tegen de in het vaccin opgenomen serotypen [33]. Conjugaatvaccins zijn vanaf de leeftijd van enkele weken immunogeen en geven goede antistofresponsen na herhaalde vaccinaties [34].
Er zijn momenteel (2018) twee conjugaatvaccins in Nederland beschikbaar: PCV10 en PCV13 die beschermen tegen respectievelijk 10 en 13 serotypen. Het 10-valente vaccin is vanaf 2011 opgenomen in het RVP. Het 13-valente vaccin, niet opgenomen in het RVP, is geregistreerd in 2010 en heeft een bredere dekking dan PCV10. Daarom wordt dit vaccin geadviseerd voor patiënten uit medische risicogroepen waaronder patiënten met een (functionele) hyposplenie en asplenie [35, 36].
Nu in vaccinatieprogramma’s grootschalig kinderen met PCV10 (of PCV13) worden gevaccineerd, circuleren PCV10 en PCV13 vaccinserotypen steeds minder. Daarentegen neemt het aandeel van de 10 extra serotypen van PPV23 toe, maar ook van de non-vaccin serotypen die niet worden gedekt door een van de vaccins. Dit heeft als gevolg dat vaccinatie alléén onvoldoende bescherming geeft tegen circulerende serotypen en dus tegen een mogelijke pneumokokkeninfectie in het algemeen [surveillancedata RIVM (Rijksinstituut voor Volksgezondheid en Milieu) sentinel labs 2004-2016]. Er is dus reden om altijd na vaccinatie met PCV13 tevens te vaccineren met PPV23, omdat het risico op een fulminant verlopende invasieve pneumokokkeninfectie bij mensen met (functionele) hyposplenie en asplenie zeer hoog is [8, 10, 37].
Indien iemand nooit eerder is gevaccineerd met een pneumokokkenconjugaatvaccin adviseren wij een eenmalige dosis met het hoogstvalent conjugaatvaccin toe te dienen alvorens te vaccineren met het polysacharidevaccin (zie de tabellen kinderen en volwassenen hierboven). Geadviseerd wordt om minimaal 2 maanden te hanteren als interval tussen het conjugaat- en het polysacharidevaccin i.v.m. de mogelijkheid van optreden van hyporesponsiviteit voor de typen die in het conjugaatvaccin zitten. Vanuit immunologisch oogpunt heeft de termijn van 6 maanden de voorkeur maar in de praktijk is het meestal belangrijker om de patiënt zo snel mogelijk te beschermen en wordt dus een termijn van 2 maanden gehanteerd. Indien PPV23 eerder dan PCV is toegediend wordt geadviseerd om PCV13 na een interval van minimaal 1 jaar na PPV23 toe te dienen (ACIP).
Polysacharidevaccins
Na vaccinatie met polysacharidevaccins wordt geen immunologisch geheugen opgebouwd. Polysacharidevaccins zijn slechts in zeer geringe mate in staat zijn om B-lymfocyten te stimuleren, zonder de tussenkomst van T-helpercellen. De beschermingsduur is daardoor beperkt en voor een langdurige bescherming zijn periodieke herhalingsvaccinaties nodig om antistofniveaus op peil te houden [38].
Hoge antistofniveaus zijn essentieel voor bescherming bij asplenie. Er zijn echter aanwijzingen voor een verminderde antistofrespons na herhaalde revaccinatie met PPV23, zogeheten hyporesponsiviteit. Hyporesponsiviteit ontstaat mogelijk doordat de al eerder gevormde memory B-cellen na herhaaldelijke PPV23 revaccinatie in aantal afnemen (en niet worden aangevuld) waardoor er een minder hoge concentratie IgG (immunoglobuline G)-antilichamen geproduceerd wordt [39-42]. Hyporesponsiviteit treedt vooral op bij aanwezigheid van een hoge concentratie polysacharide-antigenen na herhaalde revaccinatie met een kort interval (binnen 2-3 jaar) en neemt af bij grotere intervallen tussen revaccinaties van meer dan 5 jaar [43-45]. De klinische relevantie van hyporesponsiviteit is echter onbekend. Nader onderzoek om klinische implicaties beter te kunnen inschatten is nodig maar vereist zeer grootschalige studies over een lange periode. Omdat bekend is dat de titers bij volwassenen na vaccinatie en revaccinatie met PPV23 na 10 jaar substantieel gezakt zijn, wordt revaccinatie met PPV23 elke 5 jaar aangeraden [43, 44]. Bovendien zijn polysacharidevaccins onvoldoende immunogeen bij kinderen jonger dan 2 jaar, waarschijnlijk vanwege een nog onvoldoende gerijpt immuunsysteem. Vanaf de leeftijd van 5 jaar is de aanmaak van anti-polysacharideantistoffen goed, maar deze is pas optimaal bij jonge, gezonde volwassenen.
Vaccinatie met het polysacharidevaccin in aanvulling op het conjugaatvaccin wordt geadviseerd voor bredere dekking van de serotypen. In Nederland zijn twee 23-valente polysacharidevaccin beschikbaar: Pneumovax 23 en Pneumo 23.
Andere verwekkers
De meeste informatie over vaccineren bij (functionele) asplenie gaat over vaccinatie tegen pneumokokkeninfecties. Echter, ook infecties met verschillende serogroepen meningokokken en Haemophilus influenzae type b geven van oudsher een groter risico op OPSI bij een niet-functionele milt en daarom is vaccinatie geïndiceerd (tabel 1 en 2). Echter, de wetenschappelijke onderbouwing om alle aspleniepatiënten te beschermen tegen deze verwekkers is minder groot.
Meningokokken
Begin jaren 2000 waren er veel infecties met meningokokken C (MenC) in Nederland. Vanuit het RVP krijgen kinderen daarom sinds 2002 MenC (meningokokken type C)-vaccinatie aangeboden (NeisVac-C; tot zomer 2018 gebruikt in het RVP). Op dit moment zijn meningokokken serogroep B en serogroep Wde meest voorkomende serogroepen in Nederland. Mede daarom heeft de Gezondheidsraad in 2017 besloten NeisVac-C in het RVP te vervangen door een van de quadrivalente vaccins die bescherming bieden tegen serogroepen A, C, W en Y (MenACWY). Dit zijn geconjugeerde vaccins en dus ook werkzaam bij jonge kinderen onder de leeftijd van 2 jaar. Het bewerkstelligt een T-celafhankelijke immuunrespons met als gevolg het opwekken van immunologische geheugenvorming met daardoor langdurige immuniteit.
Er zijn tot heden (februari 2019) twee conjugaatvaccins tegen MenACWY geregistreerd: Menveo, geregistreerd voor personen vanaf 2 jaar, en Nimenrix, geregistreerd vanaf de leeftijd van 2 maanden. Naast deze vaccins zijn er verschillende vaccins tegen serogroep B geregistreerd (Bexsero; geregistreerd vanaf 2 maanden en Trumenba; geregistreerd voor adolescenten). Vaccinatie tegen serogroep B is niet opgenomen in het huidige RVP.
Omdat mensen met een (functionele) hyposplenie of asplenie een verhoogd risico lijken te hebben op een meningokokkeninfectie wordt geadviseerd om hen te vaccineren tegen de verschillende circulerende serogroepen en is vaccinatie tegen MenACWY en MenB geïndiceerd (zie de tabellen hierboven).
Voor kinderen, adolescenten en jongvolwassenen (tot 24 jaar) met asplenie wordt geadviseerd om diegenen die niet eerder een MenACWY-vaccin hebben ontvangen (maar bijvoorbeeld alleen tegen MenC vanuit het RVP) alsnog een MenACWY-vaccinatie aan te bieden vanwege een verhoogde incidentie op een meningokokkeninfecte in deze leeftijdsgroep. Tevens wordt geadviseerd om hen een eenmalige revaccinatie tegen Men ACWY aan te bieden, 3-5 jaar na de primaire vaccinatie.
Aan volwassenen (> 24 jaar) wordt na splenectomie eenmalig een MenACWY-vaccinatie aangeboden. Voor diegenen die eerder vaccinatie hebben gehad met het monovalente vaccin NeisVac-C (alleen tegen serogroep C), geldt een dergelijke actieve inhaalcampagne niet. Tevens wordt bij deze leeftijdsgroep ook geen revaccinatie 3-5 jaar later geadviseerd (omdat er geen verhoogde incidentie in deze leeftijdsgroep bestaat).
NB: volwassenen die een sterk verhoogd risico hebben op het oplopen van een infectie met MenACWY, bijvoorbeeld reizigers naar endemische gebieden, kan inhaalvaccinatie, dan wel revaccinatie op maat worden aangeboden.
Haemophilus influenzae type b
Haemophilus influenzae is een gekapselde bacterie en kent verschillende typen waarvan type b (Hib) voor mensen met een (functionele) asplenie het grootste risico vormt. Vanuit het Rijksvaccinatieprogramma krijgen kinderen sinds 1993 vaccinatie tegen Hib aangeboden (Infanrix hexa, Vaxelis). Dit is een geconjugeerd vaccin en dus ook werkzaam bij jonge kinderen. Voor mensen met een (functionele) asplenie is vanwege het verhoogde risico vaccinatie tegen een Hib-infectie ook geïndiceerd (zie de tabellen hierboven).
Vanwege het extra verhoogde risico op een invasieve Hib-infectie bij kinderen onder de leeftijd van 5 jaar, en eventueel andere personen met een extra verhoogd risico op een invasieve Hib-infectie, is een eenmalige revaccinatie, 2 jaar na primaire vaccinatie geïndiceerd. De indicatie hiervoor wordt gesteld door de behandelend arts.
Influenza
Patiënten bij wie de milt is verwijderd hebben vanuit het Nationaal Programma Grieppreventie (NPG) een indicatie voor de jaarlijkse griepvaccinatie vanwege het verhoogde risico op secundaire bacteriële infecties. Daarom zouden zij jaarlijks een oproep van de huisarts moeten krijgen (ICPC code B 76) om zich te laten vaccineren. Dit geldt ook voor patiënten met een functionele asplenie, bijvoorbeeld na verschillende sikkelcelcrises. Kinderen in de leeftijd van 6 maanden tot 6 jaar die niet eerder een griepprik hebben gehad dienen 2 keer een vaccinatie met een hele dosis te krijgen met een interval van minimaal 4 weken (zie SNPG).
Timing en toediening vaccins
Gezien de functie van de milt bij antistofvorming is het belangrijk om, indien mogelijk, de vaccinaties te geven voorafgaand aan een splenectomie. Hierbij is het verstandig het vaccinatieschema minimaal 2 weken vóór splenectomie voltooid te hebben. Indien vaccinatie vóór splenectomie niet mogelijk of verstandig is, kan ook worden gevaccineerd na verwijdering van de milt. Na splenectomie wordt een interval van minimaal 2 weken geadviseerd. Onderzoek toont aan dat er ondanks miltverwijdering toch een goede antistofrespons optreedt [46-48]. Voor- en nadelen van vaccinatie voorafgaand aan of volgend op een splenectomie moeten goed worden afgewogen.
Het toedienen van geïnactiveerde vaccins bij aspleniepatiënten, zoals die opgenomen zijn in de vaccinatie-adviezen in de tabellen is veilig. De vaccins kunnen niet leiden tot vaccingerelateerde infecties omdat geïnactiveerde bestanddelen in de vaccins worden gebruikt. Als er daarnaast immuunsuppressieve medicatie wordt gebruikt, kan de immuunrespons op vaccinatie mogelijk verminderd zijn. Echter, een substantieel deel van de gevaccineerden ontwikkelt na vaccinatie toch beschermende antilichamen ondanks medicatie [49-59]. Als aannemelijk is dat de immuunsuppressieve medicatie snel na de splenectomie kan worden afgebouwd dan wel gestopt, kan het verstandig zijn de vaccinaties uit te stellen en daardoor mogelijk de immuunrespons te verbeteren. Belangrijk is dan wel dat de antibiotische profylaxe gedurende die tijd optimaal is.
Genoemde vaccinaties worden intramusculair toegediend. Ook bij mensen die anticoagulantia gebruiken (en goed zijn ingesteld na recente INR-controle) kunnen vaccins tot 1 ml gewoon intramusculair worden toegediend. Alleen bij aangeboren stollingsstoornissen zoals hemofilie en de ziekte van Von Willebrandt wordt subcutane toediening van vaccins geadviseerd (en intramusculaire toediening alleen in overleg met behandelend hematoloog) (zie LCR-protocol stollingsstoornissen).
Antibioticaprofylaxe
Aangezien vaccinatie alleen geen volledige bescherming biedt tegen infectie met gekapselde bacteriën, en vanwege replacement, met name het geval bij pneumokokkeninfecties, wordt naast vaccinatie ook antibioticaprofylaxe geadviseerd bij kinderen en bij volwassenen met een hoog risico op OPSI. Uit onderzoek blijkt dat antibiotische profylaxe van oudsher een effectieve maatregel is om OPSI te voorkomen [28]. Bovendien kan veel morbiditeit en mortaliteit worden voorkómen door vanaf het vaststellen van de asplenie of de miltextirpatie te starten met zowel antibioticaprofylaxe als vaccinatie tegen pneumokokken, Hib en meningokokken. Een nuance moet hierbij wel aangebracht worden. De onderbouwing voor antibiotische profylaxe komt uit een Amerikaanse studie uit 1986 bij kinderen met sikkelcelanemie. Dit is uit de tijd vóór geconjugeerde vaccins, in een zorgsysteem dat niet gelijk is aan het Nederlandse systeem met korte aanrijtijden van ambulances en beschikbaarheid van huisartsen en bij patiënten met een relatief hoog risico op OPSI (bijvoorbeeld kinderen met sikkelcelanemie). Het zijn op dit moment echter de spaarzaam beschikbare data waar een advies op gebaseerd moet worden. Er bestaat een risico dat pneumokokken resistentie toeneemt in Nederland bij veelvuldig gebruik van antibiotica.
In de literatuur wordt veelvuldig beschreven dat het risico op OPSI levenslang blijft bestaan maar het grootst is in de eerste 2 jaar na splenectomie. Zo lijkt de helft van de OPSIs op te treden binnen 2 jaar na splenectomie [3, 6, 9]. Verder blijkt uit de epidemiologie dat de reden van splenectomie het risico op een OPSI kan verhogen of verlagen. Splenectomie vanwege hematologische maligniteit, langdurige immuunsuppressie en het eerder hebben doorgemaakt van OPSI geven een verhoogd risico op OPSI. Splenectomie na trauma heeft een relatief lager risico op OPSI.
Bij volwassenen met een hoog risico op OPSI (bijvoorbeeld splenectomie als gevolg van een hematologische maligniteit, langdurig gebruik van immuunsuppressieve medicatie, of een eerder doorgemaakte OPSI) wordt aangeraden in ieder geval in de eerste 2 jaren na splenectomie en in individuele gevallen zelfs langer antibiotische profylaxe te gebruiken [23]. Bij volwassenen die niet direct een hoog risico op OPSI hebben kan worden overwogen in de eerste 2 jaar na splenectomie geen profylaxe te geven maar direct over te gaan op on demand- antibioticagebruik, mits on demand-gebruik adequaat is; patiënt begrijpt de risico’s, is instrueerbaar om medische hulp te zoeken bij koorts/koortsig gevoel, en is verwacht compliant. Bij volwassen patiënten die een partiële splenectomie hebben gehad kan overwogen worden helemaal geen antibiotische profylaxe voor te schrijven maar direct over te gaan op on demand-gebruik omdat er mogelijk resterende immunocompetentie van het deel in situ te verwachten is. Naast profylactische antibiotica wordt bij hen aangeraden antibiotica on demand te verstrekken. In overleg met de behandelaar kan de duur van de profylaxe altijd verlengd worden.
In Nederland is feneticilline de eerste voorkeur als profylaxe en kan gezien de beperkte resistentie goed gebruikt worden. Doseringen voor gebruik staan weergegeven in de stroomschema's. Alternatief voor feneticilline is fenoxymethylpenicilline (dosering is idem).
Bij kinderen onder de 5 jaar wordt altijd profylactische behandeling gegeven en geen on demand-gebruik. On demand-gebruik is in deze leeftijdsgroep onvoldoende betrouwbaar en vaak praktisch niet haalbaar in verband met de hoge frequentie van koorts/koortsig gevoel en/of immaturiteit van het immuunsysteem.
Bij kinderen ouder dan 5 jaar kan in principe na 2 jaar antibiotische profylaxe volgend op splenectomie worden overgegaan op on demand-gebruik, mits on demand-gebruik adequaat is (risico’s worden voldoende begrepen, kind/ouder is instrueerbaar om medische hulp te zoeken bij koorts/koortsig gevoel, en kind/ouder is verwacht compliant). Kinderen bij wie na de leeftijd van 5 jaar de diagnose functionele asplenie wordt gesteld en geen relevante comorbiditeit hebben waarvoor antibiotische profylaxe geïndiceerd is worden on demand behandeld met antibiotica. Wanneer dit niet wenselijk of praktisch niet haalbaar is of potentieel risicovol is, kan in overleg met ouders en behandelaar toch gekozen worden voor langdurigere profylaxe, evt. tot de gehele kinderleeftijd.
Antibiotica on demand
De start van OPSI is vaak aspecifiek is met veelal griepachtige verschijnselen, maar het beloop kan snel progressief zijn en binnen enkele uren uitmonden in een septische shock, multi-orgaanfalen en overlijden. Dit komt mede door de exponentiële vermeerdering van bacteriën in het bloed die niet meer weggevangen kunnen worden door de milt [6, 7, 10-12].
Vanwege het verhoogde risico op OPSI en het fulminante beloop daarvan wordt aan alle patiënten met (functionele) asplenie boven de leeftijd van 5 jaar geadviseerd om bij koorts/koortsig gevoel, direct (< 1 uur) te starten met antibiotica. Deze dienen zij dus continu op voorraad te hebben met een geldige houdbaarheidsdatum en waarvan zij de eerste gift bij zich moeten dragen (= on demand-gebruik). Ook bij gebruik van antibiotische profylaxe wordt dit geadviseerd. Bij koorts/koortsig gevoel moeten zij zich altijd bij een arts melden voor klinische beoordeling. Hoewel de start van OPSI vaak aspecifiek is met veelal griepachtige verschijnselen, is het beloop over het algemeen snel progressief en kan binnen enkele uren uitmonden in een septische shock, multi-orgaanfalen en overlijden.
Honden- en/of kattenbeten
Een infectie na een dierenbeet door een hond of kat kan veroorzaakt worden door de gemengde aerobe en anaerobe flora op de huid van de gebetene en in de bek van de kat of hond [60]. In het bijzonder spelen stafylokokken, streptokokken, Pasteurella en Capnocytophaga een rol. Bij mensen met (functionele) asplenie is het laatste micro-organisme belangrijk.
Capnocytophaga canimorsus is een micro-organisme dat in de orofarynx van honden (16-25%) en katten (18%) wordt aangetroffen [60, 61]. Een infectie ontstaat 2-3 dagen na besmetting. De klinische presentatie is heterogeen, maar soms verloopt een infectie fulminant. Bij asplenie is de mortaliteit van bacteriëmie hoog (25%) [62, 63]. Het is sterk aan te raden om mensen met (functionele) asplenie altijd profylactisch gedurende één week antibiotica voor te schrijven na een honden- of kattenbeet om deze ernstige infecties te voorkomen. Patiënten moeten hier goed over worden voorgelicht.
Maatregelen bij reizen
Vooral voor mensen met (functionele) asplenie die op reis willen is het verstandig om ruim voor vertrek deskundig reisadvies in te winnen. Op dat moment kan bepaald worden of de vaccinatiestatus adequaat is en welke antibiotica profylactisch en/of therapeutisch kunnen worden gebruikt. Speciale aandacht verdient malariaprofylaxe, bescherming tegen babesiosis (zie hoofdstuk 2), vooral in de endemische gebieden in de USA, en infectiepreventie van honden- en kattenbeten (zie boven). Al deze infecties kunnen bij (functionele) asplenie veel heftiger verlopen dan bij gezonde personen [64].
Werkgerelateerde aspecten
Bedrijfsartsen dienen alert te zijn op werknemers die een aandoening hebben of een behandeling ondergaan die geassocieerd is met hyposplenie of asplenie. In geval van arbeidsomstandigheden met een verhoogd risico op ernstige infecties moeten deze werknemers hierover worden voorgelicht. Een preventief consult bij de bedrijfsarts moet plaatsvinden om te bezien of er inderdaad een verhoogd risico speelt. Mede aan de hand van de Risico-inventarisatie en -evaluatie) dient de bedrijfsarts de noodzaak tot PMO (periodiek medisch onderzoek) en indicatie voor vaccinatie (vooral pneumokokken- en influenzavaccinatie) af te wegen; dit in afstemming met de behandelend arts en/of internist-infectioloog. Daarnaast moet de werknemer toegang hebben tot medische zorg in geval van onbeschermde blootstelling en dient aan personen die beroepsmatig reizen een medisch paspoort te worden meegegeven.
Een mogelijk risico is aanwezig binnen branches of beroepen met:
- verhoogde blootstelling aan kapselvormende bacteriën: kinderopvang, basisscholen, gezondheids- en ouderenzorg;
- beroepsmatig risico op honden- of kattenbeten: veterinaire sector, dierenverzorgers;
- beroepsmatig reizen naar malariagebieden of naar bosrijke gebieden in het oosten van de Verenigde Staten van Amerika in verband met babesiosis: zakenreizigers, expats.
Medewerkers met een functionele (hypo- en) asplenie die op reis gaan naar een endemisch land worden geadviseerd advies in te winnen bij een gecertificeerde LCR reizigersspecialist.
6. Bekendheid en naleving van de advisering
Voorlichting over de risico’s van asplenie is belangrijk om OPSI te voorkomen. El-Alfi et al. hebben aangetoond dat bij goed voorgelichte patiënten OPSI statistisch significant minder vaak voorkwam (1,4% tegen 16,5%, p < 0,001) [23]. Het geven van deze voorlichting is een taak van alle behandelende specialisten en de huisarts. Het dragen van een SOS-plaatje of Medical Alert, een medisch paspoort en vaccinatiebewijs is belangrijk voor een adequate behandeling, bijvoorbeeld bij reizen.
7. Literatuur
- Melles, D.C. and S. de Marie, Prevention of infections in hyposplenic and asplenic patients: an update. Neth J Med, 2004. 62(2): p. 45-52.
- Rice, H.E., et al., Clinical and hematologic benefits of partial splenectomy for congenital hemolytic anemias in children. Ann Surg, 2003. 237(2): p. 281-8.
- Lammers, A.J., et al., Management of post-splenectomy patients in the Netherlands. Eur J Clin Microbiol Infect Dis, 2010. 29(4): p. 399-405.Schimmer, J., van der Steeg, A. & Zuidema, W. TIJD. TRAUMATOLOGIE (2012) 20: 74. https://doi.org/10.1007/s12506-012-0013-3
- Waghorn, D.J., Overwhelming infection in asplenic patients: current best practice preventive measures are not being followed. J Clin Pathol, 2001. 54(3): p. 214-8.
- Bisharat, N., et al., Risk of infection and death among post-splenectomy patients. J Infect, 2001. 43(3): p. 182-6.
- Ram, S., L.A. Lewis, and P.A. Rice, Infections of people with complement deficiencies and patients who have undergone splenectomy. Clin Microbiol Rev, 2010. 23(4): p. 740-80.
- Lynch, A.M. and R. Kapila, Overwhelming postsplenectomy infection. Infect Dis Clin North Am, 1996. 10(4): p. 693-707.
- Holdsworth, R.J., A.D. Irving, and A. Cuschieri, Postsplenectomy sepsis and its mortality rate: actual versus perceived risks. Br J Surg, 1991. 78(9): p. 1031-8.
- Kyaw, M.H., et al., Evaluation of severe infection and survival after splenectomy. Am J Med, 2006. 119(3): p. 276 e1-7.
- Styrt, B., Infection associated with asplenia: risks, mechanisms, and prevention. Am J Med, 1990. 88(5N): p. 33N-42N.
- Okabayashi, T. and K. Hanazaki, Overwhelming postsplenectomy infection syndrome in adults - a clinically preventable disease. World J Gastroenterol, 2008. 14(2): p. 176-9.
- Cullingford, G.L., et al., Severe late postsplenectomy infection. Br J Surg, 1991. 78(6): p. 716-21.
- Bronte, V. and M.J. Pittet, The spleen in local and systemic regulation of immunity. Immunity, 2013. 39(5): p. 806-18.
- Aichele, P., et al., Macrophages of the splenic marginal zone are essential for trapping of blood-borne particulate antigen but dispensable for induction of specific T cell responses. J Immunol, 2003. 171(3): p. 1148-55.
- de Porto, A.P., et al., Assessment of splenic function. Eur J Clin Microbiol Infect Dis, 2010. 29(12): p. 1465-73.
- Altamura, M., et al., Splenectomy and sepsis: the role of the spleen in the immune-mediated bacterial clearance. Immunopharmacol Immunotoxicol, 2001. 23(2): p. 153-61.
- Bach, O., et al., Falciparum malaria after splenectomy: a prospective controlled study of 33 previously splenectomized Malawian adults. Trans R Soc Trop Med Hyg, 2005. 99(11): p. 861-7.
- Toovey, S. and A. Jamieson, Pretravel health advice for asplenic individuals. J Travel Med, 2003. 10(6): p. 362; author reply 362-3.
- Chotivanich, K., et al., Central role of the spleen in malaria parasite clearance. J Infect Dis, 2002. 185(10): p. 1538-41.
- Gorenflot, A., et al., Human babesiosis. Ann Trop Med Parasitol, 1998. 92(4): p. 489-501.
- Kleijnen-Grebien, B., et al., [Fatal case of sepsis with Capnocytophaga canimorsus after a minor dog bite]. Ned Tijdschr Geneeskd, 2008. 152(34): p. 1882-5.
- Feige, K., P. Hartmann, and J.T. Lutz, [Fulminant sepsis after Capnocytophaga canimorsus infection]. Anaesthesist, 2017.
- Pasternack, M.S., Weller, P. F., & Thorner, A. R. , Prevention of sepsis in the asplenic patient. UpToDate, 2017.
- William, B.M., et al., Hyposplenism: a comprehensive review. Part II: clinical manifestations, diagnosis, and management. Hematology, 2007. 12(2): p. 89-98.
- Peters, M., et al., [Sickle cell disease in heel injection screening. I]. Ned Tijdschr Geneeskd, 2009. 153(18): p. 854-7.
- Bauer, M.P., E.W. Marijt, and F.P. Kroon, cART (combinatie antiretrovirale therapie) reverses hyposplenism in HIV-1 infection. J Acquir Immune Defic Syndr, 2014. 65(2): p. e88-90.
- Dissel van JT, K.F., Voorkómen van levensbedreigende infecties bij personen zonder (functionele) milt. Ned Tijdschr Hemat, 2004. 3: p. 91-7.
- Sinwar, P.D., Overwhelming post splenectomy infection syndrome - review study. Int J Surg, 2014. 12(12): p. 1314-6.
- Owusu-Ofori, S. and T. Remmington, Splenectomy versus conservative management for acute sequestration crises in people with sickle cell disease. Cochrane Database Syst Rev, 2017. 11: p. CD003425.
- Battersby, A.J., H.H. Knox-Macaulay, and E.D. Carrol, Susceptibility to invasive bacterial infections in children with sickle cell disease. Pediatr Blood Cancer, 2010. 55(3): p. 401-6.
- Van-Dunem, J.C., et al., Factors associated with sickle cell disease mortality among hospitalized Angolan children and adolescents. West Afr J Med, 2007. 26(4): p. 269-73.
- Daniels, C.C., P.D. Rogers, and C.M. Shelton, A Review of Pneumococcal Vaccines: Current Polysaccharide Vaccine Recommendations and Future Protein Antigens. J Pediatr Pharmacol Ther, 2016. 21(1): p. 27-35.
- Harboe, Z.B., et al., Temporal trends in invasive pneumococcal disease and pneumococcal serotypes over 7 decades. Clin Infect Dis, 2010. 50(3): p. 329-37.
- Abraham-Van Parijs, B., Review of pneumococcal conjugate vaccine in adults: implications on clinical development. Vaccine, 2004. 22(11-12): p. 1362-71.
- Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among children aged 6-18 years with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR (Morbidity and Mortality Weekly Report) Morb Mortal Wkly Rep, 2013. 62(25): p. 521-4.
- Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep, 2012. 61(40): p. 816-9.
- Horan, M. and J.H. Colebatch, Relation between splenectomy and subsequent infection. A clinical study. Arch Dis Child, 1962. 37: p. 398-414.
- Butler, J.C., et al., Pneumococcal polysaccharide vaccine efficacy. An evaluation of current recommendations. JAMA, 1993. 270(15): p. 1826-31.
- Papadatou, I., et al., Long-lasting hyporesponsivenss induced by the 23-valent pneumococcal polysaccharide vaccine (PPV23) in asplenic patients with beta-thalassemia major. Vaccine, 2015. 33(32): p. 3779-83.
- Papadatou, I., et al., Antigen-specific B-cell response to 13-valent pneumococcal conjugate vaccine in asplenic individuals with beta-thalassemia previously immunized with 23-valent pneumococcal polysaccharide vaccine. Clin Infect Dis, 2014. 59(6): p. 862-5.
- Poolman, J. and R. Borrow, Hyporesponsiveness and its clinical implications after vaccination with polysaccharide or glycoconjugate vaccines. Expert Rev Vaccines, 2011. 10(3): p. 307-22.
- O'Brien, K.L., M. Hochman, and D. Goldblatt, Combined schedules of pneumococcal conjugate and polysaccharide vaccines: is hyporesponsiveness an issue? Lancet Infect Dis, 2007. 7(9): p. 597-606.
- Musher, D.M., et al., Safety and antibody response, including antibody persistence for 5 years, after primary vaccination or revaccination with pneumococcal polysaccharide vaccine in middle-aged and older adults. J Infect Dis, 2010. 201(4): p. 516-24.
- Musher, D.M., et al., Antibody persistence ten years after first and second doses of 23-valent pneumococcal polysaccharide vaccine, and immunogenicity and safety of second and third doses in older adults. Hum Vaccin, 2011. 7(9): p. 919-28.
- Papadatou, I. and V. Spoulou, Pneumococcal Vaccination in High-Risk Individuals: Are We Doing It Right? Clin Vaccine Immunol, 2016. 23(5): p. 388-95.
- Howdieshell, T.R., et al., Surgical infection society guidelines for vaccination after traumatic injury. Surg Infect (Larchmt), 2006. 7(3): p. 275-303.
- Shatz, D.V., et al., Antibody responses in postsplenectomy trauma patients receiving the 23-valent pneumococcal polysaccharide vaccine at 14 versus 28 days postoperatively. J Trauma, 2002. 53(6): p. 1037-42.
- Shatz, D.V., et al., Immune responses of splenectomized trauma patients to the 23-valent pneumococcal polysaccharide vaccine at 1 versus 7 versus 14 days after splenectomy. J Trauma, 1998. 44(5): p. 760-5; discussion 765-6.
- de Roux, A., et al., Immunogenity of the pneumococcal polysaccharide vaccine in COPD patients. The effect of systemic steroids. Respir Med, 2004. 98(12): p. 1187-94.
- Kapetanovic, M.C., et al., Heptavalent pneumococcal conjugate vaccine elicits similar antibody response as standard 23-valent polysaccharide vaccine in adult patients with RA treated with immunomodulating drugs. Clin Rheumatol, 2011. 30(12): p. 1555-61.
- Kapetanovic, M.C., et al., Antibody response is reduced following vaccination with 7-valent conjugate pneumococcal vaccine in adult methotrexate-treated patients with established arthritis, but not those treated with tumor necrosis factor inhibitors. Arthritis Rheum, 2011. 63(12): p. 3723-32.
- Gelinck, L.B., et al., Synergistic immunosuppressive effect of anti-TNF combined with methotrexate on antibody responses to the 23 valent pneumococcal polysaccharide vaccine. Vaccine, 2008. 26(27-28): p. 3528-33.
- Mori, S., et al., Pneumococcal polysaccharide vaccination in rheumatoid arthritis patients receiving tocilizumab therapy. Ann Rheum Dis, 2013. 72(8): p. 1362-6.
- Migita, K., et al., Effect of abatacept on the immunogenicity of 23-valent pneumococcal polysaccharide vaccination (PPSV23) in rheumatoid arthritis patients. Arthritis Res Ther, 2015. 17: p. 357.
- Broyde, A., et al., Longterm Efficacy of an Antipneumococcal Polysaccharide Vaccine among Patients with Autoimmune Inflammatory Rheumatic Diseases. J Rheumatol, 2016. 43(2): p. 267-72.
- Meerveld-Eggink, A., et al., Impaired antibody response to conjugated meningococcal serogroup C vaccine in asplenic patients. Eur J Clin Microbiol Infect Dis, 2011. 30(5): p. 611-8.
- Fiorino, G., et al., Effects of immunosuppression on immune response to pneumococcal vaccine in inflammatory bowel disease: a prospective study. Inflamm Bowel Dis, 2012. 18(6): p. 1042-7.
- Farmaki, E., et al., The effect of anti-TNF treatment on the immunogenicity and safety of the 7-valent conjugate pneumococcal vaccine in children with juvenile idiopathic arthritis. Vaccine, 2010. 28(31): p. 5109-13.
- Crnkic Kapetanovic, M., et al., Rituximab and abatacept but not tocilizumab impair antibody response to pneumococcal conjugate vaccine in patients with rheumatoid arthritis. Arthritis Res Ther, 2013. 15(5): p. R171.
- Talan, D.A., et al., Bacteriologic analysis of infected dog and cat bites. Emergency Medicine Animal Bite Infection Study Group. N Engl J Med, 1999. 340(2): p. 85-92.
- Deshmukh, P.M., et al., Capnocytophaga canimorsus sepsis with purpura fulminans and symmetrical gangrene following a dog bite in a shelter employee. Am J Med Sci, 2004. 327(6): p. 369-72.
- Pers, C., B. Gahrn-Hansen, and W. Frederiksen, Capnocytophaga canimorsus septicemia in Denmark, 1982-1995: review of 39 cases. Clin Infect Dis, 1996. 23(1): p. 71-5.
- Kullberg, B.J., et al., Purpura fulminans and symmetrical peripheral gangrene caused by Capnocytophaga canimorsus (formerly DF-2) septicemia--a complication of dog bite. Medicine (Baltimore), 1991. 70(5): p. 287-92.
- Watson, D.A., Pretravel health advice for asplenic individuals. J Travel Med, 2003. 10(2): p. 117-21.