Scabiës Richtlijn
Samenvatting
Verwekker: Scabiësmijt (Sarcoptes scabiei).
Besmettingsweg: Langdurig (15 minuten of langer) of frequent direct huid-huidcontact, gezamenlijk gebruik van bed, kleding, etc. Bij scabiës crustosa kan besmetting via in de lucht aanwezige huidschilfers verlopen.
Incubatietijd: 2-6 weken. Korter bij herinfectie (1-4 dagen). Langer bij immuungecompromitteerde personen (tot 10 weken).
Besmettelijke periode: Vanaf het moment dat er mijten op de huid zitten (1-2 weken na besmetting), tot 12 uur na start eerste behandeling incl. hygiënevoorschriften. Een tweede behandeling is noodzakelijk voor effectieve behandeling.
Maatregelen: Gelijktijdige behandeling van nauwe contacten en hygiënevoorschriften. Voor scabiës crustosa gelden additionele maatregelen.
Symptomen: Jeuk, blaasjes, rode bultjes, krabeffecten en ‘gangetjes’ op voorkeurslocaties.
Doel en doelgroep
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. De richtlijn beschrijft duidelijke adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. De zorgprofessional kan de richtlijn ook gebruiken voor het bijhouden en vergaren van kennis. De uitvoering van de richtlijn overstijgt institutionele en professionele domeingrenzen en is bedoeld voor het gebruik binnen diverse sectoren van de gezondheidszorg. Voor meer informatie zie Totstandkoming LCI-richtlijnen.
Versiebeheer
Vaststelling LOI: 23 januari 2024.
Wijzigingen:
- De overleving van scabiës in de omgeving en buiten het lichaam is duidelijker en uitgebreider omschreven.
- Er is een paragraaf ‘psychosociale impact van scabiës’ toegevoegd.
- De mogelijkheid om een NAAT-test in te zetten als diagnostisch middel is toegevoegd bij de diagnostiekparagraaf.
- Scabiës crustosa en gewone scabiës zijn in de gehele richtlijn beter uit elkaar gehouden.
- De paragraaf ‘maatregelen ten aanzien van patiënt en contacten’ is vereenvoudigd en er is een extra stroomschema toegevoegd.
- De zeven bijlagen in de huidige versie zijn teruggebracht tot twee bijlagen. Twee bijlagen zijn gearchiveerd in verband met hun gedateerdheid:
- Coördinatiekaart scabiës in de extramurale setting: deze was gedateerd en er zijn geen aanwijzingen dat deze gebruikt werd;
- Aanpak scabiës in huishoudens: hier stond dezelfde informatie in als in de stappenplannen ivermectine/permetrine (die van betere kwaliteit zijn).
- De overige bijlagen zijn zoveel mogelijk samengevoegd of opgenomen in de richtlijn zelf (zoals de bijlage ‘behandelgroepen’).
- De bijlage ‘aanpak scabiës in de extramurale setting’ is geüpdatet, maar niet noemenswaardig gewijzigd.
- De bijlage ‘behandeling en hygiënevoorschriften’ is gewijzigd op de volgende punten:
- Hoe dik er gesmeerd moet worden met permetrine is toegevoegd;
- Handelingswijze bij het geven van borstvoeding en het smeren van crème/zalf (permetrine of benzylbenzoaat) is herzien door experts en gewijzigd;
- De doseringen en de kosten van de scabicide geneesmiddelen zijn gewijzigd en aangepast;
- Handelingswijze bij (vermoeden van) Loa loa en de behandeling van ivermectine is beschreven.
Ziekte & Besmettelijkheid
Verwekker
Scabiës bij mensen wordt veroorzaakt door de schurftmijt Sarcoptes scabiei var hominis, behorende tot de spinachtigen. Deze mijt heeft een ovaal, wit lichaam met een platte onder- en bovenkant en 8 poten. De rug heeft borstels en stekels die helpen bij het graven van een gangetje in de opperhuid van de mens. Het vrouwtje is ongeveer 0,4 mm bij 0,3 mm groot. Het mannetje is kleiner: 0,2 bij 0,15 mm. Het gangetje wordt door het volwassen vrouwtje gegraven en bevindt zich tussen het stratum corneum (hoornlaag) en stratum granulosum (korrellaag) van de huid. Ze graaft met behulp van een uitgescheiden stof dat lysis (oplossing van celmateriaal) van de oppervlakkige cellen veroorzaakt. Het product daarvan vormt haar voedsel, alsmede de lymfevloeistof van de gastheer dat in het gangentje loopt. Ze graaft 0,5 tot 5 mm per dag en een gangetje wordt maximaal 15 mm lang. In het gangetje vindt copulatie plaats, waarna het mannetje sterft. Gedurende de rest van haar 4 tot 6 weken durende leven legt zij 2 à 4 eitjes per dag (in totaal 40 tot 60 eitjes). Na 2 tot 7 dagen kruipt er een zespotige larve uit het ei die naar het huidoppervlak gaat en op de huid leeft. De larve maakt kleine gaatjes in haarfollikels of huidplooien om zich te voeden of te vervellen, waarna het overgaat in de achtpotige nymfefase. Na enkele vervellingen ontwikkelt het mannetje zich in ongeveer 9 à 10 dagen en het vrouwtje in 12 à 15 dagen tot een geslachtsrijpe mijt. De mijten lopen in alle ontwikkelstadia over het menselijk lichaam, behalve het vrouwtje in het legstadium; de loopsnelheid is ongeveer 1,2 tot 1,5 meter per uur (Hafner 2009).
Pathogenese
Naast het ontstaan van de huidlaesies (huidbeschadigingen) door de gangetjes van de mijt zijn de belangrijkste symptomen jeuk en een ontstekingsreactie in de huid. Deze ontstaan door de immuunreactie van de patiënt, die een vertraagd type-IV-overgevoeligheidsreactie krijgt op de mijten (door substanties op het oppervlak van de mijt) en hun excreta (het secreet, de uitwerpselen, de eitjes). Deze reactie ontstaat meestal 2 tot 6 weken na besmetting.
Incubatieperiode
De periode tussen het tot stand komen van een besmetting en het ontstaan van de eerste ziekteverschijnselen bij gewone scabiës bedraagt meestal 2 tot 6 weken. Bij een verminderde overgevoeligheidsreactie en verminderde immuunrespons kan het ontwikkelen van klachten maanden duren (Bouvresse 2010). In instellingen voor langdurige zorg wordt schurft regelmatig pas laat herkend als niet de bewoners, maar de medewerkers klachten krijgen. Mogelijk wordt dit veroorzaakt door een verminderde afweerreactie onder de bewoners en waardoor bij hen geen of minimaal typische klachten ontstaan. Gangbaar is om uit te gaan van een incubatietijd van maximaal 10 weken voor mensen die immuungecompromitteerd zijn en voor cliënten in zorginstellingen. Er kan sprake zijn van atypische klachten en/of huidafwijkingen.
Bij een herbesmetting kan de jeuk al na 1 tot 4 dagen ontstaan, nog voordat er gangetjes zichtbaar zijn, omdat de overgevoeligheid dan al bestaat (Bouvresse 2010, Currie 2010, Chosidow 2006, Hengge 2006).
Veterinair
Incubatieperiode bij dieren
Bij honden duurt het afhankelijk van het aantal mijten en de contactduur 10 dagen tot enkele weken tot er klinische verschijnselen optreden.
Ziekteverschijnselen
Er is sprake van een gegeneraliseerde en uitgesproken jeuk, die meer aanwezig kan zijn op plaatsen waar de mijt zich bevindt. In de beginfase neemt de jeuk geleidelijk toe. De jeuk is meestal ’s avonds/’s nachts in bed en bij een warme omgeving het hevigst. (Ex-)huis- of bedgenoten kunnen dezelfde klachten hebben. Het klinisch beeld wisselt sterk en vaak zijn de graafgangetjes, door onder meer krabben, niet (meer) te herkennen. In de praktijk kan het daardoor soms lang duren voor de diagnose gesteld wordt.
Gewone scabiës
Kenmerkend zijn de gangetjes die de mijt graaft op voorkeursplaatsen: tussen de vingers, zijkanten en plooien van de handpalm, buigzijde van de pols, strekzijde van de ellebogen, de mediale voetrand, enkel en wreef. De gangetjes zien eruit als smalle, gekronkelde, iets verheven bruine laesies. Aan het begin ervan kan de huid wat schilferen (‘wake sign’) en aan de andere kant, waar de mijt zich bevindt, kan een papeltje of blaasje zichtbaar zijn. Door een dermatoscoop kan de kop van de mijt als een zwart driehoekje herkend worden (‘delta sign’) (Bousema 2013). Bij gezonde personen zijn gangetjes soms moeilijk te vinden, omdat ze kapot gekrabd zijn. Ook op andere plekken kan scabiës voorkomen, maar dan meer als huidafwijking met roodheid en papels, zoals in de voorste okselplooi, rond de tepels (van de vrouw), billen, dijen en de (mannelijke) genitalia (Dupuy 2007). Soms kan er sprake zijn van nodulaire scabiës. Hierbij ontstaan noduli tot wel 2 cm groot die bruin-rood van aspect zijn en maanden na behandeling kunnen persisteren. In of rond deze nodi kan soms een scabiësmijt aangetroffen worden (Dupuy, 2007). Naast de gangetjes, papels en nodi als direct gevolg van de infestatie is er vaak een eczemateus huidbeeld verspreid op het lichaam aanwezig. Dit ten gevolge van een allergische (type IV-)immuunrespons op Sarcoptes scabiei-antigenen (Walton 2010).
Scabiës crustosa (norvegica)
Deze vorm van scabiës is voor het eerst beschreven in Noorwegen door Danielson en Böck in 1848, vandaar ook wel de naam ‘norvegica’ (Chosidow 2006, Hengge 2006). Net als de gewone scabiës wordt scabiës crustosa veroorzaakt door Sarcoptes scabiei. Deze vorm van scabiës is veel besmettelijker door de grote hoeveelheid mijten en eitjes in de huidschilfers van geïnfecteerde personen. Bij een ‘gewone’ scabiës zijn er in het algemeen 5 tot 10 mijten op het huidoppervlak aanwezig (door wassen en krabben vermindert het aantal mijten), bij scabiës crustosa kan dit oplopen tot 4700 mijten per gram huidschilfers (Koene 2006). Scabiës crustosa wordt gekenmerkt door huidafwijkingen met een sterk verdikte witte of geelbruine hoornlaag (hyperkeratose), daarom ook wel de naam ‘crustosa’. Daarnaast zijn er papels en noduli, vooral op de extremiteiten. Deze vorm van scabiës komt voornamelijk voor bij bepaalde groepen, zoals immuungecompromitteerden; personen die immunosuppressiva gebruiken; patiënten met neuropathie, paresen of bewegingsbeperkingen; alsmede personen die om welke reden dan ook niet (kunnen) krabben door bijvoorbeeld een fysieke of geestelijke beperking. Doordat bij deze personen het immuunsysteem de scabiësmijten onvoldoende kan attaqueren, hebben de mijten de mogelijkheid om zich veelvuldig voort te planten.
Tussenvormen van scabiës
Tussen gewone scabiës en scabiës crustosa zijn tussenvormen mogelijk met honderden tot duizenden mijten, waarbij de hoeveelheid mijten en dus de mate van overdraagbaarheid richtinggevend is voor de noodzakelijke behandeling. De behandelend arts dient aan de hand van de ernst van de besmetting de behandeling te bepalen. Soms zijn er geen korstvormige afwijkingen maar juist opvallend weinig huidafwijkingen. Het klinische beeld blijft soms beperkt tot een wat droge, schilferige huid. Soms is er sprake van een eczemateuze aandoening of erytrodermie. Bij langdurig gebruik van corticosteroïdzalven kan het beeld nog meer atypisch worden (‘scabiës incognito’). De anders zo uitgesproken jeuk kan verminderd of zelfs afwezig zijn. Deze vorm heeft dezelfde mate van overdraagbaarheid als scabiës crustosa en moet als zodanig behandeld worden.
Scabiës bij kinderen
Bij kinderen onder de 2 jaar is het klinisch beeld anders dan bij volwassenen. De typische kenmerken ontbreken en gangetjes zijn vaak afwezig. Wel worden er vaker puistjes en blaasjes gezien op de handpalmen en voetzolen. Daarnaast treedt er vaker eczematisatie op met secundaire infecties. Een ander belangrijk verschil is de betrokkenheid van hoofd en nek, wat bij volwassenen niet vaak voorkomt (Karthikeyan 2007).
Immuungecompromitteerde personen, personen met een verstandelijke beperking en kwetsbare ouderen
Bij immuungecompromitteerde personen, personen met een verstandelijke beperking en kwetsbare ouderen is er vaker sprake van een atypisch beloop (Tjioe 2008). Het beeld kan gecompliceerd worden door reeds bestaande huidafwijkingen. Het hoofd kan aangedaan zijn, evenals de handpalmen en de voetzolen (Johnston 2005). Hiermee dient bij de behandeling rekening te worden gehouden (hoofdhuid, wenkbrauwen, gezicht, nek en oren meebehandelen). Bij personen die bedlegerig zijn kan juist de rug aangedaan zijn. Bij nodulaire scabiës kunnen er grote verharde ontstoken noduli ontstaan. Deze zitten vooral in de okselplooi, liezen en op de billen en kunnen soms zeer hevig jeuken tot wel maanden na succesvolle behandeling.
Differentiaaldiagnose scabiës
Differentiaal diagnostisch kan er gedacht worden aan erythematosquameuze aandoeningen (bijvoorbeeld eczeem, psoriasis), allergische huidreacties en overige jeukende huidaandoeningen. Mensen met atopie (overgevoeligheid) en eczeem reageren vaak op scabiës met een verergering van het eczeem, wat de diagnose scabiës kan bemoeilijken. Na afdoende behandeling van scabiës kunnen de jeukklachten nog langere tijd (langer dan bij personen zonder deze atopie en eczeem) blijven bestaan, wat de diagnostiek van een recidief kan bemoeilijken (Hengge 2006).
Complicaties
Een mogelijke complicatie door krabben is een bacteriële infectie met (vooral) Staphylococcus aureus en/of Streptococcus pyogenes (pyodermie). Ook furunculose en cellulitis komen voor. Een bijzondere complicatie van scabiës crustosa is massale aanwezigheid van de mijt in de nagelplaat, waardoor nageldystrofie kan ontstaan (Goyal 2008). Tevens is scabiës een risicofactor voor het ontwikkelen van acute poststreptokokken-glomerulonefritis en geassocieerd met hogere aantallen reumatische koorts en reumatische hartziekte (Heukelbach 2006, Mounsey 2008).
De psychosociale impact van scabiës
Scabiës heeft naast fysieke symptomen zoals intense jeuk, huiduitslag en ontstekingen, ook een aanzienlijke psychosociale impact op patiënten. De aanhoudende jeuk en het ongemak kunnen leiden tot ernstige slaapstoornissen, angst en depressie. Bovendien dragen sociale stigma's en misvattingen over de ziekte bij aan gevoelens van isolatie en schaamte bij getroffen personen, wat hun algehele kwaliteit van leven verder kan verminderen.
Onderzoek heeft aangetoond dat patiënten met scabiës een significant lagere kwaliteit van leven rapporteren in vergelijking met de algemene bevolking, voornamelijk als gevolg van de psychosociale gevolgen van de ziekte (Ariza 2018). Een andere studie benadrukte het verband tussen de duur van scabiës-symptomen en de ernst van psychische aandoeningen zoals angst en depressie (Smith 2019). Angst voor herbesmetting na een episode van scabiës is een veelvoorkomend en relevant psychosociaal aspect bij patiënten. Na een succesvolle behandeling en het verdwijnen van de symptomen, ervaren veel patiënten angst en zorgen over het opnieuw oplopen van de besmetting. Deze bezorgdheid kan leiden tot verhoogde stressniveaus en aanhoudende psychologische belasting bij de patiënt, wat hun kwaliteit van leven beïnvloedt.
Na een succesvolle behandeling kunnen sommige patiënten blijven klagen over jeuk, wat te wijten kan zijn aan een aanhoudende immuunrespons van het lichaam. Dit staat bekend als postscabiësjeuk. Het is van groot belang om patiënten hierover goed te informeren.
In zeldzame gevallen kan een eerdere scabiësbesmetting een infestatiewaan veroorzaken, een psychiatrische aandoening die valt onder de DSM-5-classificatie van een waanstoornis van het somatische type, met een primaire en secundaire variant (Kemperman 2023). De secundaire variant kan het gevolg zijn van andere psychiatrische aandoeningen, medicatiegebruik of middelengebruik, waarbij vooral het gebruik van amfetamines en cocaïne een infestatiewaan kan uitlokken. Bij de behandeling van scabiës is het belangrijk om rekening te houden met bovengenoemde psychosociale aspecten om de negatieve gevolgen voor het welzijn van de patiënten te verminderen.
Veterinair
Ziekteverschijnselen bij dieren
Scabiës wordt veroorzaakt door de Sarcoptes scabiei (schurftmijt). Er is verregaande gastheerspecificiteit, wat inhoudt dat een bepaalde mijt slechts op één diersoort langdurig kan overleven. Wanneer de diermijten per ongeluk op de mens terechtkomen kunnen zij geen gangetjes graven, maar wel kortdurend en zelflimiterend klinische verschijnselen zoals jeuk geven. Bij dieren staan heftige jeuk en huidveranderingen ook op de voorgrond. Sommige dieren zijn of worden symptoomloos drager. Dit kan incidenteel voorkomen bij honden, varkens en cavia's.
Natuurlijke immuniteit
Een immuunrespons vanuit de gastheer komt vermoedelijk relatief laat na infectie op gang (4 tot 6 weken na infectie met de scabiësmijt). Gezien de lange co-evolutie tussen de gastheer en de scabiësmijt, is het aannemelijk dat de mijten het immuunsysteem van de gastheer kunnen moduleren, waardoor symptomen zich met een vertraging (‘delayed onset’) presenteren (Bhat 2017, Sunderkötter 2021). De huidafwijkingen en de jeuk die geassocieerd zijn met scabiës, zijn zowel type I (direct), als type IV (vertraagd of ‘delayed’) hypersensitiviteitsreacties (Bhat 2017, Sunderkötter 2021). Er vormt zich bij gewone scabiës een evenwicht tussen het afweersysteem en het aantal mijten (Hafner 2009). Bij scabiës crustosa is dit evenwicht uit balans (Hafner 2009, Hengge 2006). Er wordt onvoldoende immuniteit gevormd om een herinfectie te voorkomen.
Veterinair
Natuurlijke immuniteit bij dieren
Bij de meeste dieren wordt enige immuniteit opgebouwd, zodat het aantal mijten beperkt blijft. Dit kan verschillen per dier en per periode.
Reservoir
Er zijn meer dan 15 verschillende varianten van Sarcoptes beschreven bij meer dan 100 verschillende soorten zoog- en buideldieren (o.a. bij honden, vee, varkens, geiten en schapen). Er is verregaande gastheerspecificiteit, wat inhoudt dat een bepaalde mijt slechts op één diersoort langdurig kan overleven. De scabiës die bij dieren voorkomt heeft een ander genotype dan die bij de mens. De mens is de belangrijkste gastheer voor de humane scabiësmijt (Sarcoptes scabiei, var. hominis).
Besmettingsweg
- Bij gewone scabiës lopen de mijten over bij langdurig (naar wordt aangenomen, circa 15 minuten) of frequent direct huid-huidcontact (zoals borstvoeding geven, knuffelen, seksueel contact hebben of lichamelijke verzorging verlenen). Handen schudden, kort knuffelen en medische onderzoeken zijn waarschijnlijk onvoldoende om transmissie van de scabiësmijt te veroorzaken. Bij intensief gebruik van elkaars kleding, handdoeken en beddengoed kan de scabiësmijt ook via deze weg worden overgedragen.
- De transmissie verloopt via in de lucht aanwezige huidschilfers bij scabiës crustosa (zelfs na een korte ontmoeting zonder huid-huidcontact), via huidschilfers met mijten die op de huid van contacten kunnen komen. De mijten zoeken hun weg via geur en temperatuur (Walton, 2007). Bij gebruik van elkaars kleding, handdoeken en beddengoed kan de scabiësmijt ook via deze weg worden overgedragen.
Overdracht van mens op dier
Theoretisch kunnen huisdieren (met name de hond) als tijdelijke gastheer van de menselijke scabiësmijt optreden, in de praktijk komt dit niet of nauwelijks voor. Deze humane mijten kunnen maximaal 3 dagen overleven op de dierlijke huid, zij kunnen zich niet ingraven. De dieren hoeven bij scabiës niet meebehandeld te worden.
Overdracht van dier op mens
Een zoönotische infectie is zeldzaam, maar wel beschreven. Besmetting met de dierlijke scabiësmijt heeft, vergeleken met de menselijke variant, een andere klinische presentatie van de huidafwijkingen: de huidafwijking zit dan vooral op de delen die contact hebben met het dier. De aandoening bij de mens gaat vanzelf over en er is geen behandeling nodig. Deze dierlijke mijten kunnen zich niet reproduceren in de menselijke huid (Heukelbach 2006, Andrews 2009). Ze kunnen wel voorbijgaande jeuk veroorzaken. Zie ook de richtlijn Acariasis.
Veterinair
Relevante transmissieroutes bij dieren
Infestatie van de mens met dierlijke scabiës vindt plaats via direct contact met een besmet dier. Het aantal mijten op een dier is afhankelijk van de diersoort en per individu. Meestal komen er slechts weinig mijten voor en is er voor besmetting van de mens intensief en langdurig direct contact nodig. Indirecte besmetting is mogelijk vanuit de omgeving, maar mijten kunnen buiten hun gastheer slechts enkele dagen overleven. Alleen bij voor mijten gunstige omstandigheden (koel en vochtig) kunnen ze tot enkele weken in leven blijven.
Besmettelijke periode
Iemand is besmettelijk als er mijten op het huidoppervlak aanwezig zijn. Dat betekent dat iemand besmettelijk kan zijn voor anderen zodra de eerste nieuwe mijten volwassen zijn (vanaf ongeveer 1 tot 2 weken na besmetting), ook als de patiënt nog geen verschijnselen van scabiës heeft. Bij alle middelen mag 12 uur na start van de behandeling worden verwacht dat de patiënt met gewone scabiës niet meer besmettelijk is én in die periode ook de hygiënevoorschriften zijn afgerond. Bij gebruik van ivermectine zijn bij de eerste behandeling wel de scabiësmijten gedood (hierdoor is men niet meer besmettelijk), maar niet de eitjes. Hoewel de patiënt na de eerste behandeling met ivermectine (inclusief hygiënevoorschriften) niet meer besmettelijk is, kunnen deze eitjes in de dagen na de eerste behandeling uitkomen (dit duurt gemiddeld 2 tot 7 dagen, vervolgens duurt het geslachtsrijp worden van een mannetje 9 tot 10 dagen en van een vrouwtje 12 tot 15 dagen), waardoor iemand opnieuw besmettelijk kan zijn voor de omgeving (Hafner 2009). Daarom is een tweede behandeling van ivermectine 7 dagen na de eerste behandeling nodig om nieuw uitgekomen larven te doden. De tweede behandeling met permetrine is noodzakelijk voor een goede effectiviteit van de behandeling, i.v.m. mogelijk (onbedoeld) overgeslagen plekken bij het smeren tijdens de eerste behandeling.
Voor de patiënten met scabiës crustosa geldt dat meerdere behandelingen nodig zijn voordat de patiënt niet meer besmettelijk is. Bij scabiës crustosa is controle 4 à 6 weken na behandeling door een deskundig arts nodig om genezing vast te stellen; tot die tijd is de patiënt nog besmettelijk en moeten de maatregelen gehandhaafd blijven.
Veterinair
Besmettelijke periode bij dieren
Dieren zijn continu besmettelijk. Bij cavia’s, honden en varkens kunnen in zeer zeldzame gevallen mijten latent aanwezig zijn. Zulke dieren kunnen na partus of stress wel klinische verschijnselen (jeuk) gaan vertonen.
Besmettelijkheid
Besmettelijkheid tussen personen
De transmissie van één enkele bevruchte mijt of verscheidene larven, zijn voldoende om een ander mens te infecteren na intensief huid-huidcontact. Mijten van alle stadia hebben tot 30 minuten nodig om zich in te graven in de huid, tot die tijd kan de mijt nog weg gewassen of gekrabd worden. Het ingraven in de huid gaat sneller op plekken waar de huid dun is. Larven en sommige mijten graven zich niet in, zij blijven op het huidoppervlak en zijn op deze manier makkelijker overdraagbaar naar andere personen dan ingegraven mijten. De besmettingskans is afhankelijk van het aantal mijten en larven op de huid van de index en de blootstellingsduur of -frequentie met de blootgestelde (Sunderkötter 2021).
Overleving scabiësmijt buiten het lichaam
De overleving van de scabiësmijt buiten het lichaam is afhankelijk van verschillende omgevingsfactoren;
- De scabiësmijt kan buiten het lichaam gedurende 24 tot 36 uur overleven bij kamertemperatuur en bij een relatieve luchtvochtigheid (40-80%). Bij een hoge luchtvochtigheid en een lage omgevingstemperatuur overleeft de mijt langer (Bernigaud 2020, Liu 2016).
- De scabiësmijt gaat dood na tien minuten bij minimaal 60 graden (zoals bij wassen in de wasmachine) (Bernigaud 2020).
- In het algemeen zijn de mijten ook dood na 3 dagen (72 uur) bij kamertemperatuur zonder contact met mensen. De eventueel overgebleven mijten zijn dan slecht in staat om mensen te besmetten, omdat ze door gebrek aan voedsel te verzwakt zijn om zich nog te kunnen ingraven in de huid.
- Er is nauwelijks onderzoek verricht naar de ontwikkeling van eitjes en larven buiten de gastheer. Omdat de transmissieroute van de scabiësmijt hoofdzakelijk huid-huidcontact is en de ontwikkelingscyclus van de mijten voornamelijk op de huid geschiedt, is de kans zeer klein dat eitjes en larven in de omgeving terecht komen en zich daar ontwikkelen tot infectieuze stadia. Deze kans is mogelijk wel groter bij scabiës crustosa (Bernigaud 2020, Sunderkötter 2021).
Mate van besmettelijkheid bij verschillende scabiësvormen
De besmettelijkheid loopt op naar gelang er sprake is van verschillende scabiësvormen. Gewone scabiës is het minst besmettelijk, gevolgd door tussenvormen van scabiës en scabiës crustosa (meest besmettelijk).
A. Gewone scabiës is de minst besmettelijke vorm van scabiës. Over het algemeen is 15 minuten (of frequent) huid-huidcontact nodig om een infectie te bewerkstelligen.
B. Bij tussenvormen van scabiës heeft een arts de diagnose scabiës gesteld, maar geen scabiës crustosa kunnen vaststellen, terwijl er wel aanwijzingen zijn dat er sprake is van een verhoogde besmettelijkheid. Dit is bijvoorbeeld het geval als er iemand met een onopgemerkte scabiësinfectie recent is overleden of overgeplaatst is en er toch binnen twee weken meer dan drie bewezen secundaire scabiës gevallen zijn. In zo’n situatie is het verstandig om hetzelfde beleid als scabiës crustosa te volgen.
C. Scabiës crustosa is zeer besmettelijk. Men kan besmet raken na vluchtig contact met de patiënt (zelfs ook in dezelfde ruimte zijn als de patiënt), of na contact met besmette materialen (voorwerpen, beddengoed of kleding) (Bouvresse 2010, Hengge 2006, Koene 2016).
Veterinair
Besmettelijkheid van dieren
Voor dieren is Sarcoptes zeer besmettelijk, maar mensen worden minder makkelijk geïnfesteerd.
Diagnostiek
Zie ook Diagnostisch Vademecum Sarcoptes scabiei.
In het algemeen is een ervaren arts nodig om een mijt te vinden. Er zijn een aantal verschillende diagnostische methodes beschikbaar om de diagnose te stellen.
- Microscopisch onderzoek: de aanwezigheid van de scabiësmijt, eitjes of excreta kan bevestigd worden door microscopisch onderzoek van een preparaat van huidschraapsel. Verwijder met een lancetmesje no. 15 de bovenste huidlaag bij een papel of gangetje. Verweek eventueel de huidcellen eerst in een KOH-oplossing, leg ze onder een dekglaasje en bekijk het preparaat onder de microscoop. Onder de microscoop zijn door een ervaren persoon mijten, eitjes of fecespartikels te vinden. Door ervaren artsen kan de mijt ook met een speldenknop of naald worden gevangen uit het einde van het gangetje. Dermatoscopie kan helpen om de exacte plaats te bepalen waar de mijt zich bevindt. Als er geen mijten aantoonbaar zijn en er bij de patiënt geen typische huidafwijkingen, zoals gangetjes zichtbaar zijn, kan de diagnose scabiës niet met zekerheid gesteld worden. Scabiës crustosa is daarentegen microscopisch gemakkelijk aan te tonen: in vrijwel elke huidschilfer zijn de mijten aantoonbaar.
- Dermatoscopie: met een dermatoscoop zijn mijten soms te zien als kleine zwarte driehoekjes (V-vormen, ‘delta sign’) aan het einde van een gangetje. Voorbeelden zijn te vinden via Dermoscopedia.org/Scabies.
- Nucleic Acid Amplification Tests (NAAT) : een huidschraapsel van een op scabiës verdachte huidafwijking (bijvoorbeeld van een gebied waar het delta sign zichtbaar is) kan in een droge en steriele container opgestuurd worden naar het laboratorium voor een NAAT-test op scabiës. De sensitiviteit en negatief voorspellende waarde zijn laag en zodoende wordt de NAAT-test vooralsnog niet standaard aanbevolen. Het is van belang om te realiseren dat de NAAT-test geen actieve infectie aantoont en nog langdurig positief kan zijn na een doorgemaakte en al behandelde infectie (Fanoy 2017, Delauney 2020). De NAAT-test kan van praktisch toegevoegde waarde zijn bij een uitbraak in een instelling. Ook bij uitbraken buiten instellingen, waarbij de implicaties van behandelen groot zijn, kan een PCR-test van toegevoegde waarde zijn, als er nog geen diagnostiek heeft plaatsgevonden.
- Burrow Ink test: een eenvoudige, snelle en goedkope methode om de pathognomonische gangen zichtbaar te maken is middels inkt. Een negatieve test sluit schurft echter niet uit en verdere tests met dermatoscopie of microscopisch onderzoek van huidschraapsels zijn noodzakelijk (Rauwerdink 2023).
- UVA-lichtbron (Woodslamp): een case-series studie onderzocht een (bij toeval ontdekte) nieuwe manier om de diagnose scabiës te stellen door in vivo en in situ identificatie van gangetjes en mijten wanneer ze worden belicht met UVA-licht (365 nm). Deze procedure kan een gangetje identificeren, mogelijk efficiënter dan andere zichtbare lichtbronnen, welke zichtbaar is met het blote oog als een blauwachtig-witte lineaire luminescentie. Het lichaam van de mijt is ook te zien als een stipachtige luminescentie (wit of groen), hoewel alleen bij het bekijken van een ingezoomde foto op een normaal computerscherm (Scanni 2022). Als toekomstige studies de bruikbaarheid van deze procedure bevestigen, zal dit een belangrijke diagnostische ontwikkeling kunnen zijn.
Het advies is om bij een klinische verdenking op scabiës, zeker in zorginstellingen, met de GGD te overleggen over de methoden voor diagnostiek.
Veterinair
Microbiologische diagnostiek bij dieren
Bij gezelschapsdieren wordt microscopisch onderzoek van diepe huidafkrabsels verricht. Er zijn bij honden weinig mijten aanwezig, zodat meerdere afkrabsels nodig zijn. Notoedres cati komt bij de kat wel in grotere aantallen voor. Bij volwassen varkens zijn de mijten soms alleen bij de ingang van de oorschelp aan te tonen.
Overige diagnostiek
Bij het komen tot de diagnose scabiës zijn er een aantal aandachtspunten;
- Klinisch beeld geeft niet altijd uitsluitsel; door krabben zijn de gangetjes soms niet meer te herkennen.
- Een epidemiologische link met iemand met scabiës maakt de diagnose bij iemand met jeuk wel waarschijnlijk, maar nog niet bewezen.
- Gunstige reacties op lokale therapie kunnen niet als bewijs voor een infectie dienen. Ook kunnen schijnbaar slechte resultaten op therapie niet uitsluiten dat er wel degelijk scabiës was.
- Op epidemiologische gronden (er zijn veel mensen besmet, terwijl er weinig contact is geweest met de indexpatiënt) kan een waarschijnlijkheidsdiagnose scabiës crustosa gesteld worden.
Risicogroepen
Verhoogde kans op infectie
Er zijn drie groepen personen die een verhoogde kans hebben op infectie;
- Indien personen met een verhoogde kans op een ernstig beloop bij elkaar verblijven, bijvoorbeeld in zorginstellingen, dan is het risico op verspreiding onder personeel en bewoners groot (Van Vliet 1998, Bouvresse 2010).
- Op plekken waar meerdere personen dicht bij elkaar verblijven is er ook een verhoogde kans op infectie en verspreiding, zoals in asielzoekerscentra, gevangenissen, opvang voor dak- en thuislozen en studentenhuizen.
- Daarnaast is er een verhoogde kans op infectie bij reizigers en personen met wisselende seksuele contacten.
Arbo
Arbeidsgerelateerde risicogroepen
Beroepsgroepen met een verhoogd blootstellingsrisico voortkomend uit al dan niet intensief (zie Besmettelijkheid) contact met besmette personen of besmet beddengoed/kleding/materialen (indirecte transmissie): verloskundigen, gynaecologen, dermatologen, huisartsen, verpleegkundigen, ziekenverzorgenden, ambulancepersoneel, EHBO’ers, medewerkers linnenkamer c.q. kledingwassers, chauffeurs, zakelijke reizigers en militairen in risicogebieden, personen werkend in de seksindustrie, personen die drugs gebruiken of personen werkend op locaties waar men dicht op elkaar verblijft, zoals daklozen, asielzoekers, zeevarenden of in penitentiaire inrichtingen (KIZA, Redondo-Bravo 2021, Fiore 2021).
Veterinair
Risicogroepen veterinair
Mensen die intensief contact met dieren hebben, lopen meer risico op infestatie met dierlijke varianten van Sarcoptes.
Verhoogde kans op ernstig beloop
Er zijn drie beschermingsmechanismen tegen scabiës: (1) wassen en lichamelijke hygiëne (waardoor larven en mijten weg gewassen worden), (2) krabben (waardoor de mijten weggekrabd worden) en (3) de immuunrespons van de gastheer. Als een of meer van deze drie beschermingsmechanismen faalt, is er kans op ernstig beloop, zoals het ontstaan van scabiës crustosa (Johnston 2005, Hafner 2009, Sunderkötter 2021). Derhalve hebben de volgende patiëntgroepen een verhoogde kans op een ernstig beloop:
- Patiënten die verminderde immuunrespons hebben, bijvoorbeeld door het gebruik van immuunsuppressiva (ook corticosteroïd voor cutaan en/of systemisch gebruik) of door een afweerstoornis (bijvoorbeeld hemato-oncologische aandoeningen of hiv).
- Patiënten met lichamelijke beperkingen, zoals een parese, paralyse of arthropathie.
- Patiënten met een verstandelijke beperking of een hersenbeschadiging.
- Patiënten met chronische aandoeningen, zoals een auto-immuunziekte, diabetes mellitus, lever- en nieraandoeningen, alcohol- en druggebruik of ondervoeding.
- Patiënten met een sensorische dysfunctie van de huid, zoals bij een sensorische neuropathie.
Arbo
Medisch kwetsbare werknemers
Bij medisch kwetsbare werknemers (risicolopers) kunnen complicaties ontstaan, zoals de ontwikkeling van scabiës crustosa of een bacteriële superinfectie. Deze groep werknemers heeft onder andere ernstige pre-existente huidafwijkingen, diabetes mellitus of een hivinfectie. Daarnaast zijn er werknemers die door overige oorzaken, zoals medicatie, een verstoorde immuunrespons hebben. Om de consequenties voor deze groep werknemers goed te kunnen beoordelen, is afstemming tussen de betrokken professionals essentieel. Factoren die van belang zijn, zijn onder andere de aard en ernst van de medische aandoening, het type scabiës (gewoon versus crustosa) en de werksituatie. Het is aan de bedrijfsarts om – op maat – advies uit te brengen over aanvullende beschermende maatregelen (zie hiervoor hoofdstuk ‘maatregelen ten aanzien van werknemers’) en/of werkaanpassing.
Epidemiologie
Verspreiding in de wereld
Scabiës komt wereldwijd bij alle sociale klassen, etniciteiten en leeftijden voor. Epidemieën komen voor tijdens oorlogen, armoede, slechte hygiëne, overbevolking en seksuele promiscuïteit. Wereldwijd zijn naar schatting 150 à 200 miljoen mensen aangedaan, met een geschatte incidentie van 565 miljoen gevallen in 2019 (GBD 2016, WHO 2020, Tsoi 2021). Prevalentieschattingen van scabiës kennen een range van 0,2% tot 71%, waarbij de hoogste prevalentieschatting werd gedaan in Latijns-Amerika en Oceanië. Alle regio’s hadden een prevalentieschatting groter dan 10%, behalve het Midden Oosten en Europa (Romani 2015). Scabiës kent epidemische cycli die geschat worden op 15 jaar, waarvoor nog geen duidelijke verklaring bestaat (Hengge 2006). In landen met een gematigd klimaat is de incidentie van scabiës hoger in de winter dan in de zomer. Wellicht is dit te wijten aan ‘het dichter opeen leven’ (physical crowding) in dat seizoen en doordat de mijt in lagere temperaturen langer zonder zijn gastheer kan overleven (Heukelbach 2006).
Voorkomen in Nederland
Tijdens de Tweede Wereldoorlog en de jaren ’60 kwam scabiës vaker voor. Suboptimale leefomstandigheden en de seksuele revolutie respectievelijk zouden hiervoor als oorzaak kunnen worden gezien. Tot 1999 was er een meldingsplicht voor iedere scabiëspatiënt; er werden toen jaarlijks 1000 tot 1300 patiënten gemeld. Scabiës crustosa en scabiës in instellingen kent nog wel een meldingsplicht bij de GGD (er is echter geen nationale surveillance); er worden regelmatig scabiësuitbraken in instellingen gezien en in situaties waar meerdere personen dicht bij elkaar verblijven (zie Risicogroepen).
De laatste jaren is er een langzaam stijgende trend te zien van mensen die de huidziekte schurft oplopen. In 2014 was de incidentie van ‘scabiës en aandoeningen door andere mijten’ in de Nederlandse huisartsenpraktijk 100 gevallen per 100.000 inwoners en dit aantal nam toe tot 210 gevallen in 2019 en 260 in 2020 (Van Deursen 2022). Het aantal consulten voor scabiës bij de huisarts is sinds 2011 vervijfvoudigd (Harmans 2022). De hoogste incidentie en prevalentie ligt bij de leeftijdsgroep 19-24 jaar (Van Deursen 2022). In een ander Nederlands onderzoek werden scabiës-incidentiecijfers geschat op basis van aantal voorgeschreven scabicide middelen in combinatie met cijfers uit de huisartsendata van 2011 tot 2021. Uit dit onderzoek bleek dat de incidentie van scabiës was verdrievoudigd in tien jaar (vooral onder adolescenten en jong volwassenen) en het aantal voorgeschreven scabicide middelen was vervijfvoudigd, met een hoogtepunt in het jaar 2021 (Van Deursen 2022).
Arbo
Meldingen van beroepsgerelateerde infecties
Van 2012-2016 is jaarlijks een toenemend aantal scabiësinfecties bij het Nederlands Centrum voor Beroepsziekten (NCvB) gemeld (NCvB 2017). Dit aantal meldingen zegt weinig over het daadwerkelijk aantal voorkomende gevallen. Het NCvB heeft waarschijnlijk te maken met onderrapportage (RIVM, 2015). Vanaf 2016 daalde het aantal gemelde scabiës infecties bij het NCvB naar 0 in 2022. Tijdens de COVID-19-pandemie (2020-2023) zijn door de vele preventieve maatregelen om besmetting te voorkomen ook besmettingen door andere infectieziekten, zoals scabiës, tegengegaan. Het aantal meldingen zegt weinig over het daadwerkelijk aantal voorkomende gevallen. Het NCvB heeft te maken met onderrapportage (RIVM 2015).
Veterinair
Voorkomen in Nederland bij dieren
Hondenscabiës komt met enige regelmaat voor, vooral bij jonge honden. Notoedres cati wordt in Nederland bij katten zelden gevonden. Door gebruik van ivermectine en hygiënische maatregelen bij landbouwhuisdieren komt scabiës bij deze diersoorten in Nederland minder vaak voor dan vroeger. Bij varkens is een eradicatieprogramma ingezet, zodat Sarcoptes var. suis vrijwel niet meer op bedrijven voorkomt.
Preventie
Immunisatie
Actieve immunisatie
Er bestaat geen actieve immunisatie tegen scabiës. Omdat scabiës naast het aangeboren immuunsysteem, ook het verworven immuunsysteem activeert, is vaccinatie wel een realistisch doel. De zeldzame vaccinatie-trials die zijn uitgevoerd onder dieren zijn echter wisselend effectief, afhankelijk van adjuvantia, immunisatieschema’s, antigeen dosering en toedieningsmethode (Arlian 2017).
Passieve immunisatie
Niet van toepassing.
Veterinair
Immunisatie bij dieren
Er is voor dieren geen vaccin beschikbaar.
Algemene preventieve maatregelen
Om de kans op besmetting te verkleinen kunnen de volgende algemene adviezen bijdragen:
- Gebruik geen ongewassen kleding, handdoeken of beddengoed van een ander.
- Vermijd huidcontact met iemand die scabiës heeft.
- Slaap niet in hetzelfde bed met iemand die scabiës heeft.
- Was tweedehands kleding voor deze aangetrokken wordt (leg de kleding apart van ander wasgoed als het niet gelijk gewassen wordt).
- Gebruik op reis je eigen lakens/lakenzak.
- Draag beschermende kleding (in ieder geval lange mouwen) en handschoenen als er huid-huidcontact is met iemand die scabiës heeft.
Veterinair
Preventieve maatregelen bij dieren
Tijdens contact met dieren met scabiës kunnen handschoenen en beschermende kleding worden gedragen. Nieuwe dieren (laten) controleren op een mogelijke besmetting, voordat ze bij andere dieren worden geplaatst.
Reiniging, desinfectie en sterilisatie
Conform de richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg. Voor wasinstructies en andere hygiënevoorschriften ter behandeling en preventie van verdere bestrijding zie bijlage Behandeling en hygiënevoorschriften.
Veterinair
Reinigen en desinfecteren van dierverblijven
Naast het behandelen van het besmette dier dient ook de slaapplaats (mand en/of het hok van de hond, kattenbak etc.) na behandeling van het dier schoongemaakt te worden; deken of matje wassen op 60°C in de wasmachine of 72 uur in een goed dichtgeknoopte plastic zak bewaren op kamertemperatuur. Stofzuigen kan de infectiedruk in huis verminderen. Kleden en manden van geïnfesteerde dieren indien mogelijk wassen in de wasmachine.
Maatregelen
Meldingsplicht
- Individuele gevallen van scabiës zijn niet meldingsplichtig.
- In de context van artikel 26 zijn meldingsplichtig: een of meerdere gevallen met de diagnose of de verdenking op scabiës in instellingen voor kwetsbare personen zoals zieken, jonge kinderen, hoogbejaarden en verstandelijk beperkten (denk aan: verpleeghuizen, ziekenhuizen, verzorgingshuizen, instellingen voor verstandelijk beperkten, thuiszorginstellingen, kinderdagverblijven, scholen voor basisonderwijs en opvang voor dak- en thuislozen.).
- Voor aanmeld- en opvangcentra voor asielzoekers geldt dat scabiës alleen meldingsplichtig is als er verspreiding is in de opvang (niet bij één geval). Bij meerdere, gerelateerde gevallen, adviseert de GGD over de aanpak van de uitbraak.
Arbo
Melden als beroepsziekte
Indien de infectie (waarschijnlijk) is opgelopen tijdens de beroepsuitoefening moet dit door een geregistreerd bedrijfsarts worden gemeld bij het Nederlands Centrum voor Beroepsziekten (het NCvB) via Beroepsziekten.nl.
Veterinair
Meldingsplicht veterinair
Voor dierenartsen bestaat er geen meldingsplicht voor scabiës bij dieren.
Inschakelen van andere instanties
Bij instellingen is het raadzaam om een uitbraakteam samen te stellen, welke mensen hierin zitting kunnen nemen, kunt u lezen in de folder Scabiës in uw zorginstelling, zorg voor een juiste behandeling.
Bij scabiës crustosa is het raadzaam om specialisten van naburige verwijsinstellingen en uitzendbureaus te informeren, alsmede ontslagen patiënten/cliënten die in de incubatieperiode in de instelling met een scabiësuitbraak verbleven, maar ook zeker instellingen waar patiënten/cliënten die nog niet zijn behandeld naar zijn overgeplaatst.
Bronopsporing
Bronopsporing is van belang om de bron te identificeren en te behandelen, zodat mogelijke herinfecties of een nieuwe uitbraak kunnen worden voorkomen. Voor bronopsporing moet er geïnventariseerd worden met wie de index intensief contact heeft gehad in de periode voor het ontstaan van de klachten. Hiervoor kan er een ‘trace back’ uitgevoerd worden gedurende 6 weken voor het ontstaan van de eerste klachten bij de index. Indien de index immuungecompromitteerd is, betekent dit dat deze trace back tot 10 weken terug gaat. Denk met name ook aan contact met medewerkers, medepatiënten/cliënten en contact met overleden personen met scabiës. Als de bron een persoon is met scabiës crustosa kan het contact minder intensief zijn geweest (zie ook besmettingsweg en besmettelijkheid).
Contactonderzoek
Het doel van contactonderzoek is het opsporen van mogelijk besmette personen en het vaststellen van de behandelgroep. In deze paragraaf worden de contacten buiten de zorginstelling besproken. Voor contacten binnen zorginstellingen wordt verwezen naar de bijlagen onder ‘zorg’.
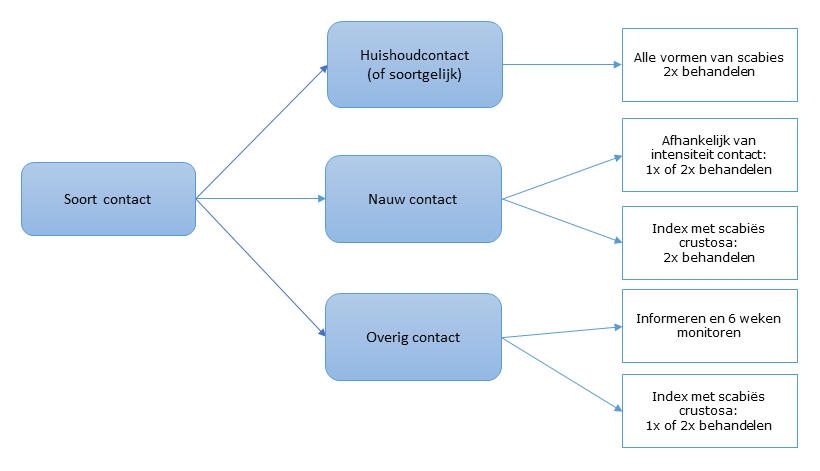
Bij gewone scabiës bestaat de behandelgroep uit mensen die langdurig (> 15 minuten) of frequent intensief huid-huidcontact met een index hebben gehad in de besmettelijke periode. Dit zijn bijvoorbeeld bedpartners, personen die lichamelijke zorg verlenen, huisgenoten of logés.
| Definitie contact | Omschrijving contacten bij gewone scabiës | Omschrijving contacten bij scabiës crustosa |
|---|---|---|
| Huishoudcontacten (of soortgelijke contacten) |
Verblijven in dezelfde leefomgeving. Bijvoorbeeld inwonende kinderen, partners, huisgenoten, seksuele contacten. |
Alle personen die genoemd worden bij gewone scabiës. |
| Nauwe contacten | Langdurig (> 15 minuten) of frequent huid-huidcontact. Denk aan logees, oppassers, speelkameraadjes, veel knuffelcontact, etc. |
Alle personen die genoemd worden bij gewone scabiës.
Ook alle personen die in dezelfde ruimte zijn geweest als de indexpatiënt met scabiës crustosa, alsmede personen die contact hebben gehad met de kleding of beddengoed van de indexpatiënt. |
| Overige contacten | Langdurig (< 15 minuten) of frequent huid-huidcontact. Denk aan huisarts of fysiotherapeut met lichamelijk onderzoek, sociale contacten met kort knuffelcontact, collega waarmee kort fysiek contact is geweest. | Maatwerk, afweging afhankelijk van blootstellingsduur en de intensiteit van het contact. |
Voor alle contacten met klachten die kunnen wijzen op scabiës, geldt de aanbeveling zich te laten onderzoeken door een deskundig arts voor de diagnose scabiës.
Bij scabiës crustosa en tussenvormen met veel mijten dient uitgebreid contactonderzoek plaats te vinden. Inventariseer alle mensen die bij de patiënt in de leefruimte zijn geweest of contact hebben gehad met diens kleding of beddengoed (bijvoorbeeld ook medewerkers van de linnenkamer), tijdens de besmettelijke periode. De besmettelijke periode start vanaf minimaal 6 weken of maximaal 10 weken bij immuungecompromitteerden (de incubatieperiode), voorafgaand aan de eerste symptomen van de index. De besmettelijke periode eindigt als een deskundig arts vaststelt dat er geen actieve scabiës-infectie meer is. Alle personen die in de bovengenoemde periode, waar frequent secundaire besmettingen optraden, en die in dezelfde leefruimte geweest zijn als de index met scabiës crustosa, of een tussenvorm, kunnen als contact worden beschouwd (zij behoren dus tot de behandelgroep). De inventarisatie van contacten kost veel tijd en de groepsbehandeling vindt om die reden pas na gemiddeld 2 weken plaats.
Kinderen
Bij samengestelde gezinnen moet er rekening gehouden worden met het overnachten van kinderen op meerdere plekken, waardoor het contactonderzoek uitgebreider kan zijn.
Maatregelen ten aanzien van patiënt en contacten
Raadpleeg bijlage Behandeling en hygiënevoorschriften voor de uitgebreide beschrijving van de middelen en de adviezen die opgevolgd dienen te worden wat betreft hygiëne- en wasinstructies. Deze bijlage omvat zowel de aanpak van gewone scabiës als scabiës crustosa.
Gewone scabiës
Bij de behandeling van scabiës is het van belang dat de indexpatiënt en alle contactpersonen gelijktijdig met een scabicide middel behandeld worden. Indien dit niet gebeurt, kunnen er direct na behandeling herbesmettingen plaatsvinden vanuit nog onbehandelde personen. Contacten in een reeds vastgestelde behandelgroep dienen op het gemeenschappelijke behandelmoment weer meebehandeld te worden, onafhankelijk van het moment waarop de vorige behandeling heeft plaatsgevonden. Bij groepsbehandeling hebben de klinische gevallen (allen een index) al vóór de groepsbehandeling uit een behandeling gehad (de eerste behandeling): zij dienen tegelijk met de contacten in de behandelgroep een tweede behandeling te krijgen. Deze collectieve behandeling kan op één dag georganiseerd te worden, bij voorkeur 7 (max. 10) dagen na de 1e behandeling. Het voorbereiden van de behandelingen en de behandelingen zelf, betreft een forse logistieke operatie. Voor aanmeld- en opvangcentra voor asielzoekers geldt bij een uitbraak een periode van monitoring gedurende 12 weken (twee maal de incubatietijd voor niet-immuungecompromitteerden).
Scabiës crustosa
De isolatie van een patiënt met scabiës crustosa en de maatregelen voor bezoekers en verzorgenden moeten gehandhaafd blijven tot het moment dat door een deskundig arts is vastgesteld dat er geen sprake meer is van scabiës crustosa. De follow-up van de patiënt en de monitoring binnen een instelling/de zorg dient 20 weken (twee maal de maximale incubatietijd) gecontinueerd te worden.
Schema behandelgroep thuis (buiten de zorginstelling)
| Soort contact | Indexpatiënt met gewone scabiës | Indexpatiënt met scabiës crustosa of tussenvorm |
|---|---|---|
| Huishoudcontacten (of soortgelijke contacten) | Allen twee keer behandelen | Allen 2 keer behandelen |
| Nauwe contacten | 1 of 2 keer behandelen (maatwerk), afhankelijk van de intensiteit van het contact en de risico-inschatting | Allen 2 keer behandelen |
| Overige contacten | Informeren en 6 weken monitoren |
1 of 2 keer behandelen (maatwerk), afhankelijk van de intensiteit van het contact en de risico-inschatting |
In een stroomschema is de behandelgroep in de thuissetting als volgt:
In het geval van scabiës crustosa wordt de index direct behandeld en wordt er niet gewacht met behandelen tot de contacten zijn geïnventariseerd. Bij gewone scabiës worden idealiter eerst alle contacten geïnventariseerd, zodat allen tegelijkertijd behandeld kunnen worden.
Voor alle contacten met klachten die kunnen wijzen op scabiës, geldt de aanbeveling zich te laten onderzoeken door een deskundig arts voor de diagnose scabiës.
Goede patiëntvoorlichting is essentieel bij een patiënt met vastgestelde scabiës, dit kan mondeling en middels online informatie. Gebruik hiervoor de meest actuele informatiebronnen via de website van het RIVM, die tevens ontwikkeld worden in diverse talen:
- Infographic wat is schurft en hoe behandel je | RIVM
- Stappenplan behandeling schurft met permetrine creme (scabiës) | RIVM
Overweeg daarnaast een soa-testen indien scabiës waarschijnlijk opgelopen is via seksueel contact waarbij kans op een soa bestaat.
Veterinair
Maatregelen bij dieren
Dieren hoeven bij humane scabiës niet behandeld te worden, maar in sommige gevallen wel uit de scabiësomgeving gehaald te worden (zie bijlage behandeling en hygiënevoorschriften).
Arbo
Maatregelen ten aanzien van werknemers in de extramurale setting
Als aan scabiës wordt gedacht bij werknemers (risicovormer) die in het werk intensief contact hebben met anderen (zoals patiënten en jonge kinderen) is snelle diagnostiek gewenst. Zolang er sprake is van (reële) verdenking op scabiës of zolang er sprake is van besmettelijkheid voor derden zal in overleg met de bedrijfsarts (en/of leidinggevende) het werk worden aangepast en/of aanvullende beschermende maatregelen worden genomen. Tenzij de werknemer scabiës crustosa heeft: in praktijk mogen er dan hooguit alleen werkzaamheden vanuit huis worden verricht totdat het risico op overdracht voorbij is.
Persoonlijke beschermingsmiddelen (PBM) zijn ter preventie van overdracht van een werknemer met scabiës naar diens omgeving (of andersom):
- disposable schorten met lange mouwen;
- disposable handschoenen;
- bovenstaande na eenmalig gebruik weggooien en vervolgens handen wassen.
Normaliter kan een zorgmedewerker (risicoloper) twaalf uur na een eerste adequate behandeling van patiënten met een gewone scabiës de patiëntenzorg uitoefenen zonder PBM. Uiteraard onder voorwaarde dat de tweede behandeling op dag acht ook correct wordt uitgevoerd.
Er zijn enkele situaties waarin wel wordt geadviseerd PBM te dragen door zorgmedewerkers tijdens de patiëntenzorg:
- In woon- en verblijfsvoorzieningen waar een uitbraak gaande is (meerdere gevallen van gewone scabiës): PBM gebruik bij patiënten in de behandelgroep tot 12 uur na de tweede groepsbehandeling.
- Indien het om een patiënt gaat met scabiës crustosa: PBM-gebruik door zorgmedewerkers op de afdeling tot het moment dat door een deskundig arts is vastgesteld dat er geen sprake meer is van scabiës crustosa.
Doordat een scabiësuitbraak in een woon- en verblijfsvoorziening in de meeste gevallen impact heeft op werknemers (als risicoloper en risicovormer) is het toevoegen van de bedrijfsarts aan het uitbraakteam gewenst.
Overweeg om medisch kwetsbare werknemers preventief niet in te zetten bij de zorg voor patiënten met scabiës waarbij door andere factoren een verhoogd risico is op overdracht (bijv. bij onrustige/slecht instrueerbare patiënten).
Wering van werk, school, kinderdagverblijf of consultatiebureau
Niet van toepassing.
Arbo
Wering van werk
Overleg voor het beleid ten aanzien van werknemers die zelf scabiës hebben met de bedrijfsarts. Bij werknemers waarbij preventieve behandeling niet mogelijk is of die behandeling kunnen weigeren (in overleg met de bedrijfsarts) voor een periode van zes weken naar ander / aangepast werk gezocht worden. Dit geldt voor mensen die zich in de monitorfase bevinden.
Door krabben kunnen huidirritaties en -infecties ontstaan. In het algemeen zullen deze mild verlopen en zal dit niet leiden tot verzuim of beperkte inzetbaarheid. Er zijn af en toe werknemers die naar aanleiding van scabiës angstig worden en hierdoor minder belastbaar zijn. De zorgbelasting van een scabiës uitbraak kan ook een forse toename van werkdruk geven bij zorgpersoneel, wat op zichzelf weer een risico is voor het ontstaan van burn-out (Hessels 2019). In Spanje blijken besmette werknemers gemiddeld 6 dagen thuis te blijven van werk (Redondo-Bravo 2021).
Profylaxe & Behandeling
Profylaxe
Bij huishoud- en nauwe contacten (zonder klachten) is profylactische behandeling geïndiceerd. Zie bijlage Behandeling en hygiënevoorschriften.
Behandeling
Zie bijlage Behandeling en hygiënevoorschriften voor uitgebreide informatie over de behandeling, inclusief kinderdosering.
Aangepast beleid
In sommige gevallen vraagt een uitbraak onder een specifieke doelgroep, of in een specifieke context, om een aangepast beleid. De verantwoordelijkheid voor het aangepaste beleid ligt bij de GGD en wordt gedeeld met de ketenpartners die het uitvoeren. Het bestrijden van uitbraken van scabiës vraagt om maatwerk.
Grote uitbraken kunnen zich voordoen in specifieke populaties, zoals onder studenten en asielzoekers. Het is belangrijk dat er bij dergelijke grote uitbraken bij een aantal personen met klachten diagnostiek moet zijn ingezet. Indien bewijzend voor scabiës, hoeft niet bij elk contact met bij scabiës passende klachten diagnostiek te worden ingezet.
Vervolgens wordt het behandelbeleid aangepast aan de specifieke situatie. Bijvoorbeeld:
- een scabiësbehandeling voor iedereen met bij scabiës passende klachten in combinatie met het behoren tot een specifieke groep waar de uitbraak is.
- een scabiësbehandeling van alle binnenkomende asielzoekers uit een specifiek land, nadat is vastgesteld dat een groot aantal van hen scabiës heeft.
Veterinair
Behandeling bij dieren
Dieren moeten met passende middelen onder toezicht van een dierenarts worden behandeld om mijten te elimineren. Pas als deze bron van besmetting is weggenomen, houden de klachten bij mensen op. In zeldzame gevallen houden mensen ondanks behandeling van alle aanwezige dieren langdurig klachten. Een enkele keer kan het dan nodig zijn deze mensen te behandelen tegen dierlijke Sarcoptes-mijten. Contactpersonen van mensen die met animale scabiës zijn besmet, hoeven niet te worden behandeld.
Historie
Scabiës (schurft) bij de mens komt al van oudsher voor. De aandoening wordt aangetroffen in Bijbelse teksten en werd al voor de jaartelling door Aristoteles (384-323 A.C.) beschreven (Thyresson 1994, De Schrijver 1999). In 1634 verscheen het boek Insectorum Theatrum van Thomas Moffett, waarin één van de eerste beschrijvingen van de mijt staan (Jackson 2004, Selwyn 1976). De scabiësmijt werd in 1687 door Bonomo in Italië beschreven en getekend. Tot 1999 was er een aangifteplicht voor iedere patiënt met scabiës. Er werden jaarlijks 1000 tot 1300 patiënten gemeld. Daarna was volgens artikel 7 van de Infectieziektewet 3 of meer mogelijke of bewezen gevallen van scabiës of één geval van scabiës crustosa in zorginstellingen meldingsplichtig. Sinds 1 december 2008 geldt een meldingsplicht voor scabiës crustosa en scabiës in instellingen op basis van artikel 26 van de Wet publieke gezondheid.
Literatuur
- Andrews RMM, McCarthy J, Carapetis JR, Currie BJ. Skin disorders, including pyoderma, scabies, and tinea Infections. Pediatric Clinics of North America 2009;56:1421-1440
- Argenziano G, Ferrara G, Francione S, Di Nola K, Martino A, Zalaudek I. Dermoscopy--the ultimate tool for melanoma diagnosis. Seminars in Cutaneous Medicine and Surgery 2009;28:142-148.
- Ariza L, Walter B, Texier N, et al. Quality of life of scabies patients: a cross-sectional study in a health center in the Republic of the Congo. J Eur Acad Dermatol Venereol. 2018;32(12):e445-e447.
- Arlian LG, Morgan MS. A review of Sarcoptes scabiei: past, present and future. Parasit Vectors. 2017 Jun 20;10(1):297.
- Bellissimo-Rodrigues F, Silva MF, de Souza RP, de Tarso de Oliveira e Castro P. Alcohol-based hand rub and nosocomial scabies. Infection Control & Hospital Epidemiology 2008;29:782-783
- Bernigaud C, Fernando DD, Lu H, Taylor S, Hartel G, Chosidow O, Fischer K. How to eliminate scabies parasites from fomites: A high-throughput ex vivo experimental study. J Am Acad Dermatol. 2020 Jul;83(1):241-245.
- Betti S, Bassi A, Prignano F, Lotti T. Scabies: should we always perform dermatoscopy? Giornale Italiano di Dermatologia e Venereologia 2009;144:313-315
- Bhat SA, Mounsey KE, Liu X, Walton SF. Host immune responses to the itch mite, Sarcoptes scabiei, in humans. Parasit Vectors. 2017 Aug 10;10(1):385.
- Bouvresse S, Chosidow O. Scabies in healthcare settings. Current Opinion in Infectious Diseases 2010;23:111-118.
- Chosidow O. Clinical practice- Scabies. New England Journal of Medicine 2006;354:1718-1727
- Chosidow O. Scabies and pediculosis. The Lancet 2000;355:819-826
- Currie BJ, Harumal P, McKinnon M, Walton SF. First documentation of in vivo and in vitro ivermectin resistance in Sarcoptes scabiei. Clinical Infectious Diseases 2004;39:e8-12.
- Currie BJ, McCarthy JS. Permethrin and ivermectin for scabies. New England Journal of Medicine 2010;362:717-725.
- De Schrijver K, Tilborghs G. Scabies terug van weggeweest. Vlaams Infectieziektebulletin 1999;3.
- Delaunay P, Hérissé AL, Hasseine L, Chiaverini C, Tran A, Mary C, Del Giudice P, Marty P, Akhoundi M, Hubiche T. Scabies polymerase chain reaction with standardized dry swab sampling: an easy tool for cluster diagnosis of human scabies. Br J Dermatol. 2020 Jan;182(1):197-201.
- Dupuy A, Dehen L, Bourrat E, Lacroix C, Benderdouche M, Dubertret L, et al. Accuracy of standard dermoscopy for diagnosing scabies. Journal of the American Academy of Dermatology 2007;56:53-62.
- Fanoy E. et al. Scabiës-PCR bij uitbraken binnen zorgorganisaties, Infectieziekten Bulletin 2017; 10: 391-396.
- Farmacotherapeutisch Kompas
- Fiore V, De Vito A, Martineková P, Princic E, Geremia N, Madeddu G, Babudieri S. Infectious diseases screening approach among refugees: results from a single-center study. J Infect Dev Ctries. 2021 Jun 30;15(6):847-852.
- GBD 2015 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016 Oct 8;388(10053):1545-1602.
- Goyal NN, Wong GA. Psoriasis or crusted scabies.Clinical & Experimental Dermatology 2008;33: 211-212.
- Hafner C, Meurer M, Szeimies RM , redactie. Der Hautartzt. Springer Medizin Verlag 2009; 60: 145-161
- Harmans L. De huisarts ziet steeds vaker scabiës. Ned Tijdschr Geneeskd 2022;166:C5053.
- Hengge UR, Currie BJ, Jäger G, Lupi O, Schwartz RA. Scabies: a ubiquitous neglected skin disease. The Lancet Infectious Diseases 2006;6:769-779.
- Hessels AJ, Kelly AM, Chen L, Cohen B, Zachariah P, Larson EL. Impact of infectious exposures and outbreaks on nurse and infection preventionist workload. Am J Infect Control. 2019 Jun;47(6):623-627.
- Heukelbach J, Feldmeier H. Scabies. Lancet 2006;367: 1767-1774
- Jackson R. Scabies by Kenneth Mellanby. J Cutan Med Surg 2004: 73-76
- Johnston G, Sladden M. Scabies: diagnosis and treatment. British Medical Journal 2005;331:619-622.
- Karthikeyan K. Scabies in children. Arch Dis Child Educ Pract Ed. 2007 Jun;92(3):ep65-9.
- Kemperman PMJH, Vos MHE, et al. Post-scabiës jeuk: een overzicht van oorzaken en behandelingsstrategieën. NTvG, accepted.
- Koene RP, Tjioe M, Hoondert K, van de Vrie W, Olde Rikkert MG, Wulfen M, Voss A. Uitbraak van scabiës in i ziekenhuis en 8 zorginstellingen door een geriatrische patiënt met scabies crustosa. Ned Tijdschr Geneeskd. 2006 Apr 22;150(16):918-23.
- Liu JM, Wang HW, Chang FW, et al. The effects of climate factors on scabies A 14-year population-based study in Taiwan. Parasite. 2016;23
- Monsel G, Chosidow O. Management of Scabies 2012;17(3)
- Mounsey KE, Holt DC, McCarthy J, Currie BJ, Walton SF. Longitudinal evidence of increasing in vitro tolerance of scabies mites to ivermectin in scabies-endemic communities. Archives of Dermatology 2009;145:840-841
- Mounsey KE, Holt DC, McCarthy J, Currie BJ, Walton SF. Scabies: Molecular perspectives and therapeutic implications in the face of emerging drug resistance. Future Microbiology 2008;3:57-66.
- Mounsey KE, Holt DC, McCarthy J, Walton SF . Identification of ABC transporters in Sarcoptes scabiei. Parasitology 2006;132:883-892.
- NCvB. Kerncijfers beroepsziekten 2017, https://www.beroepsziekten.nl/sites/default/files/documents/NCvB_Kerncijfers2017def5.pdf 2017; 19:33-34.
- Oh S, Van der Griff T. Scabies of the nail unit. Dermatol Online J 2014, Oct 15;20(10).
- Rauwerdink D, Balak D. Burrow Ink Test for Scabies. N Engl J Med. 2023;389(7):e12.
- Redondo-Bravo L, Fernandez-Martinez B, Gómez-Barroso D, Gherasim A, García-Gómez M, Benito A, Herrador Z. Scabies in Spain? A comprehensive epidemiological picture. PLoS One. 2021 Nov 1;16(11):e0258780.
- Romani L, Steer AC, Whitfeld MJ, Kaldor JM. Prevalence of scabies and impetigo worldwide: a systematic review. Lancet Infect Dis. 2015 Aug;15(8):960-7.
- Scanni G. Facilitations in the Clinical Diagnosis of Human Scabies through the Use of Ultraviolet Light (UV-Scab Scanning): A Case-Series Study. Trop Med Infect Dis. 2022;7(12):422.
- Scheinfeld N. Controlling Scabies in institutional settings: A review of medications, treatment models, and implementation. American Journal of Clinical Dermatology 2004;5:31-37.
- Scott GR, Chosidow O. European guideline for the management of scabies. 2010
- Selwyn S. Dr Thomas Moffett and the sixteenth century origins of medical microbiology. Proc.Roy.Soc.Med 1976;69:32.
- Smith EV, McClure P, Laliotis AT, Repiso Ortega A, Fischer K. Scabies and mental health: a scoping review. Dermatol Ther (Heidelb). 2019;9(4):679-690.
- Sonder GJ, van Ouwerkerk IM. Hardnekkig probleem met scabies in Amsterdam: resistentie tegen lindaan en ivermectine? Infectieziektebulletin 2008;6:204-206
- Strong M, Johnstone P. Interventions for treating scabies [Review]. 2009 Cochrane Database of Systematic Reviews.
- Sunderkötter C, Wohlrab J, Hamm H. Scabies: Epidemiology, Diagnosis, and Treatment. Dtsch Arztebl Int. 2021 Oct 15;118(41):695-704.
- Sweitzer SE,Winer LH. Norwegian scabies. Arch Derm Syphilol 1941;43:678-81.
- Thyresson N. The remarkable debate during the beginning of the nineteenth century concerning the aetiology of scabies. Sydsven Medicinhist Sallsk Arsskr 1994;31:79-90.
- Tjioe M, Vissers WHPM. Scabies outbreaks in nursing homes for the elderly: recognition, treatment options and control of reinfestation. Drugs Aging 2008;25:299-306.
- Tsoi SK, Lake SJ, Thean LJ, et al. Estimation of scabies prevalence using simplified criteria and mapping procedures in three Pacific and southeast Asian countries. BMC Public Health 2021;21:2060.
- Van den Hoek JA, van de Weerd JA, Baayen TD, Molenaar PM, Sonder GJ, van Ouwerkerk IM. A persistent problem with scabies in and outside a nursing home in Amsterdam: indications for resistance to lindane and ivermectin. Euro Surveillance 2008;13:1-2.
- Van Deursen B, Hooiveld M, Marks S, Snijdewind I, van den Kerkhof H, Wintermans B, Bom B, Schimmer B, Fanoy E. Increasing incidence of reported scabies infestations in the Netherlands, 2011-2021. PLoS One. 2022 Jun 24;17(6):e0268865.
- van Vliet JA, Samsom M, van Steenbergen JE. Oorzaken van verspreiding en terugkeer van scabiës in gezondheidszorginstellingen; literatuuranalyse van 44 epidemieën. Nederlands Tijdschrift voor Geneeskunde 1998;142:354-357.
- Walton SF et al. Increased allergic immune response to Sarcoptes scabiei antigens in crusted versus ordinary scabies. Clin and Vaccine Immunology. 2010: 1428-1438.
- Walton SF, Currie BJ. Problems in diagnosing scabies, a global disease in human and animal populations. Clinical Microbiology. 2007;20:268-279.
- World Health Organization. Scabiës. WHO 2020. Geraadpleegd 2023 op: https://www.who.int/news-room/fact-sheets/detail/scabies.